利用脫細胞血管基質體外構建小口徑組織工程血管
武欣,谷涌泉,段紅永,陳兵,李建新,吳英鋒,張淑文,汪忠鎬,張建
(首都醫科大學宣武醫院血管外科,北京 100053)
利用脫細胞血管基質體外構建小口徑組織工程血管
武欣,谷涌泉,段紅永,陳兵,李建新,吳英鋒,張淑文,汪忠鎬,張建
(首都醫科大學宣武醫院血管外科,北京 100053)
目的 探討利用犬的間充質干細胞誘導分化種子細胞,以異種脫細胞血管基質為基礎體外構建小口徑血管移植物。方法 采用密度梯度離心和貼壁培養的方法從犬骨髓中分離出間充質干細胞并體外培養,誘導分化成內皮樣細胞和平滑肌樣細胞;采用非離子型去垢劑和胰蛋白酶去除豬頸動脈血管壁結構細胞,對脫細胞基質進行組織學、力學檢測及孔隙率評估。在生物反應器內采用旋轉種植的方法將犬骨髓間充質干細胞誘導的內皮樣細胞種植到脫細胞基質上,體外構建小口徑組織工程血管。結果 犬的骨髓間充質干細胞體外能夠定向誘導分化為平滑肌樣細胞和內皮樣細胞,可以作為血管組織工程的種子細胞。經過脫細胞處理后,光鏡和電鏡觀察證實血管壁的細胞成分完全去除。具有良好的孔徑和孔隙率。支架在生物力學、孔隙率等方面符合構建組織工程血管支架的要求。在生物反應器內剪切力條件下可以初步構建出組織工程血管。結論 小口徑血管移植物可以將間充質干細胞誘導種子細胞,以異種脫細胞血管支架作為基質,在搏動性生物反應器內培養的方法進行構建。
間充質干細胞;脫細胞;支架;生物反應器;組織工程
血管疾病是世界上發病率最高的疾病之一,其主要的治療手段就是血管移植術。目前,血管移植術的主要適應證有:晚期的動脈粥樣硬化性疾病、血管瘤性疾病、血管先天缺陷性疾病和創傷等。因此血管移植物的來源就成為人們關注的重要課題。目前臨床上應用的血管移植物主要有三個來源:①自體血管;②異體血管;③人工材料。自體血管,包括大隱靜脈和內乳動脈,組織相容性好,無免疫排異反應,仍是血管移植物的“金標準”。但是動脈血管的供體有限,靜脈血管舒縮性差,易于形成血栓及血管瘤,靜脈或動脈的取材部位留下創口,形成二次創傷,因此其臨床應用受到限制。異體血管包括異種血管和同種血管。異種血管來源雖然豐富,但移植后會產生強烈的超急性免疫排異,致使血管壁增生、血栓形成而使移植血管腔閉塞。同種血管存在供體不足及免疫排斥反應的問題。人工血管移植物對于小口徑動脈移植的長期通暢率也不是十分滿意。所有這些原因,使我們意識到臨床需要小口徑血管替代物的重要性。
組織工程學的興起為從根本上解決以上問題帶來了新的曙光。1987年美國國家科學基金會正式提出和確定組織工程這一概念[1],核心是利用細胞生物學和工程學原理,在體外培養、擴增種子細胞,種植于生物相容性好、并可降解的生物材料上,形成細胞—生物材料復合物,植入體內與宿主組織融合生長,以達到對宿主組織結構的修復和功能重建。
本研究采用以去垢劑和胰蛋白酶聯合的脫細胞方法制備的脫細胞血管基質作為支架,以從犬骨髓分離培養的間充質干細胞誘導分化的內皮樣細胞作為種子細胞,并在搏動性生物反應器內培養的方法進行構建。
1 材料與方法
1.1 種子細胞的培養與鑒定
1.1.1 犬的骨髓間充質干細胞分離培養:取健康成年雜種犬,由北京市科宇實驗動物養殖中心提供[SCXK(京)2000-0015,動物飼養級別 1 級],雌雄不限,平均體質量在(15±1.5)kg左右。速眠新II注射液和安定注射液1∶1混勻肌內注射麻醉后。無菌條件下,以肝素預潤的16號骨穿針穿刺髂前上棘,抽取骨髓10 mL。加入肝素抗凝(每毫升骨髓加入肝素100 U),以等體積的PBS充分混勻,4℃條件下轉入離心管中,取20 mL淋巴細胞分離液(Ficoll,1.077 g/L,Sigma),將稀釋骨髓按1∶1小心加在分離液的界面上。用水平離心機以1500 r/min離心30 min后,取中層云霧狀單個核細胞層,加PBS反復離心洗滌3次,每次2000 r/min離心5 min。將分離的單個核細胞按1×104/cm2密度接種于預先用明膠(0.2%)襯底的 25 cm2培養瓶,用含有 LG-DMEM和FBS(比例為9∶1)混勻培養液懸浮,置于37℃、5%CO2飽和濕度的細胞培養箱內培養。
1.1.2 犬的骨髓間充質干細胞誘導分化為內皮樣細胞和平滑肌樣細胞:將分離的骨髓單個核細胞分別按1×104/cm2密度接種于預先用明膠(0.2%)襯底的25 cm2培養瓶,內皮樣細胞以內皮樣細胞誘導培養液 EBM-2培養液(Lonza,包含 5% FBS、VEGF、hFGF-b、IGF-1、hEGF、hydrocortisone 和ascorbic acid)懸浮,平滑肌樣細胞以誘導培養基(DMEM培養液含 10%的胎牛血清、PDGF-BB 5 μg/L、TGF-β1 2 μg/L、IGF-1 5 μg/L、100 U/mL 青霉素、100 g/L鏈霉素)重懸,置于37℃、5%CO2飽和濕度的細胞培養箱培養,48 h后輕輕換液棄去未貼壁細胞,以后每隔2 d更換培養液。待細胞生長至80%~90%匯合時,以0.25%胰蛋白酶和0.02%EDTA混合消化液消化,傳代培養。每天倒置相差顯微鏡下觀察細胞的形態特征。
1.1.3 誘導分化的內皮樣細胞、平滑肌樣細胞免疫化學鑒定:免疫熒光鑒定方法為把誘導的內皮樣細胞、平滑肌樣細胞以1×104/cm2的密度接種于24孔板內,隔日換液。每天在倒置相差顯微鏡下觀察細胞的形態特征。36 h待細胞達到完全貼附后進行鑒定。內皮樣細胞進行 CD31和 VIII因子(1∶200)特異性抗體鑒定,平滑肌樣細胞則進行 α-SMA(1∶400)、SMMHC(1∶500)特異性抗體鑒定。
1.2 脫細胞基質的制備與檢測
1.2.1 脫細胞基質的制備:脫細胞方法基于Kaushal等[2]所描述的方法,并對其進行了部分改進。具體為:將獲得的豬頸血管放在蒸餾水中1 h,以去除血液成分。然后將血管放入到含0.25%胰蛋白酶及0.02%EDTA(Sigma)中37℃恒溫水槽處理6 h,然后將血管放入到含有 1% Triton X-100(Sigma)和0.1%氨水的PBS中,放置于脫色搖床上(30 r/min),4℃條件下振蕩處理72 h。每日更換脫細胞溶液。
1.2.2 組織學觀察:取新鮮的豬頸動脈和制備得到的血管脫細胞基質,用4%甲醛固定,石蠟包埋后切片以進行蘇木精-伊紅(HE)染色、Masson三色法檢測胞外基質結構的完整性。
脫細胞血管基質,用2%戊二醛固定后,用無菌PBS沖洗3遍后,凍干抽真空。標本送檢北京師范大學電鏡測試中心,進行掃描電鏡檢查,觀察脫細胞基質的脫細胞效果和孔徑大小。
1.2.3 爆破強度與縫合強度檢測:將脫細胞血管基質標本進行移植前的力學性能檢測,包括爆破強度(burst strength)、縫合強度,并與正常豬的頸動脈進行對照。
1.2.4 孔隙率檢測:新鮮豬頸動脈及脫細胞血管基質標本經真空凍干后進行孔隙率檢測。孔隙率測定采用Autopore IV 9510壓汞儀,壓力范圍0.5~6000 Pa。測試樣本包括3組脫細胞血管和正常豬的頸動脈作為對照。
1.2.5 脫細胞基質組織膠原含量測定:膠原是細胞外基質(extracellular matrix,ECM)的主要蛋白質成份,約占機體總蛋白的 25%。羥脯氨酸(hydroxyproline,HYP)為非必需氨基酸,是構成膠原組織主要成分,含量相對穩定,約占膠原氨基酸總量的10%,是衡量組織膠原含量的特異性指標之一[3]。因此,測定HYP的量能確定組織中膠原的含量。我們采用胃酶酸解法對脫細胞三組樣本(每組3個樣本)與自然正常豬的頸動脈(3個樣本)進行了測試。
1.3 生物反應器下脫細胞支架內皮細胞的動態種植
將脫細胞支架材料用75%酒精浸泡1 h消毒后,用無菌PBS沖洗浸泡3遍,每次1 h,以去除消毒酒精。將消毒好的脫細胞支架置于無菌離心管內,用EBM-2培養液浸泡12 h。將消化計數好的誘導分化的內皮細胞按照1×105/cm2的密度將細胞懸液注入到管狀支架的腔內,兩端封閉。置入培養箱內旋轉種植3 h,轉速為5~6 r/h。灌流液體選用EBM-2培養液,通過調節蠕動泵轉速調節流量,進而調節反應器的剪切力。采用逐漸增加剪切力的方式,1 d內逐漸將剪切力由 1 dyn/cm2增加至 10 dyn/cm2,然后在10 dyn/cm2剪切力條件下繼續培養2 d。同時以在脫細胞支架上靜態培養3 d的內皮細胞的血管支架作為對照。標本取材,留取 HE染色和掃描電鏡檢查樣本。
1.4 統計學分析
2 結果
2.1 誘導分化種子細胞的結果
分離獲得的骨髓MSCs經培養液培養后,培養48 h,可見貼壁細胞呈集落樣生長,細胞呈長梭形、三角形、紡錘形或不規則形,核分裂相明顯。此后,細胞生長迅速,集落邊緣細胞呈紡錘形近似單層生長,集落中心則細胞密集呈復層生長。誘導內皮樣細胞加EBM-2完全培養基誘導培養24 h后,牢固貼附在培養瓶底,初為圓形或橢圓形,多呈小團集落存在,24 h后牢固貼附在培養瓶底。培養2~3 d細胞生長迅速,集落增大,并開始匯合形成排列較疏松的單細胞,此時細胞較大,有明顯的橢圓形核,常有2~5個核仁。6~8 d完全匯合形成連續的單層細胞,匯合成片后外觀呈“鵝卵石”樣形態。誘導的血管平滑肌樣細胞多數呈圓形。接種于培養瓶中約4 h貼壁,培養24 h后,可見細胞呈三角形或梭形,有少量突起;3 d細胞開始增殖;7 d左右細胞密集,呈峰谷樣生長。平滑肌細胞有一卵圓形或圓形明亮的核,核中有1~4個大小不一深色的核仁,細胞質豐富,含少量顆粒。細胞逐漸伸展,透明度增高,周界不清,突起相互接觸,平等排列成束,密集與稀疏處相互交錯成“峰谷”狀。
內皮樣細胞、平滑肌樣細胞的免疫熒光鑒定:內皮樣細胞VIII因子,CD31染色陽性,著色位于細胞核周圍,誘導分化的內皮細胞呈陽性(圖1,彩插2);平滑肌樣細胞 α-actin、calponin及 SMMHC染色陽性(圖2見彩插2,圖3見彩插3)。
2.2 脫細胞支架
2.2.1 形態:形態學觀察:豬頸動脈經脫細胞處理后外觀呈乳白色,外表面呈微絨毛狀,管壁彈性良好無塌陷,管腔內表面光滑。
2.2.2 脫細胞支架檢測:組織切片的HE染色結果表明,豬頸血管的細胞的破裂,支架中已經沒有可見核染,細胞成分被完全清除。胰酶處理6 h,細胞基質的結構有所破壞,內彈力板部分斷裂。隨后的Masson染色結果也表明,基質中藍染的膠原纖維結構完整,紅色的細胞成分基本被除,同時以自然豬的頸動脈作為對照進行HE、Masson染色(圖4、5,彩插3)。掃描電鏡結果表明脫細胞基質內膜面沒有內皮細胞及其殘余成分,胰酶處理6 h,內彈力板可見大小不等孔隙,橫切面可見脫細胞基質為疏松多孔結構,孔徑最大平均為99.2 μm(圖6)。

圖6 脫細胞基質內膜面(a)與側面掃描電鏡(b)Fig.6 SEM appearance of decellularized arterial matrix.a.The intimal surface;b.the lateral surface.
2.2.3 生物力學檢測:①爆破強度:為了了解自體活組織管是否具有足夠的強度能夠耐受生理的張力,我們進行爆破強度檢測,以了解該材料破裂前所能承受的最大壓力。對5根脫細胞基質進行了測試,5根未處理的自然頸動脈作為對照。統計學分析,采用獨立樣本t檢驗,與自然血管比較,脫細胞基質爆破強度P值為 0.073(P>0.05),兩者爆破強度無統計學差異。②縫合耐受強度:每個標本測試3次,對5根脫細胞基質進行了測試,5根未處理的自然頸動脈作為對照,每組結果以均數±標準差(±s)表示。兩者的強度接近(P>0.05),提示本組活組織生物管具有足夠的可縫合強度,能夠耐受在體的端端吻合操作。見表1。
表1 脫細胞基質和自然血管的力學與膠原含量測定比較(±s)Tab.1 Comparison of the mechanical properties and collagen content of decellularized arterial matrix and natural artery
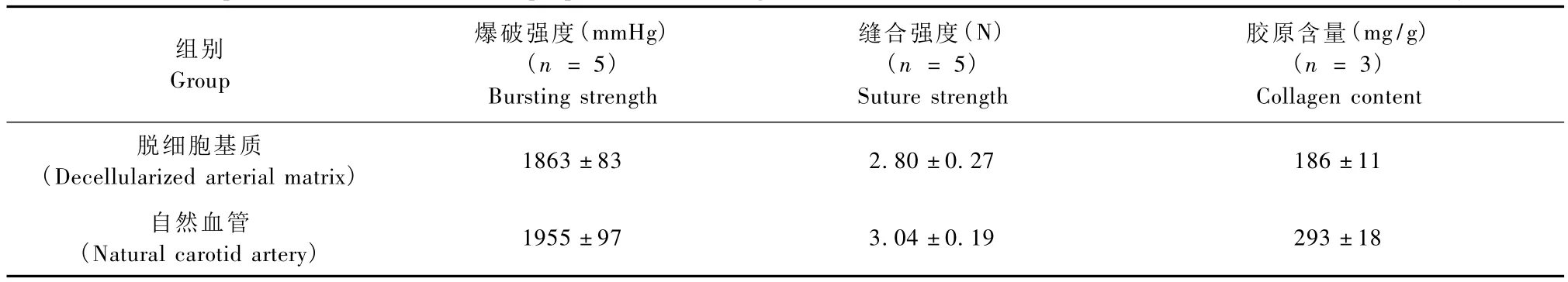
表1 脫細胞基質和自然血管的力學與膠原含量測定比較(±s)Tab.1 Comparison of the mechanical properties and collagen content of decellularized arterial matrix and natural artery
Collagen content脫細胞基質(Decellularized arterial matrix)膠原含量(mg/g)(n=3)組別Group爆破強度(mmHg)(n=5)Bursting strength縫合強度(N)(n=5)Suture strength 1863±83 2.80±0.27 186±11自然血管(Natural carotid artery)1955±97 3.04±0.19 293±18
2.2.4 脫細胞基質膠原含量測定:取脫細胞基質3個樣本與自然血管3個樣本,進行了組織動脈HYP(膠原)含量測定,從而計算出動脈支架的膠原含量數值[3]。膠原含量與自然血管均有明顯統計學差異(P<0.001)。統計學分析,采用獨立樣本 t檢驗,與自然血管比較,脫細胞基質爆破強度P值為0.073,縫合強度三組 P值為 0.064,二者均 P >0.05。膠原含量與自然血管均有明顯統計學差異(P<0.001)。見表1。
2.2.5 孔隙率的檢測:自然血管的孔隙率為64.2%,脫細胞基質的孔隙率為94.93%。
2.3 反應器下組織工程血管構建
血管脫細胞基質旋轉種植3 h后反應器動態培養3 d,HE染色可見脫細胞基質內表面整齊排列一層有核細胞形態(圖7,彩插3);掃描電鏡結果可見基質的管腔面基本為種植的EC覆蓋,部分細胞伸展入基質內彈力層,細胞伸展,排列方向與培養液流動方向一致。相同密度的內皮細胞靜態種植3 d后的掃描電鏡可見細胞貼附在基質的管腔面生長,成片狀,細胞排列雜亂(圖8)。

圖8 靜態種植(a)與(b)體外構建內膜面掃描電鏡Fig.8 SEM appearance of the inner surface of the grafts.a.static cultivation;b.in vitro construction
3 討論
隨著各種直徑大小的血管移植物在胸心外科手術中的應用,血管移植物的研究成為人們關注的熱點。目前對小口徑血管移植替代物臨床需要很大,但可供使用的小口徑替代物又十分缺乏,因此研制一種優良的小口徑血管替代品就顯得特別迫切[4]。
組織工程學是近年來研究的一個熱點領域[5],有望解決臨床小口徑移植物短缺的問題[4]。血管組織工程研究的主要內容集中在三個方面:① 種子細胞的培養與生長;② ECM替代物;③組織工程血管三維培養技術的研究。
血管組織工程所應用的種子細胞包括內皮細胞、平滑肌細胞和成纖維細胞。內皮細胞覆蓋于血管的內表面,呈單層排列,并能分泌多種血管活性因子如內皮素、前列腺素、一氧化氮(NO)等,具有抑制血小板聚集、抗血栓形成及抗內膜增生的作用[6],從而保持血管的穩定性。雖然自體來源的血管細胞獲取和培養技術都已經較為完善,但是限于個體差異,并非所有患者都有合適的自體靜脈可供選擇,獲取的細胞數量,細胞活力也因人而異。最主要的問題是體外培養和構建的時間過長,難以滿足急癥患者的需要。并且患者如果并存有動脈硬化或糖尿病時,往往自體來源的內皮細胞存在功能低下的問題,其分裂增殖的能力和分泌細胞因子的能力均下降[7]。
間充質干細胞 (mesenchymal stem cell,MSC)是組織中多能干細胞的混合體,具有來源廣泛、取材方便、分化較容易、可分化的組織類型廣泛等優點,因而在組織工程方面具有廣闊的應用前景。
本實驗應用密度梯度離心法聯合貼壁培養的方法,成功誘導分離了犬的骨髓間充質干細胞,并進行了傳代培養。內皮誘導培養基為 EBM-2完全培養基,平滑肌細胞培養基是含有 PDGF-BB,TGF-β1,IGF-1特定誘導培養基,成功誘導分化成內皮樣細胞和平滑肌樣細胞,并表現了其特有的細胞形態。誘導分化的內皮細胞樣細胞和平滑肌細胞樣細胞經過特定的細胞鑒定,CD31和VIII因子在誘導的內皮細胞樣細胞均呈明顯陽性表達,α-SMA、calponin和SM-MHC在誘導的SMCs的也呈明顯陽性表達。
ECM的研究仍是目前研究的重點。脫細胞的異種或同種異體的血管作為小口徑組織工程血管具有以下優點:①生物來源的材料,生物相容性大大提高;②可生物降解性,允許受者自身組織的重建:③細胞成分被除去,免疫原性大大降低,炎癥反應發生的幾率也大大降低;④胞外基質結構保持完整,機械強度較高,同時脫細胞基質相當于合成材料有利于細胞的生長[8]。
本研究采用Kaushal 2001年Nature雜志發表論文的脫細胞基本方法選用酶消化法和非離子去垢劑聯合處理,對豬的頸動脈進行脫細胞處理[3]。傳統的胰酶處理1 h,Triton X-100和氨水處理72 h,此方法我們發現,脫細胞效果明確,ECM完整,但是獲得的脫細胞基質的孔徑與孔隙率不足,實驗發現,胰酶處理1 h,其孔隙率為65%,孔徑為54 μm,無法滿足種子細胞種植(尤其是平滑肌細胞種植)的要求。我們采取了不同的探索,如何在保障脫細胞基質適當力學強度的前提下,盡量增大脫細胞基質的孔徑。最后我們選擇胰酶處理6 h作為時間切入點,實驗觀察,ECM中無細胞成分,脫細胞的支架結構基本完整,組織學切片觀察,內彈力板部分破壞,掃描電鏡檢測可見內彈力膜有大小不等的孔洞,獲得的ECM的最大孔徑99.2 μm,孔隙率是94.93%。雖然脫細胞基質的膠原含量有所下降,但隨后生物力學檢測,其縫合強度與爆破強度相對于自然血管雖略有降低,但統計學無顯著性差異。
在血管生長發育過程中,血流動力起重要作用[9,10]。合適的切應力環境有利于血管平滑肌細胞與血管內皮細胞增殖分化,過高切應力則會抑制其生長[11,12]。構建組織工程血管的一大難題在于血管處在一個天然的機械動力環境,它包括:血液流經內皮層的切線產生的切變應力,環形管壁舒縮產生的牽張應力和靜水壓產生的正常應力。切變應力對血管細胞的形態、增殖、極性及基質的構成和結構有重要的影響。目前用于血管組織工程的生物反應器的研制主要是通過模擬體內的血流動力學條件,旨在體外培育成在結構和功能上與天然血管具有相同作用的人工血管。
本實驗采用將犬骨髓分離培養的MSCs誘導分化的ECs為種子細胞,以豬脫細胞血管基質為支架,將 ECs旋轉種植到脫細胞基質上,并在模擬血管的搏動性生物反應器內在剪切力的條件下培養,低剪切力條件下完成了小口徑組織工程血管構建,實驗剪切力的條件,發現在反應器早期,如果過快增加剪切力,不利于內皮細胞的粘附。所以我們采用逐漸增加剪切力的方式,1 d內逐漸將剪切力由1 dyn/cm2增加至10 dyn/cm2,然后在 10 dyn/cm2剪切力條件下繼續培養2 d。從構建后血管與未進行反應器種植僅僅內皮細胞粘附的血管基質比較,HE染色與掃描電鏡觀察,動態反應器下血管內皮細胞粘附較好,細胞平鋪整齊,細胞沿著血流方向生長。
本項研究表明小口徑組織工程血管移植物可以通過將MSCs誘導分化的內皮細胞作為種子細胞,以脫細胞血管支架作為基質,在搏動性生物反應器內,通過逐漸增加剪切力條件的方法,成功進行體外組織工程小口徑血管的構建。
(本文圖 1、2見彩插 2,圖 3-5、7見彩插 3)
[1] Shalak R,Fox CF.Preface.In:Tissue Engineering[M].Shalak R,Fox CF,eds.Alan R.Liss,New York.1998,26-29.
[2] Kaushal S,Amiel GE,Guleserian KJ,et al.Functional smalldiameter neovessels created using endothelial progenitor cells expanded ex vivo[J].Nat Med.2001,7(9):1035- 1040.
[3] Dahl SL,Koh J,Prabhakar V,et al.Decellularized native and engineered arterial scaffolds for transplantation[J]. Cell Transplant.2003,12(6):659-666.
[4] 武欣,谷涌泉,張建,等.生物血管異種移植的初步研究[J].中國實驗動物學報,2007,15(1):39-42.
[5] Langer R,Vacanti JP.Tissue engineering[J].Science 1993,260:920-926.
[6] Fields C,Cassano A,Makhoul RG,et al.Evaluation of electrostatically endothelial cell seeded expanded polytetrafluoroethylene grafts in a canine femoral artery model[J].J Biomater Appl,2002,17:135-152.
[7] VevesA, AkbariCM, Primavera J, etal. Endothelial dysfunction and the expression ofendothelialnitric oxide synthetase in diabetic neuropathy,vascular disease, and foot ulceration[J].Diabetes.1998,47(3):457-463.
[8] Schmidt CE,Baler JM.vascular tissues:natural biomaterials for tissue repair and tissue engineering[J].Biomaterials.2000;21:2215-2231.
[9] Schmidt D,Asmis LM,Odermatt B,et al.Engineered living blood vessels: functionalendothelia generated from human umbilical cord derived progenitors1[J].Ann Thorac Surg ,2006,82(4):1465-1471.
[10] Dobson J,Cartmell SH,Keramane A,et al.Principles and design ofa novelmagnetic force mechanicalconditioning bioreactor for tissue engineering,stem cell conditioning and dynamic in vitro screening[J].IEEE Trans Nanobiosci,2006,5(3):173-177.
[11] T?r?k E,Vogel C,Lütgehetmann M,et al.Morphological and functional analysis of rat hepatocyte spheroids generated on poly(L2 lactic acid)polymer in a pulsatile flow bioreactor[J].Tissue Eng,2006,12(7):1881-1890.
[12] Niklason LE,Gao J,Abbott WM,et al.Functional arteries grown in vitro[J].Science,1999,284:489-496.
Preliminary Study of in vitro Construction of Small-Diameter Vascular Graft by Seeding Cells onto Decellullarized Arterial Matrix
WU Xin,GU Yong-quan,DUAN Hong-yong,CHEN Bing,LI Jian-xin,WU Ying-feng,ZHANG Shu-wen,WANG Zhong-gao,ZHANG Jian
Department of Vascular Surgery,Xuan Wu Hospital,Capital University of Medical Sciences,Beijing 100053,China
ObjectiveTo explore the use of canine bone marrow mesenchyme stem cells to induce differentiated seed cells in vitro,and using the seeding cells to develop small-diameter vascular graft based on xenogenic decellularized arterial matrix.MethodsCanine bone marrow mesenchymal stem cells were separated by density gradient centrifugation and cultured in vitro,and differentiated into endothelial cells and smooth muscle cells.Porcine carotid arteries were decellularized using Triton X-100 and tripsin to eliminate all the cellular components.The mechanical and biocompatibility properties of the decellularized scaffolds were identified and evaluated.Small-diameter tissue engineered vascular grafts were constructed using the decellularized scaffolds and seeding cells in the dynamic bioreactor under dynamic conditions.ResultsThe cultured bone marrow mesenchymal stem cells were successfully differentiated into endothelial-like cells and smooth muscle-like cells,which can be used as seeding cells.Porcine carotid arteries were successfully decellularized by trypsin,ammonium hydroxide and non-ionic detergent eliminating all cellular components to make acellular scaffolds.Good pore size and porosity of the acellular scaffold were obtained.The biomechanics,immunogenicity and cell compatibility characteristics of the scaffolds could meet the requirements of tissue engineered vascular graft.Therefore,construction of the tissue engineered vascular graft in vitro in the dynamic bioreactor was succeded.ConclusionsBone marrow mesenchyme stem cells can be induced to differentiated into endothelial-like cells and smooth muscle-like cells in vitro.Using these cells as seeding cells and xenogenic decellularized arterial matrix as acellular scaffolds,small-diameter vasculargrafts can be constructed in a pulsatile bioreactor by culture under dynamic conditions in vitro.
Bone marrow mesenchymal stem cells;Decellularization;Scaffold;Bioreactor;Vascular graft,tissue engineered;Arterial matrix;Dog

圖3 誘導的平滑肌樣細胞重鏈免疫熒光染色呈陽性Fig.3 SMMHC-positive smooth muscle-like cells, immunofluorescence staining
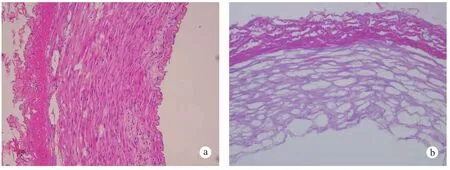
圖4 自然動脈(a)與脫細胞基質(b)HE 染色Fig.4 Natural carotid artery (a) and decellularized arterial matrix (b), HE staining
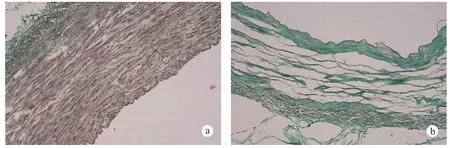
圖5 自然動脈(a)與脫細胞基質(b)Masson 染色Fig.5 Natural carotid artery (a) and decellularized arterial matrix (b), Masson staining
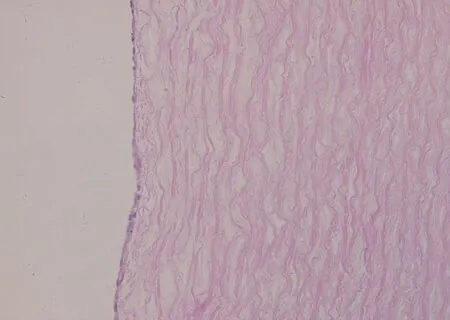
圖7 體外構建小口徑血管(HE)Fig.7 An in vitro constructed small caliber tissue engineered vascular graft, HE staining
Q95-3,R654.3
A
1005-4847(2010)05-0377-06
10.3969/j.issn.1005-4847.2010.05.004
2010-04-22
國家高技術研究發展計劃(863計劃)項目(2006AA02A134);北京市自然科學基金項目(項目編號:5082007和2103049)資助。
武欣(1975-),男,主治醫師,博士,主要從事血管外科的臨床與基礎研究。

