缺磷脅迫下番茄側根形成與miR164及NAC1表達的關系
曾后清,朱毅勇*,包 勇,沈其榮,郭 凱,黃思齊,楊志敏
(1南京農業大學資源與環境科學學院,江蘇南京210095;2南京農業大學生命科學學院,江蘇南京210095)
磷是植物生長的一種重要營養元素。施入土壤中的磷肥大部分被土壤中的鐵鋁氧化物所吸附或與土壤中的鈣形成沉淀,還有一部分轉化為有機磷。因此,磷在土壤中的有效性較低,是造成植物缺磷的一個主要原因。在缺磷脅迫下,植物根系通常會產生大量的側根來擴大根系在土壤中的吸收面積。由于側根的發生與磷的有效性有很好的相關性,因此一直受到研究者的關注[1-2]。研究表明,缺磷對側根的形成在某種程度上依賴于生長素作用;缺磷時植物側根對生長素的敏感性提高[3],并影響生長素在根系中的分布[4]。此外,側根發生過程中生長素信號還受到轉錄因子NAC1的介導,其表達強度與生長素濃度、側根的發生量呈高度正相關[5-6]。最近在擬南芥中發現,NAC1的表達受到miR164的調控。miR164與NAC1 mRNA特異性結合,引起NAC1 mRNA降解,進而影響側根的發育與形成[7]。但是,植物在缺磷情況下側根發生是否與miR164及其靶基因NAC1有關,國內外尚未見報道。
MicroRNA(miRNA)是近年來在真核細胞中發現的一類內源具有調控其他基因表達的、非編碼(蛋白質)的小分子 RNA,長度為20~ 24 nt[8]。目前對miRNA作用機制的研究顯示,成熟的miRNA先與RISC(RNA-induced silencing complex)的復合物結合,再特異性地與堿基互補的同源mRNA配對結合,若是堿基完全互補,則引起靶 mRNA的降解[9];若miRNA與靶mRNA不完全互補時,則與對應的靶mRNA的3′端非翻譯區(3′UTR)結合阻止轉錄后翻譯[10-11]。前者主要存在于植物中,而后者主要在動物中比較常見。miRNA主要參與基因后轉錄水平的調控,通過調節其對應的靶基因來控制植物生長發育,包括根、葉、花和輸導組織的形態發生與分化等[12-16]。此外,miRNA在調節植物對干旱、鹽害及植物養分等環境脅迫的反應方面也起著重要作用[17]。番茄是一種重要的蔬果,也是研究根系形態發育(如側根和根毛)的模式植物。因此,本試驗利用番茄幼苗研究了不同供磷水平下根系的形態變化和磷素缺乏情況下側根發生與生長素的關系,以及缺磷情況下其根系中調控生長素信號的轉錄因子NAC1與miR164在轉錄水平上的表達關系,為研究植物在缺磷脅迫下的生理機制提供依據。
1 材料與方法
1.1 材料培養和處理
番茄(Lycopersicon esculentum)品種為蘇紅 2008(江蘇省農科院提供)。種子用2%的次氯酸鈉消毒8 min,在1 mmol/L CaSO4溶液中浸泡6 h后于 22℃黑暗中發芽。2 d后將露白的種子均勻地播在漂浮于營養液面的尼龍網上。營養液組成為:0.7 mmol/L Ca(NO3)2、0.5 mmol/L NH4H2PO4、1.5 mmol/L KNO3、4.75 μ mol/L FeSO4、0.5 mmol/L Mg-SO4 、11.5 μ mol/L H3BO3 、1.25 μ mol/L MnCl2 、0.2 μ mol/L ZnSO4 、0.32 μ mol/L CuSO4 、0.025 μ mol/L H2MoO4和 4.75 μ mol/L Na2EDTA(pH 5.5)。對 于磷濃度處理,加入 0、0.005、0.05、0.5 mmol/L NH4H2PO4,不足0.5 mmol/L的部分以NH4Cl代替。植物在生長箱中培養,溫度為23℃,每天光照12 h。營養液每天更換一次,到第5 d時采樣分析。外加生長素抑制劑與外源生長素的濃度分別為50 nmol/L NPA與10 nmol/L NAA,在每天更換營養液時根據試驗設計要求加入。由于所有番茄培養時間均為5 d,如無特別說明,則外加生長素抑制劑與外源生長素時間均為5 d,如加入時間為4 d,表示移栽1d后加入,依次類推;不加生長素抑制劑和外源生長素的為對照,試驗均重復3次。
1.2 測定項目與方法
根系形態分析:將番茄幼苗在莖與根的交界處切開,根長、側根數和側根原基測量在體視鏡下進行。根長,側根長用直尺測量,側根原基數在體視鏡下計數。
植物磷含量測定:將幼苗在液氮中迅速冷凍,研磨后稱取50 mg凍干粉溶解于50 mL 10%(v/v)TCA中,4℃往復振蕩15 min。12000×g離心5 min后取上清液,用鉬藍比色法測定磷含量[18]。
根系總RNA采用Trizol(Invitrogen)提取:由于成熟miRNA片斷太短,因此先對其進行polyA加尾處理[16]。 反應體系 為 25 μ L(1.5 μ g total RNAs、1 mmol/L ATP、2.5 mmol/L MnCl2和 2 U polyA polymerase),反應條件37℃60 min。加尾后的RNA直接進行反轉錄,反應體系為 25 μ L,其中含有12.5 μ L ployA加尾的產物,0.5 mmol/L dNTP,200 UMMLV 反轉錄酶(Promega),1 μ L 錨 定引物[5′-CGAACATGTACAGTCCATGGATAG d(T)30(A,G or C)(A,G,C or T)-3′],獲得 cDNA 產物。以 EF-1a作為內參,其擴增所用引物為:正義鏈 5′-AGACCACCAAGTACTACTGCAC-3′;反 義 鏈 5′-CCACCAATCTTGTACACATCC-3′。擴增NAC1 的引物為:正義鏈 5′-CCCTTGGACTTTGATACAC-3′;反 義 鏈 5′-TGGCTTTCC AGTAACCAGATACG-3′。擴增miR164的引物為:正義鏈即為miRNA序列,反義鏈為加尾所含序列(5′-CGAACATGTACAGTCCATGGATAG-3′)。 反 應 體系:25 μ L[包括 10 mmol/L Tris-HCl(pH 8.3)、50mmol/L KCl、1.5 mmol/L MgCl2、0.01%Gelatin 、0.01%Triton X-100、0.2 mmol/L dNTP、2U Taq DNA polymerase(TaKaRa)、0.5mmol/L primer]。反應條件為:94℃預變性3 min。25循環:1)94℃變性,30 s;2)72℃退火,30 s;3)65℃延伸,40 s,最后保持72℃,5 min。
實驗數據均使用SPSS 13.0進行統計與分析。
2 結果與分析
2.1 磷有效性對番茄幼苗根系形態的影響
番茄種子發芽后,直接轉移到含有不同磷濃度的營養液中。培育5 d后發現,完全缺磷營養下的番茄幼苗側根數量最多,平均有6條;5 μ mol/L Pi處理下的幼苗平均有5條側根。當磷濃度達到50 μ mol/L時,側根數目明顯減少,僅有 2~3條;當磷濃度達到500 μ mol/L時,側根數量平均為1條(圖1A)。同時,側根的總長度也隨著營養液中磷濃度的升高而降低,其變化趨勢與側根數目的變化一致(圖1B)。相比之下,培養5 d后主根的長度在0~5 μ mol/L磷濃度范圍內無顯著差異,而且比50~500 μ mol/L磷濃度下培養的主根略長一些(圖1C)。幼苗體內的磷含量隨著營養液中磷濃度的增高而顯著增加(圖1D)。
為了避免完全缺磷可能帶來的其他影響,我們選取了 5 μ mol/L 和 500 μ mol/L 的供磷濃 度作為缺磷脅迫處理(-P)與供磷對照(+P)進行以下研究。
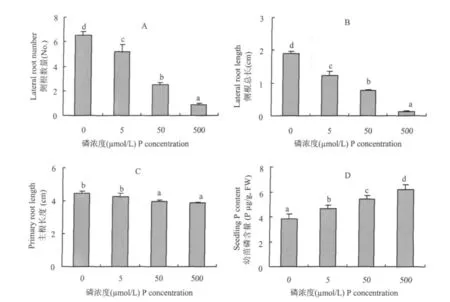
圖1 不同供磷濃度下番茄幼苗的根系形態及其體內磷含量Fig.1 Morphology of root system and phosphate content of tomato seedlings cultivated under different P levels
2.2 生長素對番茄幼苗側根發育的影響
生長素是影響根系形態變化的一個重要因素。在缺磷與供磷營養液中分別加入生長素運輸抑制劑NPA和外源生長素NAA,結果發現,在外加NPA的情況下,缺磷和供磷植物的側根發生都受到強烈的抑制,植株幾乎沒有長出側根;而加入NAA后,供磷植物也產生了大量的側根,與不加NAA的缺磷植物的側根數目相近;缺磷植物在外加NAA的情況下,也產生了更多的側根,并且有顯著差異(圖2A)。植物側根的總長度變化在外加NPA與NAA時,與側根的發生量變化一致(圖2B)。除了側根以外,側根原基的數目在NPA的處理下也受到明顯的抑制,外加NAA顯著促進了側根原基的數目(圖2C)。
2.3 磷有效性與生長素運輸對側根發育的交互作用
為了進一步研究缺磷誘導側根發生與生長素之間的關系,將缺磷番茄幼苗用NPA進行不同時間段的連續處理5 d。結果發現,移栽1和2 d后用NPA處理,即連續處理4和3 d,幾乎完全抑制了側根形成(圖3A),側根的伸長生長也相應地受到抑制(圖3B)。相比之下,移栽3~4 d后的缺磷幼苗用NPA連續處理2和1 d,雖然也減少了側根的形成數量,但與對照相比,僅減少了30%(圖3A)。因此,第3和第4 d是側根形成的重要時期。相對而言,側根的伸長生長卻受到了強烈的影響,表現為側根總長度下降了80%(圖3B)。為了明確生長素對側根形成早期的調控影響,觀察了NPA處理對側根原基數量的發生的影響(圖3C),結果發現,連續3和4 d的NPA處理均明顯減少了側根原基的數量,達50%以上;連續用NPA處理1及2 d對側根原基數量的抑制分別減弱為20%和30%左右。與側根形成數量受NPA抑制的結果相比(圖3A),生長素抑制劑NPA對側根原基是否發育成側根的影響更大。
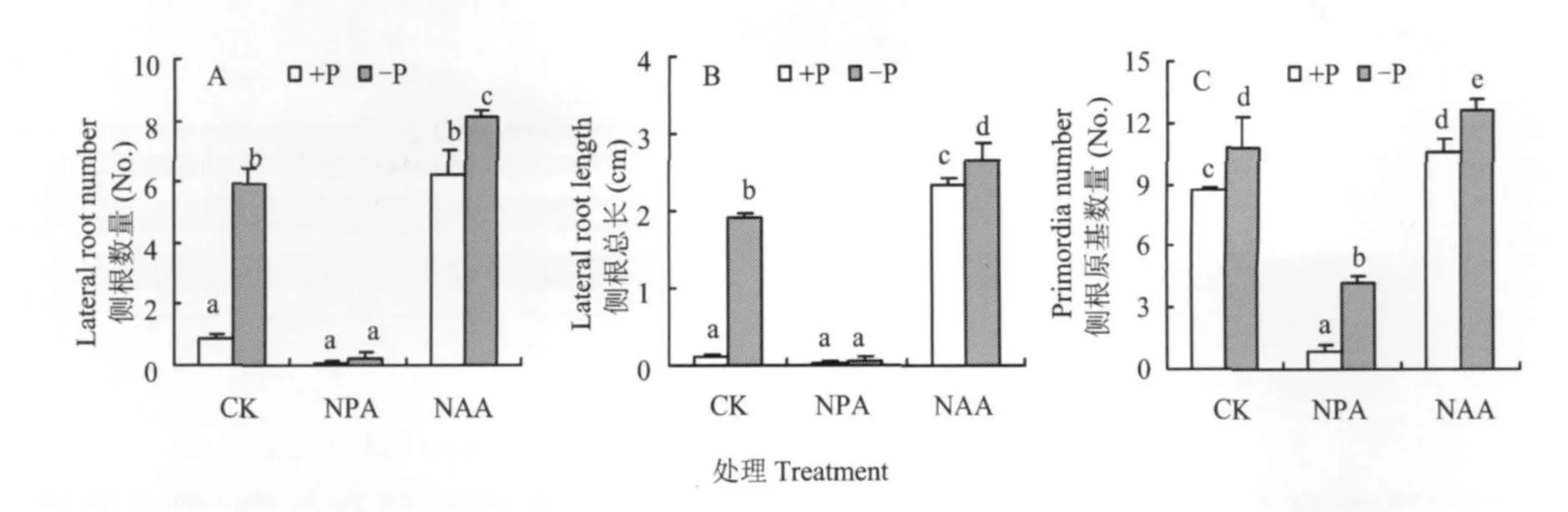
圖2 生長素抑制劑NPA與外源生長素NAA對缺磷與供磷番茄幼苗側根發育的影響Fig.2 Effect of NPA and NAA on the development of tomato lateral roots under P deficiency and sufficient conditions
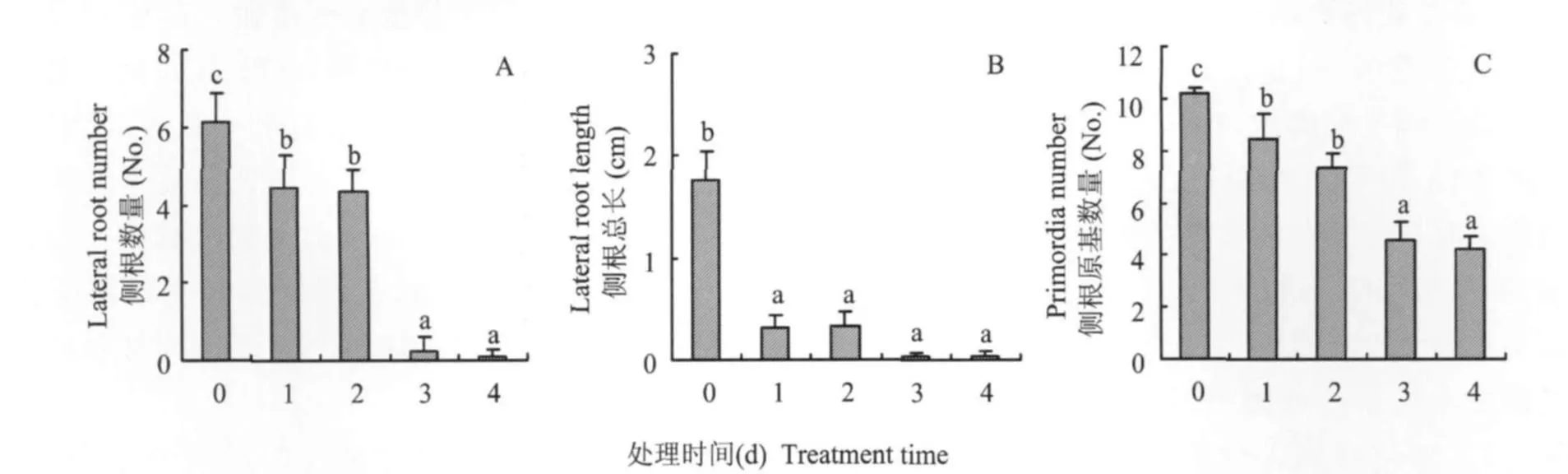
圖3 不同時間段NPA處理對缺磷番茄側根發育的影響Fig.3 Effect of NPA on the development of tomato lateral roots under P deficiency
2.4 NAC1與miR164在側根形成過程中的表達變化
為了驗證轉錄因子NAC1與miR164在側根發育過程中可能的作用,本試驗觀察了番茄根系側根發生的過程。如圖4A所示,番茄幼苗從第3 d開始長出側根,到第4 d時是側根大量形成的時期。通過半定量RT-PCR分析發現,在第3和第4 d的24 h中NAC1在缺磷植物與供磷植物的根系中的表達都有上升的趨勢,但缺磷植物的NAC1表達量要明顯高于供磷植物。與此同時,miR164的表達量在缺磷植物中始終低于供磷植物(圖4B)。
3 討論
土壤中磷素缺乏的主要原因是磷在土壤中容易被固定,移動性差,因此截獲是植物根系獲得土壤中磷素的一個主要方式。植物根系通過分枝,產生大量側根以擴大吸收范圍。本試驗中,隨著營養液中供磷濃度的降低,側根數逐漸增加,側根總長度也隨之增加,與磷有效性之間體現了較好的負相關(圖1)。說明外界環境中磷的有效性是決定植物根系形態變化的一個重要因素。相比之下,主根的長度與外界供磷濃度之間沒有類似的關系。主根在缺磷脅迫下(0~ 5 μ mol/L)比不缺磷時(50~ 500 μ mol/L)略有伸長。類似的情況在擬南芥中也有發現[3],并且只有在供磷水平低于50 μ mol/L時,根系鮮重才顯著增加;但是在各個低磷濃度處理之間無顯著差異。結合本試驗結果(圖1A、C),在缺磷脅迫下,植物根系(包括主根與側根)生長得到了促進;同時從圖1D可知,外界磷濃度是造成植物體內磷含量差異的一個主要原因。
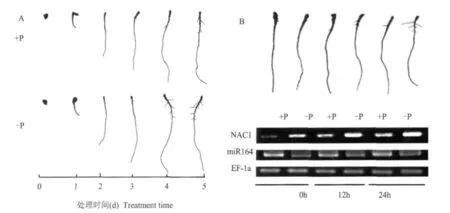
圖4 番茄幼苗根系發育過程及其側根發育過程中NAC1與miR164的表達變化Fig.4 Root morphology of tomato seedlings and expression pattern of NAC1 and miR164 during the development of lateral roots
根系形態的改變與外界環境中供磷水平密切相關,但最終是通過影響植物體內的激素調控來實現的。在本試驗中(圖2A),外加生長素運輸抑制劑NPA嚴重抑制了缺磷植物的側根發生,而施用外源生長素NAA則導致供磷植物也產生大量的側根。說明缺磷時番茄幼苗側根的生長依賴于生長素;相應的,側根長度的變化也與此一致(圖2B)。盡管側根原基的數量變化也有上述類似的趨勢(圖2C),但是供磷植物所形成的側根原基亦達到缺磷植物的75%左右,即使在加入生長素抑制劑NPA的情況下,無論供磷還是缺磷植物的側根原基數量都沒有完全受到抑制,相比之下側根形成則完全受到抑制(圖2A)。此外,即使加入了外源生長素NAA后,供磷和缺磷植物所增加的側根原基數量也很少,這與NAA處理下側根大量形成有著明顯的差別。說明側根原基的形成也需要生長素,但是對生長素的敏感性及依賴性不如側根發生過程時那么強烈。由此可知,缺磷是誘導側根原基增多的一個主要原因,缺磷信號通過植物體內的生長素使更多的側根原基發育成側根。
由于生長素是在植物的地上部分合成并運輸到根系組織,因此生長素的極性運輸決定了生長素在根系中的濃度與分布[19]。NPA是抑制生長素極性運輸的一種化學試劑。通過NPA對缺磷脅迫下的番茄幼苗進行處理時發現,前期開始處理徹底抑制了側根的形成,而后期處理則無法完全抑制側根的形成(圖3A)。表明前期處理可能導致缺磷誘導產生的生長素在向地性運輸過程中受到抑制而無法在根系中積累,以至于側根形成受阻。盡管側根原基的數量并沒有受到完全的抑制(圖3C),而后期NPA處理可能無法改變根系中已有的生長素的作用,植物仍能夠形成側根。但是,由于處理后生長素的運輸開始受到抑制,導致側根形成數量減少。相比之下,無論處理時間長短,側根的伸長生長都受到了NPA強烈的抑制(圖3B),說明生長素對側根的伸長生長影響更大。
NAC1是NAC家族中的一員,是一個轉錄因子,能激活生長素信號途徑中兩個下游基因DBP和AIR3。NAC1不僅本身受生長素誘導,同時也調控生長素信號來促進側根的形成和發育。因此,NAC1的過表達與反義轉基因擬南芥分別顯示出側根增加與側根減少兩種表型[5]。從圖4A中可知,番茄幼苗生長到第3~4 d,是側根迅速形成的主要時期。在24 h之內(圖4B),無論是缺磷還是供磷植物的NAC1表達都有上升的趨勢,但是缺磷植物的NAC1表達量明顯高于供磷植物。因此推測,在這個側根迅速形成的過程中,NAC1的表達增強是激活側根發育的重要原因之一。而與NAC1互補的miR164表達水平則始終表現為缺磷處理比供磷要低,在趨勢上與NAC1的表達差異相反。說明miR164在缺磷脅迫時下調,是NAC1的表達水平升高的一個重要原因,對缺磷植物大量形成側根起到重要的調控作用。但是缺磷又是如何來調控miR164的表達,還有待進一步的研究。
[1] Sánchez-Calder ón L,López-Bucio J,Chacón-López A et al.Phosphate starvation induces a determinate developmental program in the roots of Arabidopsis thaliana[J].Plant Cell Physiol.,2005,46:174-184.
[2] 劉鵬,區偉貞,王金祥,等.磷的有效性與植物側根的發生發育[J].植物生理學通訊,2006,42(3):395-400.Liu P,Qu W Z,Wang J X et al.Phosphorus availability and lateral root initiation and development of plants[J].Plant Physiol.Commun.,2006,42(3):395-400.
[3] López-Bucio J,Hernandez-Abreu E,Sanchez-Calderon L et al.Phosphate availability alters architecture and causes changes in hormone sensitivity in the Arabidopsis root system[J].Plant Physiol.,2002,129:244-256.
[4] López-Bucio J,Hernandez-Abreu E,Sanchez-Calderon L et al.An auxin transport independent pathway is involved in phosphate stress-induced root architectural alterations in Arabidopsis.Identification of BIG as a mediator of auxin in pericycle cell activation[J].Plant Physiol.,2005,137:681-691.
[5] Xie Q,Frugis G,Colgan D,Chua N H.Arabidopsis NAC1transduces auxin signal downstream of TIR1 to promote lateral root development[J].Genes Devel.,2000,14:3024-3036.
[6] 王友華,段留生,盧孟柱,等.NAC1上游調控區表達特征及其與側根激素誘導的關系[J].中國科學C輯(生命科學),2006,36(3):217-222.Wang Y H,Duan L S,Lu M Z et al.Expression of NAC1 up-stream regulatory region and its relationship to the lateral root initiation induced by gibberellins and auxins[J].Sci.China Ser.C(Life Sci.),2006,36(3):217-222.
[7] Guo H,Xie Q,Fei J,Chua N.MicroRNA directs mRNA cleavage of the transcription factor NAC1 to downregaulate auxin signals for Arabidopsis lateral root development[J].Plant Cell.2005,17:1376-1386.
[8] Bartel D.MicroRNAs:Genomics,biogenesis,mechanism and function[J].Cell,2004,116:281-297.
[9] Hammond S M,Bernstein E,Beach D,Hannon G J.An RNA—directed nuclease mediates post-transcriptional gene silencing in Drosphila cells[J].Nature.2002,404:293-296.
[10] Chen X.microRNA biogenesis and function in plants[J].FEBS Lett.,2005,579:5923-5931.
[11] Zhang B,Pan X,Cobb G P,Anderson T A.Plant microRNA:A small regulatory molecule with big impact[J].Devel.Biol.,2006,289:3-6.
[12] Jones-Rhoades M W,Bartel D P.Computational identification of plant microRNAs and their targets,including a stress-inducedmiRNA[J].Mol.Cell.2004,14:787-799.
[13] Mallory A C,Vaucheret H.Functionsof microRNAs and relatedmall RNAs in plants[J].Nat Genet.,2006,38:31-37.
[14] Wang J W,Wang L J,Mao Y B et al.Control of root cap formation by microRNA-targeted auxin response factors in Arabidopsis[J].Plant Cell,2005,17:2204-2216.
[15] Zhang B,Pan X,Anderson T A.Identification of 188 conserved maize microRNAs and their targets[J].FEBS Lett.,2006,580(15):3753-3762.
[16] Zhou Z S,Wang S J,Yang Z M.Bioinformatic identification and expression analysis of new microRNAs from Medicago truncatula[J].Biochem.Biophy.Res.Comm.,2008,374:538-542.
[17] Sunkar R,Zhu J K.Novel and stress-regulated microRNAs and other small RNAs from Arabidopsis[J].Plant Cell,2004,16:2001-2019.
[18] Rytcher A M,Milkulska D D.The relationship between status and cyanide-resistant respiration in bean roots[J].Physiol.Plant.,1990,79:383-388.
[19] Narcy P,Canivenc G,Muller B et al.A role for auxin redistribution in the responses of the root system architecture to phosphate starvation in Arabidopsis[J].Plant Physiol.,2005,138:2061-2074.

