微細腔內甲烷濕空氣低溫重整特性熱力學分析
冉景煜 趙柳潔
(重慶大學動力工程學院,重慶 400044)
微細腔內甲烷濕空氣低溫重整特性熱力學分析
冉景煜*趙柳潔
(重慶大學動力工程學院,重慶 400044)
從理論上探討低溫(小于973 K)、壓力、空碳比及水碳比對重整特性及甲烷轉化率的影響,以及各參數的合理取值范圍;同時,對甲烷自熱重整系統與無氧重整系統進行了性能對比.研究結果表明:微細腔在溫度大于633 K,反應壓力小于0.10 MPa,空碳(摩爾)比為2.0以及水碳摩爾比在1.0-2.5之間有利于甲烷自熱重整反應的發生;自熱重整與無氧重整體系相比,當甲烷質量流量一定時,有氧系統可以在較低的水碳比和較低的溫度條件下獲得較高的甲烷轉化率和氫氣產量.
微細腔; 低溫; 自熱重整; 熱力學分析; 無氧系統; 對比
Abstract:We studied the effects of reaction pressure,molar ratios of air to methane and steam to methane on the reforming process at temperatures below 973 K theoretically.Their reasonable ranges were also studied.We also compared the performance of a methane autothermal reforming system and a non-oxygen system.Results show that methane autothermal reforming occurs much more easily at temperatures above 633 K,reaction pressures below 0.10 MPa,a molar ratio of air to methane of 2.0,and a molar ratio of steam to methane between 1.0 and 2.5.At a definite methane mass flow,a higher methane conversion rate and hydrogen yield can be obtained at lower temperatures and in lesser steam to methane ratio in an autothermal reforming system compared with a non-oxygen system.
Key Words: Micro-combustor;Low temperature;Autothermal reforming;Thermodynamic analysis;Non-oxygen system;Contrast
在微細腔中加氫來保持燃料燃燒的穩定和不熄火是很多科研人員研究的熱點,氫氣的加入擴展了燃料的著火極限,并降低著火溫度.有學者將氫氣直接加入到燃料氣中用來改善燃燒[1-2];也有學者提出可利用甲烷水蒸氣的高溫(1100 K左右)重整,使產生的部分氫氣混入尚未燃燒或正在燃燒的混合氣中,從而改善燃料的著火、燃燒特性[3-5];自熱重整制氫技術與甲烷水蒸氣重整相比,變外供熱為自供熱,反應熱量利用較為合理,既可以限制反應器內的高溫,又降低了體系的能耗[6-7],從而比較容易實現在微細腔初始段的低溫和欠氧環境中產氫.目前甲烷自熱重整的研究主要集中在大空間下不同反應器和不同催化劑對獲取大量合成氣產生的影響[8],而對微細腔燃燒特性與催化重整的研究基本圍繞高溫環境下氫氣-氧氣、甲烷-空氣或甲烷-水蒸氣展開[9-10].針對甲烷濕空氣低溫自熱重整特性來改善燃燒以實現微尺度下燃料持續穩定燃燒的基礎性研究報道極少.因而有必要深入研究微細腔內低溫低燃料流量自熱重整反應的特性和影響因素.
于此,本文采用平衡常數法對微細腔中甲烷自熱重整在低溫下的反應特性進行了熱力學分析,從理論上探討欠氧條件下溫度(小于973 K)、壓力、空碳比(摩爾比)和水碳比(摩爾比)對自熱重整產氫以及甲烷轉化率的影響,并對有氧的自熱系統與無氧重整系統進行性能對比,以期獲得微細腔內低溫低水碳比下自熱重整反應的規律及合理反應參數,為進一步實驗研究和開發微細腔催化重整燃燒技術提供理論基礎與依據.
1 微細腔內甲烷自熱重整體系
甲烷自熱重整反應實際上是部分氧化重整和甲烷水蒸氣重整的耦合,通過調控這兩個過程的反應速率來實現系統自熱運行是可行的.自熱重整理想的整體反應可用如下化學式表示[11]:

由此可知氧氣與甲烷摩爾比φ是比較關鍵的參數.當φ=0時,代表水蒸氣重整反應的條件,該反應為強吸熱反應;當φ增大時,即原料氣中氧氣含量增大,反應的吸熱程度降低;當φ=0.44時,反應中的熱量達到最低值.通常,甲烷自熱重整反應在放熱條件下(φ≥0.44)進行,即滿足空氣與甲烷的摩爾比應大于或等于2,產生的熱量用于彌補熱量損失和提高反應溫度[12].
微細腔中甲烷濕空氣自熱重整是一個復雜的體系,部分氧化反應所放出的熱量應高于甲烷水蒸汽重整所吸收的熱量,兩個過程既可以分兩步進行也可以混在一起進行.暫不考慮碳的析出和氮氧化物的生成,在此采用Christensen等[13]推薦的主要反應如下:
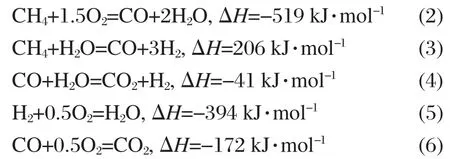
上述反應式雖多,但對化學平衡來說,只需研究對應的獨立反應.獨立反應是指一組包含了體系所有物種的反應,且其中任一個方程式不能用組中其余反應式的線性組合求得.而體系另外的反應式均可從這組獨立反應的線性組合中求得[14].這一體系中共有 CH4、H2O、CO、H2、CO2、O2、N2七種物質,它們由C、H、O、N四種元素組成,因此應有三個(物種數-元素數=7-4=3)獨立反應.反應(2)-(4)滿足上述獨立反應的特點,且是諸多學者在甲烷重整研究中認可的重要反應.本文選此三個反應進行熱力學平衡計算,體系的其他反應均可由這三個反應的線性組合獲得.
熱力學方法是通過對反應平衡時最大產率、平衡轉化率及平衡體系各物質濃度的計算,判斷出化學反應進行的程度,從而考察體系進行的可行性.一般而言,微反應器結構微小,物料在其中停留時間較短、易出現反應效率低下等問題.但微反應器本身能在小尺度空間上耦合吸熱和放熱反應,使得傳熱系數比傳統反應器提高2個數量級,可將傳統的秒級甲烷重整反應提高為毫秒級反應過程,約為0.01-0.1 ms[5].本文主要是研究毫米級微細腔,如直徑是1 mm的微細圓管道,其質量流量選為7 g·h-1,即使管道長度僅為1 mm(微細腔長度一般大于1 mm),氣體停留時間約為0.29 ms,大于反應發生的時間,符合平衡反應研究的條件.
此外,物料停留的時間與質量流量成反比,選擇合理的流量則是整個研究的基礎.對于停留時間低于甲烷反應時間時,甲烷質量流量對體系影響較大;當氣體在微細腔內的停留時間超過反應發生所需的時間即反應達平衡時,甲烷質量流量對結果的影響不大,在滿足一定功率的前提下優先選擇較低的質量流量.本文是針對物料停留的時間大于反應時間的研究,故進行定甲烷質量流量的熱力學分析.近幾年國內外發展起來體積在1 cm3量級上的微型發動機,能產生大約10-100 W的功率,設計工況耗燃料在7 g·h-1左右[15],在此基礎上,選取甲烷質量流量為6.6 g·h-1作為基礎參數,用以開展后續的熱力學平衡計算.
2 熱力學計算方法
通過上述分析得出的獨立反應,找出各反應的平衡常數關系式.因為參加反應的物種應同時滿足所有獨立反應的平衡,建立方程可求得體系平衡時的氣相組成,從而獲知組分特性變化.
2.1 反應平衡常數的計算
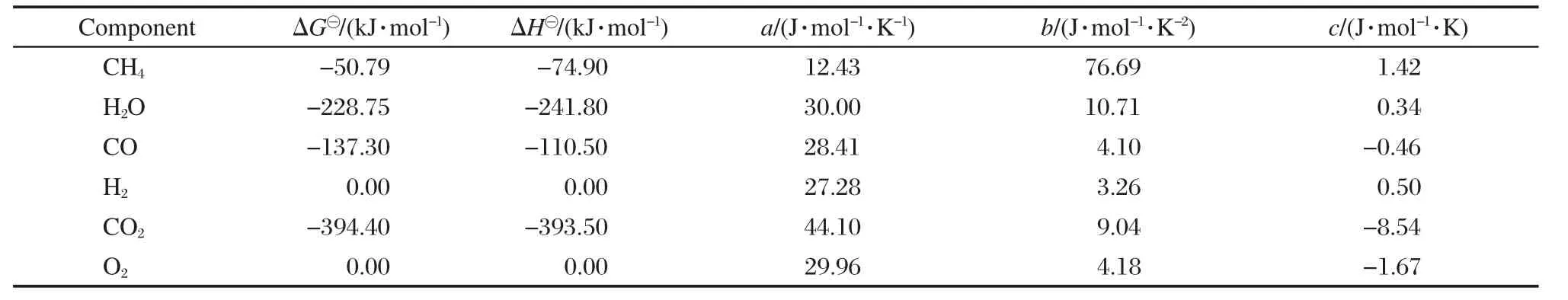
表1 298 K及常壓下各物質的熱力學常數Table 1 Thermodynamic constants of each substance under 298 K and atmospheric pressure
熱容Cp與溫度T的函數關系如下[16](a、b、c各值見表1):

由 △G?(298)=-RTlnK298求出 lnK,代入(12)式可計算出積分常數項IK,得到各反應平衡常數與溫度的函數關系見表2和表3,K2-K4分別表示為反應(2)-(4)式的平衡常數.可以看出,隨著反應溫度的升高,K2的值雖然隨之減小,但其對應的值相對大得多,也就是說相同溫度下反應(2)比其他各反應更易發生,為自熱體系所需能量提供一定的保障.平衡常數K3的值隨溫度升高在973 K以后陡然增大,說明高溫更有利于吸熱反應的甲烷水蒸氣重整.而平衡常數K4則隨著溫度的升高逐漸減小,溫度低時其值較大,在973 K以后,變化相對較小,說明溫度過高會抑制放熱反應(4)的進行.從化學平衡的角度講,該低溫體系存在一個促使各反應能順利進行的溫度范圍.
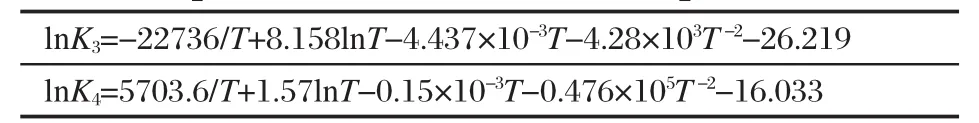
表2 反應平衡常數與溫度的關系Table 2 Relationship between reaction equilibrium constant and temperature
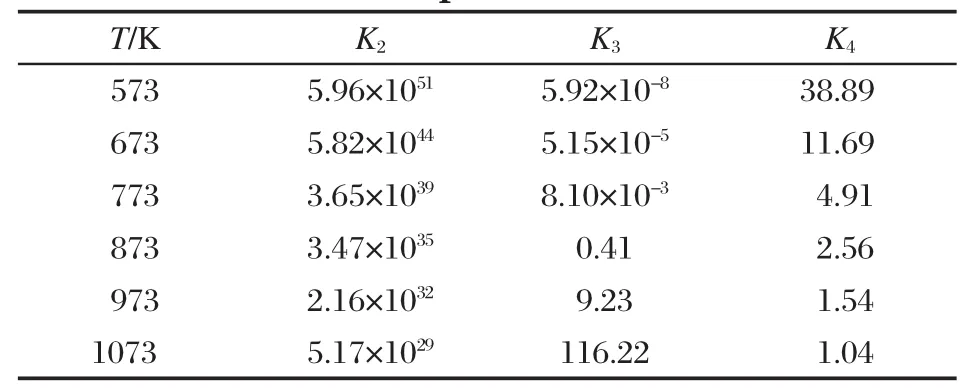
表3 不同溫度下的反應平衡常數Table 3 Reaction equilibrium constant at different temperatures
2.2 重整反應平衡各組分特性模型
甲烷與氧氣易發生氧化反應,欠氧條件時氧氣消耗完全:
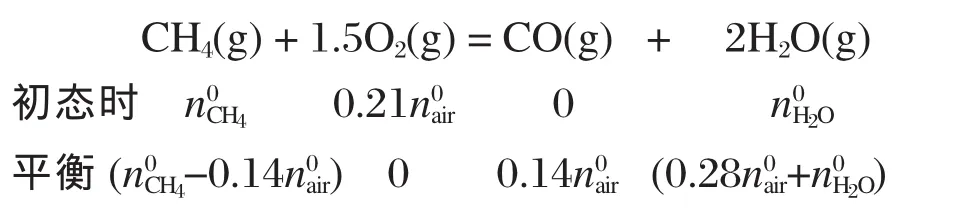
再設反應(3)中 CH4轉化了x mol·h-1,反應(4)中CO轉化了y mol·h-1,
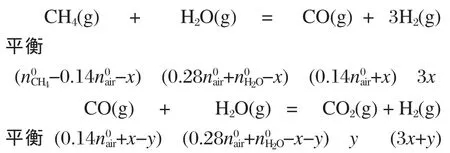
那么平衡時各組分的摩爾流量ni見表4.定義CH4轉化率:CO2和 CO 選擇率:組分產量單位為mol·mol-1.
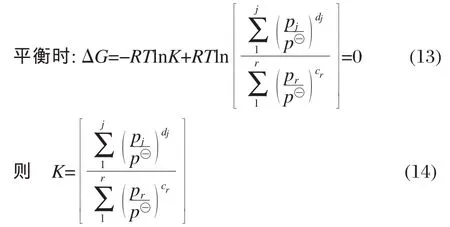
pj表示生成物分壓;pr表示反應物分壓;dj和cr分別表示各反應中生成物和反應物對應的化學計量數),通過氣體狀態方程將氣體組分分壓換算成摩爾濃度[14]可得:
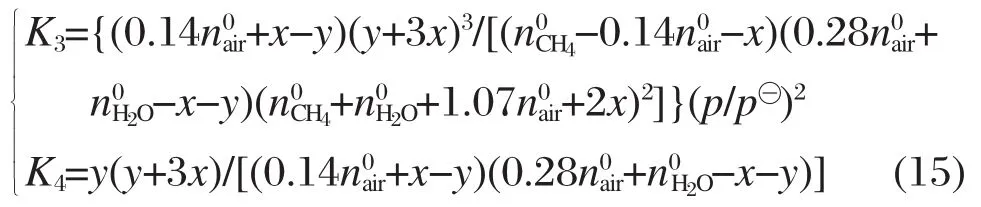

表4 反應平衡時各組分的摩爾流量Table 4 Molar flow of each component at reaction equilibrium
將不同溫度下計算得到的平衡常數K3和K4的值代入式(15),建立方程組.利用MATLAB軟件計算該非線性方程組即可獲取對應溫度、壓力及原料配比條件下,各物質的平衡組成.針對微細腔的尺寸特點,參照文獻[12]和化學反應式(1)的摩爾比,選取微細腔基本反應參數是:甲烷質量流量MCH4=6.6 g·h-1,α=2.0,β=1.0,p=p?,物料進氣溫度即反應溫度.
3 重整反應特性熱力學分析結果與討論
3.1 溫度的影響
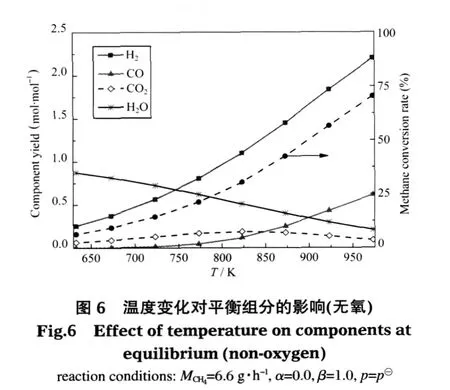
基本參數不變 (MCH4=6.6 g·h-1,α=2.0,β=1.0,p=p?),考察溫度對熱力平衡時各組分產量的影響,如圖1和表5所示.結果發現,溫度在達到633 K以后才能同時發生甲烷部分氧化反應(2)、甲烷水蒸氣重整(SMR)反應(3)和水汽轉換(WGS)反應(4),并有微量氫氣產生.633 K時H2產量為0.27 mol·mol-1,主要來源于WGS反應,CH4轉化率為28%,二者在633-973 K之間增長幅度較大,達973 K后兩值分別維持在2.30 mol·mol-1和95%左右;CO的產量也一直增加,973 K以后其值在0.68 mol·mol-1左右;生成的CO2隨溫度變化先增加后減小,在823 K時產量最大為0.41 mol·mol-1;H2O的產量隨溫度增大一直在減小,但也在973K以后趨于穩定.這里973 K以后的變化特性與文獻中的模擬結果[3]較為一致.這是因為溫度的增加極大程度地推動了SMR反應的進行,導致CH4轉化率,CO、H2的增加和H2O的減少.在低溫條件下水汽轉換(WGS)反應(4)進行的程度較大,使得CO2的量增加,而溫度的增加和H2O的減少都抑制WGS反應的進行,從而導致CO2的含量在823 K時達到最大并開始逐漸減少.雖然WGS反應對CO有一定的消耗,但總體來說呈不斷增長趨勢,溫度的增加對該反應頗為不利,所以在較低溫段(小于823 K)CO增加的幅度很小,在較高溫段增加幅度加大.
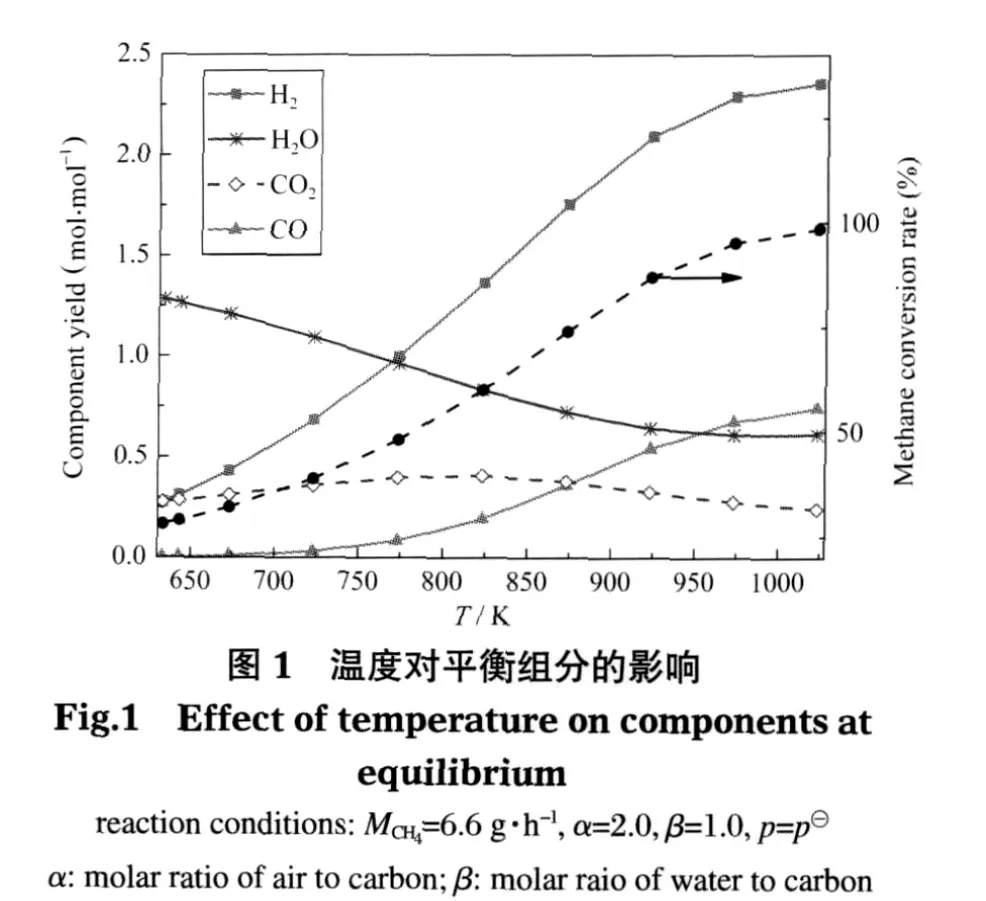

表5 不同溫度下反應(3)中轉化甲烷的量Table 5 Reacted methane in reaction(3)at different temperatures
從圖中可以看出,溫度在633-973 K之間可實現微細腔內甲烷自熱重整,并在此范圍內能獲得高于28%的甲烷轉化率和大于0.27 mol·mol-1的氫氣產量,且CO2的體積含量在823 K達到最多為0.41 mol·mol-1.溫度超過973 K以后,各組分變化相對平穩.
3.2 壓力的影響
原料氣進氣組成不變(MCH4=6.6 g·h-1,α=2.0,β=1.0),考察溫度為973 K時反應壓力對熱力學平衡時各組分的影響,見圖2.可以看出,隨著壓力增大,CH4轉化率和H2的產量均有所減少,其中CH4轉化率下降的幅度較大.如反應壓力為0.10 MPa時,H2產量為 2.29 mol·mol-1,CH4轉化率為 95.2%;反應壓力為0.15 MPa時,二者對應的值分別為2.19 mol·mol-1和91.40%,反應壓力從0.10 MPa增加到0.15 MPa,H2量減少了 0.10 mol·mol-1,而 CH4轉化率下降了3.80%.其他組分含量隨壓力增加變化并不大,CO、CO2、H2O 的產量分別維持在 0.70、0.28、0.60 mol·mol-1左右.從化學平衡的角度出發,該反應體系是體積增大反應,壓力過高,反應向體積減小的方向進行,CH4轉化率和H2產量因此減少,不利于該體系重整反應的發生.
表6反映了633 K及以上溫度時,不同壓力下甲烷水蒸氣重整反應中轉化甲烷的量.可以看出壓力大于0.10 MPa以后,633 K對應的值為負值,說明此時SMR反應困難;大于633 K時,SMR反應都適量開展并隨著溫度的升高轉化的甲烷量增多,這與前面溫度影響的分析結果一致.如反應壓力為0.12 MPa時,633 K轉化的甲烷量為-0.002 mol·h-1,653、773、873 K 對應的值分別是 0.005、0.046、0.130 mol·h-1.所以反應壓力應不大于0.10 MPa,才有利于633-973 K范圍內實現微細腔低溫自熱重整產氫.
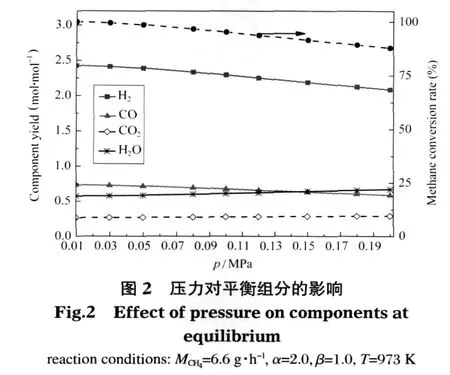
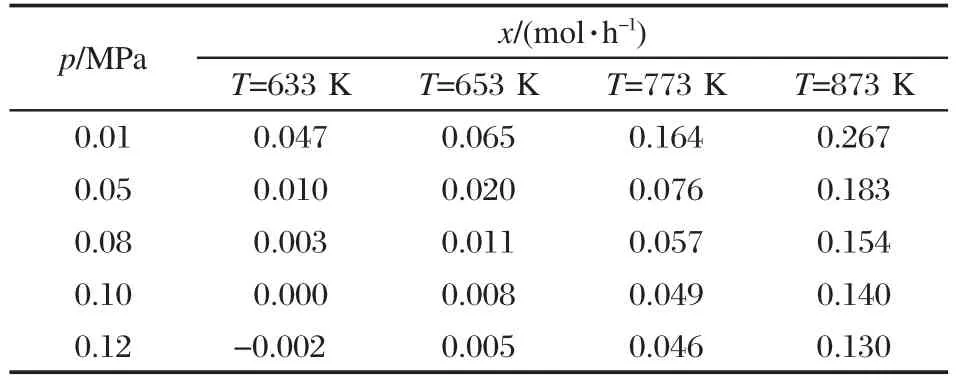
表6 不同壓力下反應(3)中轉化甲烷的量Table 6 Reacted methane in reaction(3)under different pressure

3.3 空氣含量的影響
除空碳比外,其他基本參數保持不變(MCH4=6.6 g·h-1,β=1.0,p=p?),考察 973 K 下空碳比對熱力學平衡時各組分的影響,見圖3.如圖所示,隨著空碳比的增加,CH4轉化率、H2O和CO2的產量都逐漸增加;H2和CO產量先略有增加,在空碳比增加到1.0以后有小幅度減少,而在空碳比達2.0以后,二者下降的幅度明顯增大.如空碳比為0.5時,CH4轉化率為79.97%,H2O、CO2、H2和CO的產量分別是 0.28、0.13、2.32、0.67 mol·mol-1;空碳比為 1.0 時,CH4轉化率為 87.10%,H2O、CO2、H2和 CO的產量分別是0.38、0.17、2.36、0.70 mol·mol-1; 空 碳 比 為 2.0 時 ,CH4轉化率為95.2%,其余各項對應的產量分別是0.61、0.28、2.30、0.67 mol·mol-1;空碳比為 3.0 時,以上各項對應的值分別為 98.40%、0.89、0.39、2.08、0.59 mol·mol-1.不難看出,空碳比從0.5到3.0,CH4轉化率、H2O和CO2的產量分別增加了 18.43%、0.61和0.26 mol·mol-1;H2和CO的產量在空碳比從0.5增加到 1.0時,分別增加了 0.04和 0.03 mol·mol-1,空碳比從1.0變化到2.0,二者卻下降了0.06和0.03 mol·mol-1,空碳比從2.0繼續增加到3.0,二者的產量居然下降了0.21和0.08 mol·mol-1.這是因為欠氧環境中氧氣的增加易促進了CH4、H2及CO的氧化,使得甲烷轉化率、H2O和CO2的產量相應增加.而且參與SMR反應的甲烷量在空碳比為1.0時也最大,占進料氣中甲烷含量的73%,見圖4.H2和CO在氧氣量嚴重不足時(空碳比小于1.0),甲烷轉化率較低,作為二者主要來源的SMR反應在體系中占主導地位.此時體系本身熱量不多,因此增加極少量氧氣參與反應獲得的熱量和水既促進SMR反應產氫也促進WGS反應,H2和CO增加的產量大于被氧化減少的量,故表現為先增加.隨著空碳比(大于1.0)的增加,體系熱量逐漸增加,參與SMR反應的甲烷量逐漸減少,尤其是空碳比大于2.0以后減少幅度更大,如空碳比為1.0時,參與SMR反應甲烷比例為73.00%;空碳比為2.0時,對應的值下降為67.20%;空碳比為3.0時,其值卻下降到56.40%,H2和CO在體系中增加的量因此減少較快,而空氣的增加使兩者被氧化消耗的量增大,故兩者在空碳比為1.0以后呈減少趨勢,并在空碳比達到2.0以后迅速下降.
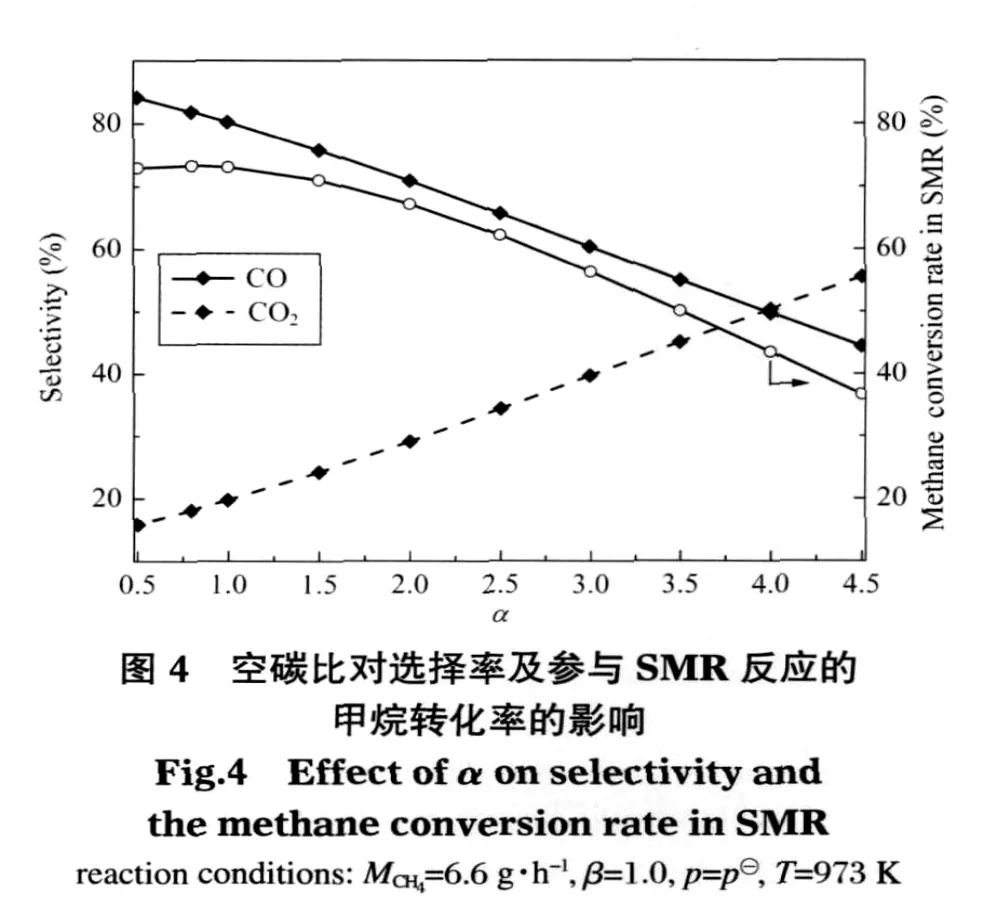
另外從圖4中CO和CO2的選擇率變化來看,空碳比較小時,CO的選擇率比CO2高得多,體系生成CO占優勢,如空碳比為1.0時,二者的選擇率分別為83%和17%.CO的選擇率隨著空碳比的增加一直減小;而CO2卻相反,且空碳比大于4.0以后,CO2的選擇率反超CO.由此看出空碳比增加對體系CO向CO2的轉化很有利,CO的產量也因消耗幅度不斷增大最終呈減小趨勢.
由此看出欠氧條件時,體系較易產生氫氣.但氧氣量過多,會使得氫氣因被氧化而大量消耗.為了盡可能維持多的氫氣產量和提高甲烷轉化率,綜合考慮微細腔內空碳比不易過高.在本文所示的反應條件下,空碳比為2.0時,甲烷的轉化率已達95%以上,此時氫氣的產量也達2.30 mol·mol-1,滿足反應體系的要求.
3.4 水蒸氣含量的影響
大空間下研究甲烷水蒸氣重整產氫要求保持較高的水蒸氣甲烷比率(3.0-5.0),文中對甲烷濕空氣重整的研究是為實現少量氫氣的產生,穩定和加強微細腔內的燃燒.不難理解,水蒸氣過多會導致微尺度環境溫度降低,影響燃燒效果,在此以研究低燃料流量(水碳比小于3.0)的自熱重整為主.
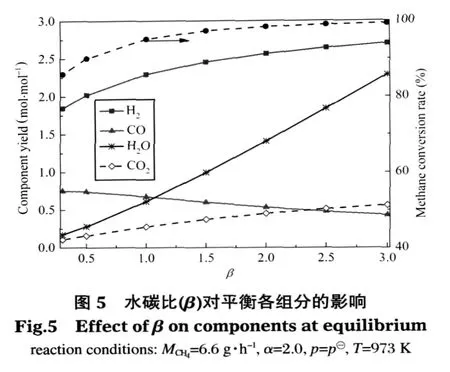
甲烷質量流量、空碳比和反應壓力不變(MCH4=6.6 g·h-1,α=2.0,p=p?),圖 5 考察了 973 K 時水碳比對熱力平衡時各組分的影響.如圖所示隨著水分的增加,H2、H2O、CO2的產量和 CH4的轉化率都隨之增加,唯獨CO的產量隨之減小.如水碳比為1.0時,CH4轉化率為 95.20%,H2、H2O、CO2和 CO 的產量分別為 2.29、0.61、0.28 和 0.67 mol·mol-1;水碳比為2.0時,CH4轉化率為98.40%,其余各項對應的值為2.56、1.41、0.45 和 0.53 mol·mol-1.水碳比從 1.0 增加到 2.0,前四項分別對應增加了 0.27、0.80、0.17 mol·mol-1和 3.20%,而 CO 的產量減少了 0.14 mol·mol-1.這是因為水分的增加推動了反應(3)、(4)式向正方向移動,導致CH4轉化率、H2和CO2產量增加,而甲烷在SMR反應中增加的幅度小于CO在反應(4)中轉化增加的幅度,如水碳比為1.0時,x和y值對應為0.28和0.11 mol·h-1;水碳比為2.0時,二者對應為0.29和0.19 mol·h-1,水碳比從 1.0變化到2.0,參與SMR反應的甲烷增加了0.01 mol·h-1,對應該反應生成的CO也增加0.01 mol·h-1,而參與WGS反應消耗的CO量增加了0.08 mol·h-1,所以CO的產量表現為減少.
從圖5中還可看出,隨著水碳比的增加,甲烷轉化率和氫氣產量增加的幅度都逐漸減少,如水碳比為0.5時,CH4轉化率為90.08%,H2的產量為2.02 mol·mol-1;水碳比為1.5時,二者對應的值分別為97.33%和2.45 mol·mol-1.水碳比從0.5增加到1.0,二者分別增加了5.12%和0.29 mol·mol-1;而水碳比從1.0增加到1.5,二者的增加量分別減少到2.13%和 0.16 mol·mol-1.此外,水碳比達 2.5以后,CH4的轉化率和H2的產量趨于穩定,二者上升的空間不大.如水碳比為2.5時,CH4轉化率為98.96%,H2的產量為2.64 mol·mol-1;水碳比為3.0時,二者對應的值分別為99.30%和2.70 mol·mol-1.水碳比從2.5增加到3.0,二者僅分別增加了0.34%和0.06 mol·mol-1.
在本文甲烷質量流量一定的條件下,微細腔內水碳比選擇在1.0-2.5之間比較適宜,既可以滿足水蒸氣的含量不易過高,又能保持95%以上的甲烷轉化率和較高的產氫量.
3.5 有氧與無氧系統的比較
空碳比分別取為2.0和0.0,其他基本參數不變(MCH4=6.6 g·h-1,β=1.0,p=p?),考察不同溫度下有氧和無氧條件時平衡組分變化的情況,見圖1、6、7.從圖1和圖6對比可知,隨著溫度的變化兩種反應系統平衡時各組分的變化趨勢大致相同,即溫度越高,CH4的轉化率、H2和CO的產量越高;H2O量越少;CO2的產量先增加后減小且均在823 K達最大值.由圖7(a)可知,在相同的低溫環境中,有氧系統甲烷的轉化率和氫氣產量都高于無氧系統.這是因為在有氧環境中,氧的存在有利于原料氣中甲烷氧化反應的發生,氧化反應本身放出的熱量和部分水分的增加大大促進了強吸熱SMR反應的進行,而低溫條件本身就利于WGS反應的進行,從而有氧條件下甲烷的轉化率和氫氣產量相對比較高;而無氧環境中甲烷主要通過從外界吸收大量的熱和送入的水蒸氣重整產生氫氣,溫度較低時不利于重整反應的進行,所以甲烷轉化率和氫氣產量較低.
空碳比分別取為2.0和0.0,甲烷質量流量和反應壓力不變,考察973 K不同水碳比對有氧和無氧系統平衡時甲烷轉化率和氫氣產量的影響,見圖7(b).可以看出,隨著水碳比的增加,有氧系統的甲烷轉化率明顯高于無氧系統.如水碳比為1.0時,有氧體系甲烷轉化率為95.2%,而無氧體系對應的值只有70.40%.
此外,當水碳比較小時(小于1.0),在相同的甲烷質量流量和反應溫度條件下,有氧系統比無氧系統相比,氫氣量要高得多.如水碳比為0.5時,有氧體系氫氣產量為2.02 mol·mol-1,而無氧體系對應的值為1.35 mol·mol-1.這是因為,水碳比小于1.0時,氫氣的量主要依賴參與SMR反應中水的量,有氧系統中甲烷氧化反應生成的部分水彌補了SMR反應水分不足的情況,生成的氫氣相對較多;而無氧系統單靠外界提供的少量水,甲烷轉化量小,生成氫氣的量自然小于有氧系統.當水碳比大于1.0時,有氧系統產生氫氣的量小于無氧系統對應的量.這是因為此時水蒸氣的量相對充足,氫氣的產生主要依賴參與SMR反應中甲烷的量,有氧系統中部分氧化消耗了甲烷,使得SMR反應量減少;而無氧系統中,甲烷主要用來與水蒸氣發生重整產氫,從反應式(3)、(4)物質前后的摩爾比變化可知,氫氣增加的量比有氧系統多,所以無氧系統中氫氣的產量逐漸大于有氧系統.
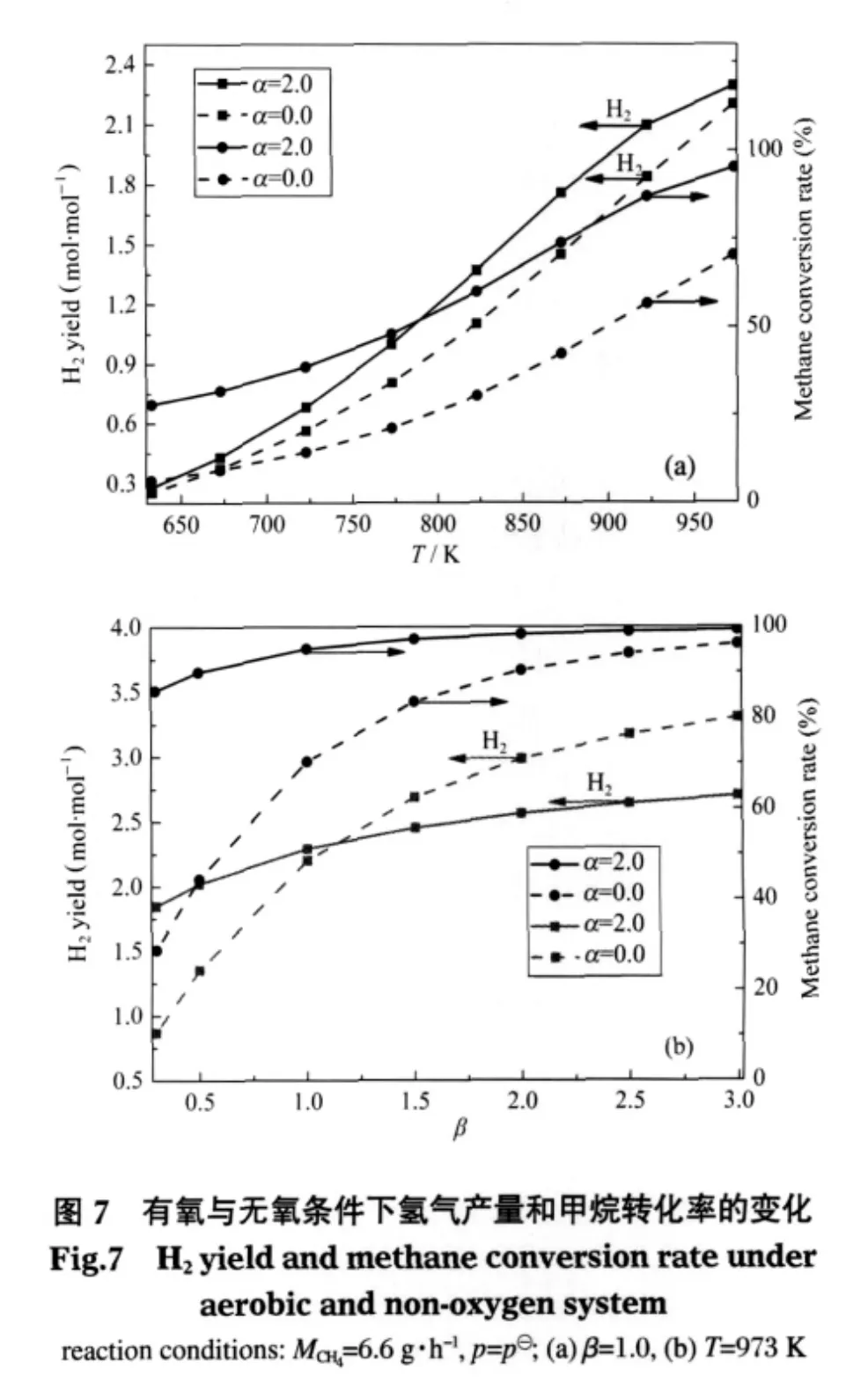
因此,要想在微細腔內實現甲烷自熱重整制氫,獲得較高的甲烷轉化率和氫氣量來促進腔內的點火和穩燃,在相同的甲烷質量流量條件下,有氧系統比無氧系統在低溫和低水碳比的環境中更具有優勢.
4 結 論
(1)溫度在633-973 K之間能實現微細腔內甲烷自熱重整,各組分在此區間的變化幅度較大,溫度超過973 K以后,各組分的體積含量趨于穩定,小于此范圍甲烷自熱重整不易發生.此范圍內能獲得高于28%的甲烷轉化率和高于0.27 mol·mol-1的氫氣產量;并且溫度在823 K時,CO2產量最多為0.41 mol·mol-1.
(2)微細腔內壓力過高,反應會向體積減小的方向進行,甲烷轉化率和氫氣產量減少,其余組分變化不大.反應壓力應維持在不大于0.10 MPa的條件下,才更有利于633-973 K范圍內實現微細腔低溫自熱重整產氫.
(3)微細腔內隨著空碳比的增加,甲烷轉化率、H2O和CO2的產量均增加,H2和CO的產量在空碳比為1.0時最大分別為2.36和0.70 mol·mol-1,此后有所減少但變化不明顯,而空碳比大于2.0后H2和CO迅速下降.體系中CO2選擇率隨空碳比增加一直升高,CO則相反,但空碳比較小時,CO的選擇率比CO2高得多,空碳比大于4.0以后,CO2的選擇率超過CO.為了維持較多的氫氣產量和較高甲烷轉化率,空氣量不應太大.空碳比為2.0時,氫氣產量達2.30 mol·mol-1,而甲烷的轉化率可達95%以上.
(4)水碳比的增加有利于自熱重整產氫及甲烷轉化的進行.在一定甲烷質量流量條件下,微細腔內的水碳比選擇在1.0-2.5之間比較適宜,既滿足水量不易過高,又能保持95%以上的甲烷轉化率和較高的氫氣產量.
(5)在微細腔的低溫環境下,有氧的甲烷自熱系統比無氧甲烷重整系統更具有優勢.甲烷質量流量一定時,在相同的低水碳比條件下,有氧系統能獲得更高的甲烷轉化率和氫氣產量.
1 Hua,J.S.;Wu,M.;Kumar,K.Chem.Eng.Sci.,2005,60(13):3497
2 Wang,Y.;Chin,Y.H.;Rozmiarek,R.T.;Johnson,B.R.;Gao,Y.;Watson,J.;Tonkovich,A.Y.L.;Vander Wiel,D.P.Catal.Today,2004,98(4):575
3 Ran,J.Y.;Hu,J.H.Proceedings of the Chinese Society for Electrical Engineering,2007,27(8):42 [冉景煜,胡建紅.中國電機工程學報,2007,27(8):42]
4 Zhang,L.;Yan,Y.F.Microfabrication Technology,2008,1:49[張 力,閆云飛.微細加工技術,2008,1:49]
5 Tonkovich,A.L.Y.;Yang,B.;Perry,S.T.;Fitzgerald,S.P.;Wang,Y.Catal.Today,2007,120(1):21
6 Dias,J.A.C.;Assaf,J.M.J.Power Sources,2005,139(1/2):176
7 Ayabe,S.;Omoto,H.;Utaka,T.Appl.Catal.A-Gen.,2003,241(1/2):261
8 Chan,S.H.;Ding,O.L.Int.J.Hydrog.Energy,2008,33:633
9 Zhang L.;Yan,Y.F.Journal of Chemical Industry and Engineering(China),2009,60(3):627 [張 力,閆云飛.化工學報,2009,60(3):627]
10 Hu,G.X.;Wang,M.L.;Li,Y.H.Proceedings of the Chinese Society for Electrical Engineering,2004,24(1):201 [胡國新,王明磊,李艷紅.中國電機工程學報,2004,24(1):201]
11 Lee,S.H.D.;Applegate,D.V.;Ahmed,S.;Calderone,S.G.;Harvey,T.L.Int.J.Hydrog.Energy,2005,30:829
12 Ahmed,S.;Krumpelt,M.Int.J.Hydrog.Energy,2001,26:291
13 Christensen,T.S.;Primdahl,I.I.Hydrocarbon Process Int.Ed.,1994,5:39
14 Chen,Z.Y.Chemical thermodynamics and refractory compositions.Beijing:Metallurgical Industry Press,2005:162-172 [陳肇友.化學熱力學與耐火材料.北京:冶金工業出版社,2005:162-172]
15 Furjes,P.;Bognar,G.;Barsony,I.Sensor Actuat.B-Chem.,2006,120(1):270
16 Ye,D.L.Practical handbook of thermodynamic data of inorganic.Beijing:Metallurgical Industry Press,2002:1-9,228-1183[葉大倫.實用無機物熱力學數據手冊.北京:冶金工業出版社,2002:1-9,228-1183]
Thermodynamic Analysis of Low Temperature Methane Wet-Air Reforming in a Microcombustor
RAN Jing-Yu*ZHAO Liu-Jie
(College of Thermal Power Engineering,Chongqing University,Chongqing 400044,P.R.China)
O642
Received:April 12,2010;Revised:July 9,2010;Published on Web:September 28,2010.
*Corresponding author.Email:ranjy@cqu.edu.cn;Tel:+86-23-65103114.
The project was supported by the National Natural Science Foundation of China(50876118)and New Century Excellent Talent Project of Ministry of Education,China(NCET-08-0605).
國家自然科學基金(50876118)和教育部新世紀優秀人才計劃(NCET-08-0605)資助項目

