壬基酚長期暴露對斑馬魚雄魚第二性征、精子活力的影響
夏繼剛,牛翠娟,高穎,裴雪姣
北京師范大學生命科學學院生物多樣性與生態工程教育部重點實驗室,北京100875
壬基酚長期暴露對斑馬魚雄魚第二性征、精子活力的影響
夏繼剛,牛翠娟*,高穎,裴雪姣
北京師范大學生命科學學院生物多樣性與生態工程教育部重點實驗室,北京100875
研究了不同濃度下(0(對照)、0.1、1、10、100μg·L-1)壬基酚(NP)長期暴露對斑馬魚(Brachydanio rerio)雄魚第二性征、精子活力的影響.結果表明,NP暴露對斑馬魚第二性征的影響顯著,可導致雄性個體出現泄殖乳突、腹部膨大等典型雌性化特征.100μg·L-1NP暴露導致76.9%的雄魚出現泄殖乳突.NP暴露對斑馬魚精子激活率的影響顯著,隨NP暴露濃度升高精子激活率下降,呈現負相關的劑量-效應關系.NP暴露對斑馬魚精子壽命和精子劇烈運動時間均有顯著影響.低劑量(0.1μg·L-1)和高劑量(100μg·L-1)NP暴露下精子壽命及其劇烈運動時間顯著縮短,而中等劑量(10μg·L-1)NP對上述指標影響不顯著(p>0.05).斑馬魚第二性征、精子活力可作為指示水體環境雌激素毒理學效應的敏感指標.
壬基酚;第二性征;精子活力;斑馬魚
1 引言(Introduction)
環境內分泌干擾物(Endocrine Disrupting Chemicals,EDCs)對水生生物生命活動的影響以及對人類生殖健康的潛在威脅正日益引起人們的廣泛關注.壬基酚(Nonylphenol,NP)是一種非離子表面活性劑,廣泛應用于造紙、紡織、橡膠塑料、洗滌劑和化妝品等生產中,與人們的日常生活關系十分密切.NP也是壬基酚聚氧乙烯醚(NPEO)的降解產物,在污水處理后的水體中廣泛存在(Ahel et al.,1994),愈來愈多的研究表明,NP具有雌激素活性,是一種環境內分泌干擾物(Jobling et al.,1996;Schwaiger et al.,2002;Chikae et al.,2003).目前,大量有關NP內分泌干擾效應的文獻報道集中于NP誘導的雄魚睪丸退化、性激素水平的改變以及肝臟卵黃蛋白原生成等方面(Jobling et al.,1996;Schwaiger et al.,2002;Chikae et al.,2003;Kobayashi et al.,2005).相對而言,有關NP對第二性征、精子活力等方面的研究報道較為少見(Hara et al.,2007).
精子活力是評價精液質量的重要指標,良好的精子活力是進行成功受精的基礎(Vladi? and Jarvi,1997;Kime et al.,1996).有研究表明,魚類精子對水體環境污染非常敏感,精子活力可作為敏感而精確的生物標志(biomarker),用于水體環境內分泌干擾物污染評價(Hara et al.,2007;Hashimoto et al.,2009;Singh et al.,2008;Nice,2005).研究表明,17α-乙炔基雌二醇(EE2)暴露3周,可導致青鳉(Oryzias latipes)精子運動速率和精子激活率升高(Hashimoto et al.,2009);NP短期暴露可導致青鳉精子運動速率和精子激活率下降(Hara et al.,2007);2周NP暴露對青鳉精子運動速率的影響不顯著(Kawana et al.,2003);NP長期暴露可導致具有活動精子的牡蠣(Crassostrea gigas)數量顯著減少(Nice,2005).除精子活力外,魚體第二性征也是水體環境內分泌干擾物監測敏感而可靠的生物標志(Bjerselius et al.,2001;Larsen et al.,2008).
斑馬魚(Brachydanio rerio)是一種小型熱帶魚,由于其世代周期短、產卵量大、易收集、易于大規模飼養等特點,現已成為經濟合作與發展組織(OECD)常規試驗魚種,并作為模式生物被廣泛用于化學品的各種毒性測試,是研究內分泌干擾作用的理想實驗動物和水體污染監測的理想指示生物(Kime and Nash,1999;Kime,1999).然而,內分泌干擾物對斑馬魚精子活力的影響尚不完全清楚,尚未見NP暴露對斑馬魚雄魚第二性征、精子活力影響的文獻報道.為進一步探索NP的環境雌激素效應,并篩選生物標志物,本文研究了NP長期暴露對斑馬魚雄魚第二性征、精子活力的影響.
2 材料與方法(Materials and methods)
2.1 實驗動物與試劑
斑馬魚種魚由北京大學斑馬魚中心提供,實驗用魚為經過本實驗室多代培養的純種品系,飼養方法參照Westerfield(1995).實驗條件:實驗用水為充分曝氣脫氯并經活性炭過濾的自來水,水溫(25±1)℃,pH 7.8±0.03,光周期14L:10D,ρ<1g·L-1,每日投喂2次冰凍紅蟲,投喂15min后,吸去殘餌.選取120d以上,健康狀況良好的斑馬魚進行實驗,平均體重(0.406±0.003)g(n=90).
壬基酚(NP,Sigma公司),以丙酮(分析純,國藥集團化學試劑有限公司)為助溶劑,配制成10mg·mL-1的NP母液,并稀釋到相應濃度,4℃避光保存,待用.對照組丙酮濃度為10μL·L-1,低于Hutchinson等(2006)所推薦的最大濃度.
2.2 暴露處理
暴露容器為24cm×18cm×20cm的方形玻璃缸.為避免產生應激反應,正式暴露試驗前,使魚群處于試驗環境條件下,馴養適應2周.實驗設5個濃度梯度:0、0.1、1、10、100μg·L-1.每個梯度隨機放入健康活潑的斑馬魚雄魚15尾,每個處理設3個平行組.采用半靜態暴露裝置,每日換水50%,持續暴露70d.
2.3 第二性征
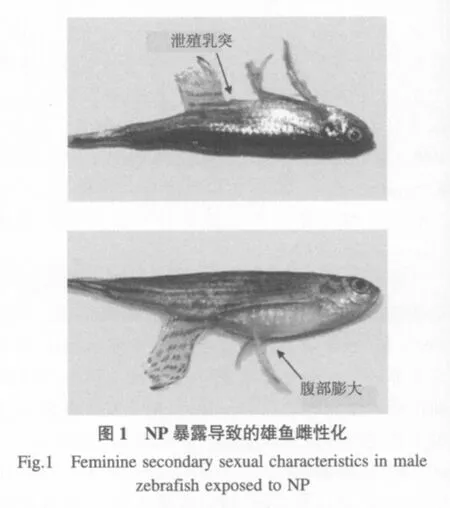
斑馬魚雌雄分別具有以下典型特征(Laale,1977;Larsen et al.,2008):①體型:雌魚身體比雄魚粗壯,尤其是腹部膨大,體圓,各鰭均比雄魚短小,但不明顯;雄魚體細長扁平,呈桿形,沒有明顯突出的腹部.雌魚的體高/體長比要明顯高于雄魚.②體色:雌魚的藍色條紋偏藍而鮮艷,間以銀灰色條紋;雄魚藍色條紋偏黃,間以檸檬色條紋.③泄殖乳突(Urogenital papillae):此為雌魚所具有的典型特征,雄魚無.暴露60d后,檢查各處理組魚的第二性征并拍照,有改變計為“1”,無改變計為“0”.
2.4 精子活力
參照文獻(劉鑒毅等,2007;Alavi et al.,2006),用激活率、劇烈運動時間、總運動時間(精子壽命)等指標來評價精子活力.激活率以顯微鏡下同一視野中的活動精子百分比表示;劇烈運動時間是指從精液與激活液混合開始,到約70%運動精子轉入緩慢運動為止的時間;總運動時間是指從精液與激活液混合開始,到視野中約90%的精子停止活動或原地震顫為止的時間.
暴露70d后,顯微鏡下觀測精子活力.用移液槍吸取各濃度溶液10μL于干燥潔凈的載玻片上,調節好顯微鏡,用解剖針尖從性腺蘸取少許精液涂在載波片上,與溶液混勻,即刻于10×20倍顯微鏡下觀察精子活動情況,并用秒表記錄各運動階段的時間.每尾魚重復2次.實驗室溫(26±1)℃.由于寄生蟲感染也會導致動物生理過程的破壞,從而干擾藥物的作用效應(Hinton et al.,1992),實驗結束后,在解剖鏡下解剖并檢查每條魚的疾病及寄生蟲感染情況.
2.5 數據處理
應用軟件SPSS for Windows 16.0進行統計分析.對數據進行正態性檢驗后,用單因素方差分析(ANOVA)和LSD多重比較檢驗差異顯著性;χ2-檢驗對比率數據進行統計分析;線性回歸分析精子激活率與暴露濃度的關系.各組數據均用平均值±標準誤表示,p<0.05為差異顯著,p<0.01為差異極顯著.
3 結果(Results)
經解剖檢查,未發現有明顯寄生蟲感染的動物個體.對精子活力的觀察,100μg·L-1NP處理組樣本大小為n=11,其余各組n=15.
3.1 第二性征
NP暴露對斑馬魚雄魚第二性征的影響顯著,可導致雄性個體出現泄殖乳突(χ2=53.48;p<0.01)、腹部膨大(χ2=44.67;p<0.01)等典型雌性化特征(表1,圖1).100μg·L-1的NP暴露導致76.92%的雄魚出現泄殖乳突(p<0.01);濃度高于10μg·L-1的NP暴露可以顯著改變雄性斑馬魚的體型,導致腹部膨大(p<0.05).
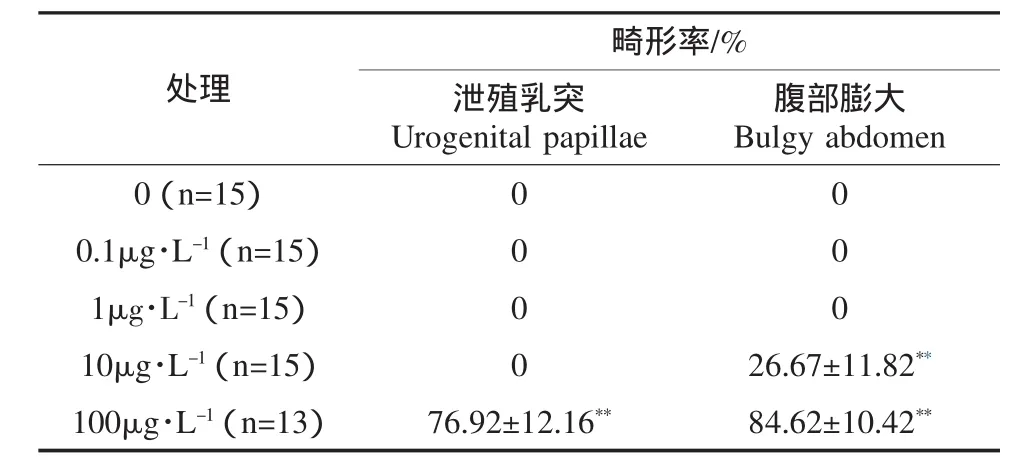
表1 NP暴露60d對斑馬魚雄魚第二性征的影響Table 1Secondary sexual characteristics of male zebrafish after being exposed to different NP concentrations for 60 days
3.2 精子活力
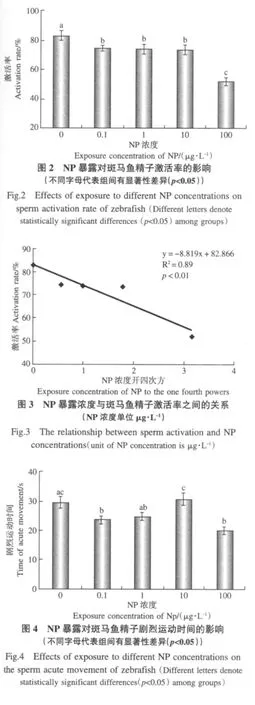
NP暴露對斑馬魚精子激活率的影響顯著(χ2=118.6;p<0.01).隨NP暴露濃度的升高,精子激活率逐漸下降,100μg·L-1NP暴露導致精子激活率極顯著下降(p<0.01)(圖2);NP暴露濃度與精子激活率呈現顯著負相關的劑量-效應關系(圖3).
NP暴露對斑馬魚精子劇烈運動時間的影響顯著(F=5.90;p<0.01).隨NP暴露濃度的提高,精子劇烈運動時間表現為低劑量(0.1μg·L-1)下減少(p<0.05),中高劑量(1、10μg·L-1)有所回升差異不顯著,高劑量(100μg·L-1)下極顯著減少(p<0.01)(圖4).
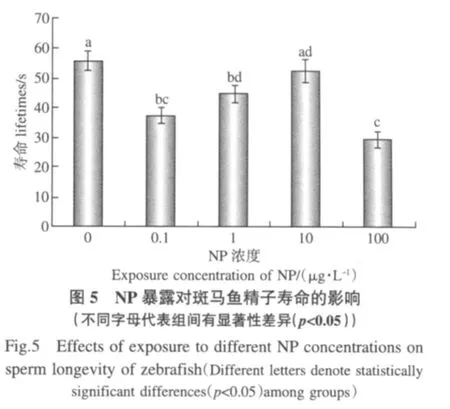
NP暴露對斑馬魚精子壽命的影響顯著(F=11.31;p<0.01).低劑量組(0.1μg·L-1)與高劑量組(100μg·L-1)精子壽命均極顯著縮短(p<0.01),而中高劑量組(10μg·L-1)與對照組相比并無顯著性差異(p>0.05)(圖5).
4 討論(Discussion)
4.1 第二性征
魚類的第二性征是由體內雄激素和雌激素的平衡所調控的(Kime,1998).內分泌干擾物暴露可以導致魚類第二性征的改變(Bjerselius et al.,2001;Larsen et al.,2008;Brion et al.,2004;Toft and Baatrup,2001),17β-雌二醇水體暴露可導致全部雄性金魚失去追星(Tubercles)(Bjerselius et al.,2001);Brion等(2004)的研究表明,25ng·L-117β-雌二醇暴露3周可誘導斑馬魚雄魚出現泄殖乳突,且隨著劑量的升高出現比例增大;Larsen等(2008)的研究表明,EE2對斑馬魚泄殖乳突的影響顯著,0.05ng·L-1EE2暴露就可導致出現泄殖乳突的比例顯著升高,同時,5.00ng·L-1高濃度EE2暴露可導致雄魚體圓、腹部膨大.長期的內分泌干擾物暴露可能通過作用于下丘腦-垂體-性腺軸,持續干擾促性腺激素的合成與分泌,進而破壞動物體內雄激素和雌激素的平衡,最終導致第二性征的改變.本文的研究結果與上述文獻報道相一致.斑馬魚第二性征可作為指示水體內分泌干擾物的敏感指標,用于環境監測.
4.2 精子活力
魚類精子是一類分化程度很高的細胞,由于精巢和精漿中存在抑制因子,精子在精巢中不活動,一旦排入水中,精子便立即被激活而開始運動(Hara et al.,2007).精子的運動是靠其尾部鞭毛的擺動,外界環境因子對魚類精子活力的影響,主要是通過影響cAMP-ATP-Mg2+系統來影響鞭毛的活動而實現(Hoar et al.,1978).精子活力的評價指標主要有精子激活的比例、精子激活后的運動時間、精子運動的激烈程度等(Alavi et al.,2006).Hara等(2007)發現NP短期暴露導致青鳉精子激活率下降;Nice(2005)的研究結果表明,NP對牡蠣精子活力的影響具有明顯的劑量-效應關系,1μg·L-1和100μg·L-1NP暴露可分別導致具有活動精子的牡蠣數從100%下降到30%和12.5%;Kinnberg等(1999)指出,NP可能通過破壞動物體內性激素水平的平衡影響到睪丸支持細胞(Sertoli cells)的正常功能,進而影響精子質量,Sertoli cells以其獨特的結構和功能為精子發生提供適宜的微環境,并為生精細胞提供營養支持,對生精細胞發育和活動具有至關重要的調控作用.此外,精子激活率的降低也可能是由于內分泌干擾物暴露導致精子畸形、缺少鞭毛或鞭毛運動受到抑制造成的(Rurangwaetal.,2002;McAllisterandKime,2003).本研究中,NP暴露對斑馬魚精子激活率的影響顯著,隨NP暴露濃度升高,精子激活率逐漸下降,呈顯著負相關的劑量-效應關系.研究結果與Nice(2005)和Hara等(2007)相一致.
精子運動的時間長短以及劇烈程度具有十分重要的生物學意義,與哺乳類相比,魚類精子激活后運動時間很短,精子必須在有限時間里找到和進入受精孔(Billard,1978).本文實驗中,NP暴露對斑馬魚精子壽命和精子劇烈運動時間的影響均顯著,并表現為低劑量(0.1μg·L-1)和高劑量(100μg·L-1)下顯著縮短,而在中等劑量(10μg·L-1)暴露濃度下影響不顯著,提示NP暴露對精子活力的影響可能具有低劑量-效應(Welshons et al.,2003).NP對精子活力影響的作用機制在高劑量和低劑量下可能不同,低劑量下精子壽命和劇烈運動時間的縮短可能是由于內分泌干擾物暴露促使精子運動速率增加,從而導致精子儲存能量的快速耗竭所造成的(Hashimoto et al.,2009),而高劑量下精子活力的下降可能是內分泌干擾物暴露直接導致精子細胞線粒體呼吸作用受到抑制、能量代謝受阻、鞭毛運動受到抑制所致(Rurangwa et al.,2002;McAllister et al.,2003).有關NP暴露對斑馬魚精子形態學、精子運動速率、精子能量代謝及精液成分的影響有待于進一步研究.
Ahel M,Giger W,Schaffner C.1994.Behaviour of alkylphenol polyethoxylate surfactants in the aquatic environment—II.Occurrence and transformation in rivers[J].Water Research,28(5):1143-1152
Alavi S M H,Cosson J,Kazemi R.2006.Semen characteristics inAcipenserpersicusinrelationtosequentialstripping[J].Journal of Applied Ichthyology,22(Suppl.1):400-405
Billard R.1978.Changes in structure and fertilizing ability of marineandfreshwaterfishspermatozoadilutedinmediaof various salinities[J].Aquaculture,14(3):187-198
Bjerselius R,Lundstedt-Enkel K,Olsén H,Mayer I,Dimberg K.2001.Male goldfish reproductive behaviour and physiology are severely affected by exogenous exposure to 17β-estradiol[J].Aquatic Toxicology,53(2):139-152
Brion F,Tyler C R,Palazzi X,Laillet B,Porcher J M,Garric J,FlammarionP.2004.Impactsof17β-estradiol,including environmentallyrelevantconcentrations,onreproductionafter exposure during embryo-larval-,juvenile-and adult-life stages in zebrafish(Danio rerio)[J].Aquatic Toxicology,68(3):193-217
Chikae M,Ikeda R,HasanQ,Morita Y,Tamyia E.2003.Effect of alkylphenols on adult male medaka:Plasma vitellogenin goesuptothelevelofestrousfemale[J].Environmental Toxicology and Pharmacology,15(1):33-36
Hara Y,Strüssmann C A,Hashimoto S.2007.Assessment of short-term exposure to nonylphenol in Japanese medaka using sperm velocity and frequency of motile sperm[J].Archives of Environmental Contamination and Toxicology,53(3):406-410
Hashimoto S,Watanabe E,Ikeda M,Terao Y,Strüssmann C A,Inoue M,Hara A.2009.Effects of ethinylestradiol on medaka(Oryzias latipes)as measured by sperm motility and fertilization success[J].ArchivesofEnvironmentalContaminationand Toxicology,56(2):253-259
Hinton D E,Baumann P C,Gardner G R,Hawkins WE,HendricksJD,MurchelanoRA,OkihiroMS.1992.Histopathological biomarkers[A].//Huggett R J,Kimerle R A,MehrlePM,BergmanHL.Biomarkers,Biochemical,Physiological,andHistopathologicalMarkersofAnthropogenic Stress[C].Boca Raton,FL:Lewis Publishers,155-209
Hoar W S,Randall D J,Donaldson E M.1978.Fish Physiology[M].New York:Academic Press,31-53
HutchinsonTH,ShillabeerN,WinterM J,PickfordDB.2006.Acute and chronic effects of carrier solvents in aquatic organisms:a critical review[J].Aquatic Toxicology,76(1):69-92
Jobling S,Sumpter J P,Sheahan D,Osborne J A,MatthiessenP.1996.Inhibitionoftesticulargrowthinrainbowtrout(Oncorhynchus mykiss)exposed to estrogenic alkylphenolic chemicals[J].Environmental Toxicology and Chemistry,15(2):194-202
Kawana R,Strüssmann C A,Hashimoto S.2003.Effect of pnonylphenolonspermmotilityinJapanesemedaka(Oryzias latipes)[J].Fish Physiology and Biochemistry,28(1-4):213-214
Kime D E,Ebrahimi M,Nysten K,Roelants I,Rurangwa E,Moore H D M,Ollevier F.1996.Use of computer assisted sperm analysis(CASA)for monitoring the effects of pollution on sperm quality of fish;application to effects of heavy metals[J].Aquatic Toxicology,36(3-4):223-237
Kime D E,Nash J P.1999.Gamete viability as an indicator of reproductive endocrine disruption in fish[J].Science of the Total Environment,233(1-3):123-129
KimeDE.1999.Astrategyforassessingtheeffectsof xenobioticsonfishreproduction[J].ScienceoftheTotal Environment,255(1-2):3-11
Kime D H.1998.Endocrine Disruption in Fish[M].Norwell,USA:Kluwer Academic Publishers
Kinnberg K,Korsgaard B,BjerregaardP,Jespersen A.1999.Effects of nonylphenol and 17β-estradiol on vitellogenin synthesis and testis morphology in male platyfish Xiphophorus maculates[J].Journal of Experimental Biology,203(Pt.2):171-181
Kobayashi K,Tamotsu S,Yasuda K,Oishi T.2005.Vitellogeninimmunohistochemistry in the liver and the testis of the Medaka,Oryzias latipes,exposed to 17β-estradiol and p-nonylphenol[J].Zoological Science,22(4):453-461
Laale H W.1977.The biology and use of zebrafish,Brachydanio rerio,in fisheries research[J].Journal of Fish Biology,10(2):121-173
Larsen M G,Hansen K B,Henriksen P G,Baatrup E.2008.Malezebrafish(Daniorerio)courtshipbehaviourresiststhe feminizing effects of 17α-ethinyloestradiol—morphological sexual characteristics do not[J].Aquatic Toxicology,87(4):234-244
Liu J Y,Gan F,Wei Q W,Du H,Zhu Y J.2007.Effects of different concentration of irons and monosaccharides on sperm motilityofChineseSturgeon(AcipenserSinensis)[J].Acta Hydrobiologica Sinica,31(6):849-854(in Chinese)
McAllisterBG,KimeDE.2003.Earlylifeexposureto environmental levels of the aromatase inhibitor tributyltin causes masculinisationandirreversiblespermdamageinzebrafish(Danio rerio)[J].Aquatic Toxicology,65(3):309-316
Nice H E.2005.Sperm motility in the Pacific oyster(Crassostrea gigas)is affected by nonylphenol[J].Marine Pollution Bulletin,50(12):1668-1674
Rurangwa E,Biegniewska A,Slominska E,Skorkowski E F,Ollevier F.2002.Effect of tributyltin on adenylate content and enzyme activities of teleost sperm:a biochemical approach to study the mechanisms of toxicant reduced spermatozoa motility[J].Comparative Biochemistry and Physiology-Part C:Toxicology&Pharmacology,131(3):335-344
Schwaiger J,Mallow U,Ferling H,Knoerr S,Braunbeck T H,Kalbfus W,Negele R D.2002.How estrogenic is nonylphenol?Atransgenerationalstudyusingrainbowtrout(Oncorhynchus mykiss)as a test organism[J].Aquatic Toxicology,59(3-4):177-189
Singh P B,Sahu V,Singh V,Nigam S K,Singh H K.2008.Spermmotilityinthefishesofpesticideexposedandfrom polluted rivers of Gomti and Ganga of north India[J].Food and Chemical Toxicology,46(12):3764-3769
Toft G,Baatrup E.2001.Sexual characteristics are altered by 4-tert-octylphenoland17β-estradiolintheadultmaleguppy(Poecilia reticulata)[J].Ecotoxicology and Environmental Safety,48(1):76-84
Vladi? T,J?rvi T.1997.Sperm motility and fertilization time span in Atlantic salmon and brown trout-the effect of water temperature[J].Journal of Fish Biology,50(5):1088-1093
Welshons W V,Thayer K A,Judy B M,Taylor J A,Curran E M,vom Saal F S.2003.Large effects from small exposures I.Mechanismsforendocrine-disruptingchemicalswithestrogenic Activity[J].Environmental Health Perspectives,111(8):994-1006
WesterfieldM.1995.TheZebrafishBook:AGuideforthe Laboratory Use of Zebrafish(Danio rerio)[M].Eugene:University of Oregon Press,9-25
中文參考文獻
劉鑒毅,甘芳,危起偉,杜浩,朱永久.2007.幾種不同濃度的離子及單糖對中華鱘精子活力的影響[J].水生生物學報,31(6):849-854◆
Effects of Long-Term Exposure to Nonylphenol on Secondary Sexual Characteristics and Sperm Motility of Male Zebrafish(Brachydanio rerio)
XIA Ji-gang,NIU Cui-juan*,GAO Ying,PEI Xue-jiao
Ministry of Education Key Laboratory for Biodiversity Science and Ecological Engineering,College of Life Sciences,Beijing Normal University,Beijing 100875
The present work examined the effects of long-term exposed to different nonylphenol(NP)concentrations(0(control),0.1,1,10,100μg·L-1)on secondary sexual characteristics and sperm motility of male zebrafish(Brachydanio rerio).Results showed that male secondary sexual characteristics were significantly affected by NP exposure,showing visible urogenital papillae and bulgy abdomen,which belong to the female.76.9%males were feminised with development of urogenital papillae at 100μg·L-1NP.Sperm activation rate showed a negative correlation with NP concentration.NP exposure also showed marked influence on acute movement time and longevity of the zebrafish sperm.Both the above two parameters were clearly shorter at low-dose(0.1μg·L-1)and high-dose(100μg·L-1)treatment comparing with the control.However,it was similar with the control at medium-dose(10μg·L-1).The results suggested that the secondary sexual characteristics and sperm motility of male zebrafish might be used as the sensitive indexes of aquatic environmental endocrine disrupting chemicals.
nonylphenol;secondary sexual characteristics;sperm motility;zebrafish
20 April 2009accepted2 June 2009
1673-5897(2010)1-044-06
X171.5
A
2009-04-20錄用日期:2009-06-02
國家自然科學基金重點項目(No.40632009)
夏繼剛(1980—),男,博士;*通訊作者(Corresponding author),E-mail:cjniu@bnu.edu.cn
牛翠娟(1965—),女,1992年獲日本北海道大學博士學位,2000年起擔任北京師范大學生命科學學院教授、博士生導師.2004年至2005年加拿大University of British Columbia訪問學者.長期從事水生生物生理生態與生態毒理學研究.主持或參加國家自然科學基金項目、國家863計劃項目,國家重大基礎研究計劃項目(973)等20余項,發表論文近百篇.

