高效液相色譜法測定動物組織中喹乙醇標示殘留物
張小軍,鄭 斌*,陳雪昌,余海霞,梅光明
(1.浙江省海洋水產研究所,浙江 舟山 316100;2.浙江工商大學食品與生物工程學院,浙江 杭州 310035;3.浙江省海洋開發研究院,浙江 舟山 316000;4.浙江大學舟山海洋研究中心,浙江 舟山 316000)
高效液相色譜法測定動物組織中喹乙醇標示殘留物
張小軍1,2,鄭 斌3,*,陳雪昌1,余海霞4,梅光明1
(1.浙江省海洋水產研究所,浙江 舟山 316100;2.浙江工商大學食品與生物工程學院,浙江 杭州 310035;3.浙江省海洋開發研究院,浙江 舟山 316000;4.浙江大學舟山海洋研究中心,浙江 舟山 316000)
建立動物組織中喹乙醇標示殘留物3-甲基喹噁啉-2-羧酸(MQCA)的高效液相色譜測定方法。肌肉組織通過鹽酸水解提取MQCA,陰離子固相萃取柱凈化,高效液相色譜定量。方法在4.0~200μg/kg添加范圍內的平均回收率為82.1%~90.3%,相對標準偏差均小于7%,方法定量限為4.0μg/kg。
高效液相色譜;喹乙醇標示殘留物;3-甲基喹噁啉-2-羧酸
喹乙醇屬于喹噁啉類化合物,在水產養殖業中常作為一種較好的生長促進劑添加于飼料中。喹乙醇本身不穩定,在動物體內能夠在短時間內代謝,其10多種代謝產物中3-甲基喹噁啉-2-羧酸(MQCA)是主要代謝物,在體內相對穩定,是歐盟規定的標示殘留物。喹乙醇及其代謝物有致癌、至畸變作用,食用含有該類藥物殘留的肉類產品會對人體造成危害[1]。
目前動物食品中常用的MQCA檢測方法有液相色譜法[2-4]、液相色譜-串聯質譜法[5-6]、納米膠體金探針法[7]等。納米膠體金探針法不能夠準確定量,液質聯用法由于儀器昂貴而不能夠普及,影響檢測方法推廣應用。本實驗采用酸水解前處理和固相萃取等方法,研究并建立適用于動物食品中MQCA測定的高效液相色譜方法,為喹乙醇及其代謝物的檢測及監控提供一種提取凈化效果好、靈敏度高、重現性好的定量分析方法。
1 材料與方法
1.1 材料與試劑
豬肉、牛肉、對蝦和草魚購自舟山東河市場,用組織搗碎機搗碎,混合均勻。
實驗用水為Milli-Q制備高純水;甲醇、甲酸、乙酸乙酯(均為色譜純) MERK公司;鹽酸(分析純) 中國上海試劑總廠;3-甲基喹噁啉-2-羧酸標準品(純度>98%) 德國Dr公司;其他試劑均為分析純。
1.2 儀器與設備
Alliance 2695高效液相色譜儀(帶紫外檢測器)、60mg/3mL MAX陰離子交換固相萃取柱 美國Waters公司;T18勻漿機、MS2漩渦混合器 德國IKA公司;Centrifuge5810高速離心機 Eppendorf公司;N-EVAP112氮吹儀 Organomation公司;SHA-B水浴恒溫振蕩器江蘇億通電子有限公司。
1.3 方法
1.3.1 提取
稱取(5±0.02)g樣品置于50mL離心管中,加入15mL 2mol/L鹽酸,勻漿5min,蓋塞振蕩水解60min,然后8000r/min離心10min,收集上清液,備用。
1.3.2 凈化
MAX固相萃取柱依次用3mL甲醇、3mL水活化,待溶液流至填料上層以下,加入樣品提取液,控制流速小于3mL/min,待樣液全部流出后用3mL乙酸鈉溶液-甲醇(0.05mol/L乙酸鈉溶液:甲醇=9:1,V/V)淋洗固相萃取柱,待全部流出后抽真空5min。最后用3mL甲酸-乙酸乙酯溶液(甲酸:乙酸乙酯=2:98,V/V)洗脫,洗脫液在40℃下氮氣吹干,加1mL流動相溶液溶解殘渣,漩渦混勻,過0.45μm濾膜后待測。
1.3.3 色譜條件
色譜柱:Sunfire C18柱(250mm×4.6mm,5μm)。流動相:甲醇-1.0%甲酸溶液(40:60,V/V)。流速:1.0mL/min。柱溫:30℃。進樣量:50μL。檢測波長:320nm。
1.3.4 標準溶液配制
MQCA標準儲備液:準確稱取10mg標準品,用甲醇溶解并定容至100mL棕色容量瓶,配成標準儲備液,質量濃度100mg/L。避光冷藏保存,保存期為3個月。
MQCA標準工作液:用流動相將標準溶液逐級稀釋成20、50、250、500、1000μg/L系列標準工作液,現配現用。
1.3.5 標準曲線與樣品測定
分別取系列標準工作液,經高效液相色譜測定后繪制標準曲線。樣品測定根據保留時間定性,外標峰面積定量。分別取豬肉、牛肉、對蝦和草魚樣品各5.0g,加入相當于樣品含量4、40、200μg/kg的MQCA標準溶液,每個水平做6個平行,測定MQCA含量,計算回收率和相對標準偏差。
2 結果與分析
2.1 前處理方法選擇
MQCA殘留在動物組織中與肌肉結合緊密,普通方法很難將其完全提取,且會帶入大量色素、蛋白質等雜質,影響分離、提取效果。有研究表明可以利用酸水解[7]、堿水解[8]和酶解[4,9]等方法使MQCA與肌肉組織分離,形成游離態的MQCA,達到提取的目的。堿水解通常反應較為劇烈,會造成少量MQCA降解,且反應后需要調節pH值至酸性。酶解條件比較溫和,但需要較長的反應時間(16h以上)。本研究采用鹽酸水解方法,研究不同濃度鹽酸的酸解效果。采用陽性草魚樣品進行水解實驗,以實測最高濃度為理論濃度計算獲得鹽酸水解效果圖,其結果如圖1所示。結果表明,樣品組織用2mol/L鹽酸溶液水解60min,可有效將MQCA從肌肉組織中分離。方法與同等實驗條件氫氧化鈉堿水解相比,鹽酸水解條件較為溫和,可減少提取液中雜質成分,提高凈化效果,提高方法回收率。
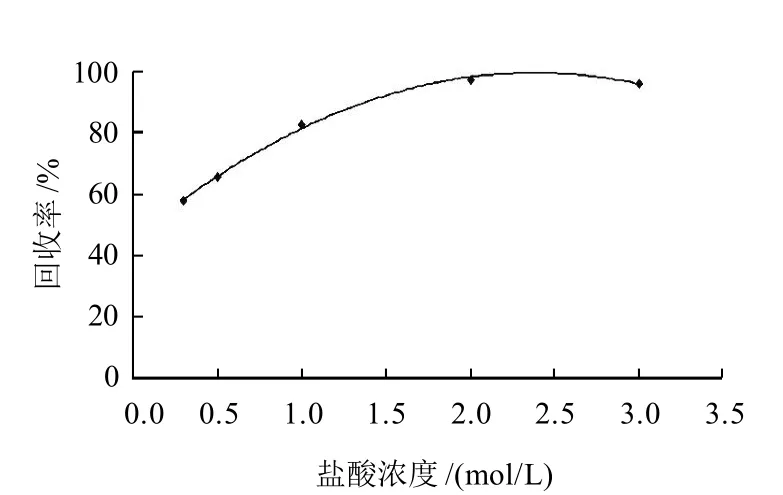
圖1 鹽酸濃度對樣品水解的影響Fig.1 Effect of hydrochloric acid concentration on hydrolysis efficiency
2.2 色譜條件選擇

圖2 50μg/L MQCA標準溶液色譜圖Fig.2 HPLC chromatogram of MQCA standard (50μg/L)
實驗對ZORBAX SB-C18柱(250mm×4.6mm,5μ m)、Sunfire(250mm×4.6mm,5μm)、X-Bridge(250mm×4.6mm,5μm) 3種C18色譜柱進行選擇,ZORBAX和XBridge出峰較早,但有雜峰干擾,Sunfire出峰相對較晚,但分離效果好,因此選擇Sunfire柱作為MQCA分析柱。分析MQCA常用的流動相為1%甲酸溶液-甲醇(60:40),甲醇、水和乙酸-乙酸鈉緩沖液組成梯度洗脫以及0.5%甲酸水溶液-甲醇(70:30)。經實驗比較,以1%甲酸溶液-甲醇(60:40)作為流動相,其峰形和靈敏度最好。MQCA標準溶液的高效液相色譜圖如圖2所示,豬肉樣品空白色譜圖、樣品加標色譜圖如圖3~5所示。MQCA色譜峰峰形尖銳,對稱性好,與雜質完全分離,可滿足定量分析的要求。
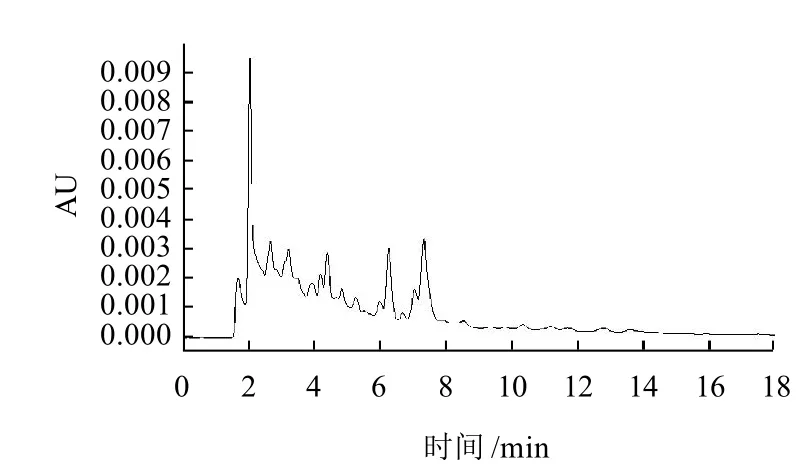
圖3 豬肉空白樣品色譜圖Fig.3 HPLC chromatogram of blank pork sample
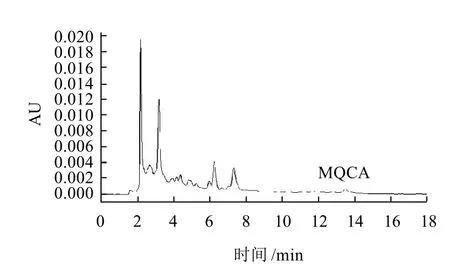
圖4 豬肉樣品4μg/kg MQCA加標色譜圖Fig.4 HPLC chromatogram of pork sample with spiked MQCA(4μg/kg)
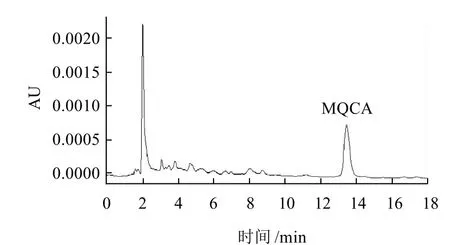
圖5 豬肉樣品40μg/kg MQCA加標色譜圖Fig.5 HPLC chromatogram of pork sample with spiked MQCA(40μg/kg)
2.3 線性范圍和檢出限
用MQCA標準使用液配制質量濃度分別為20、50、250、500、1000μg/L的標準工作溶液,進樣后制作標準曲線,標準曲線方程為Y=105000X-272。方法在4.0~200μg/L范圍內方法線性良好,線性相關系數為0.9994。將加標濃度逐級稀釋添加于樣品中測定信噪比,最終按照10倍信噪比計算該方法的定量限(LOQ)為4.0μg/kg。
2.4 方法回收率和精密度
分別對豬肉、牛肉、對蝦和草魚樣品進行3個梯度的加標回收實驗,計算其回收率和相對標準偏差,結果如表1所示。方法平均回收率為82.1%~90.3%,相對標準偏差均小于7%。由結果可知,水產品MQCA的回收率要稍高于畜產品,其原因是由于水產品色素和脂肪含量相對較少,其基質效應要小于畜產品。
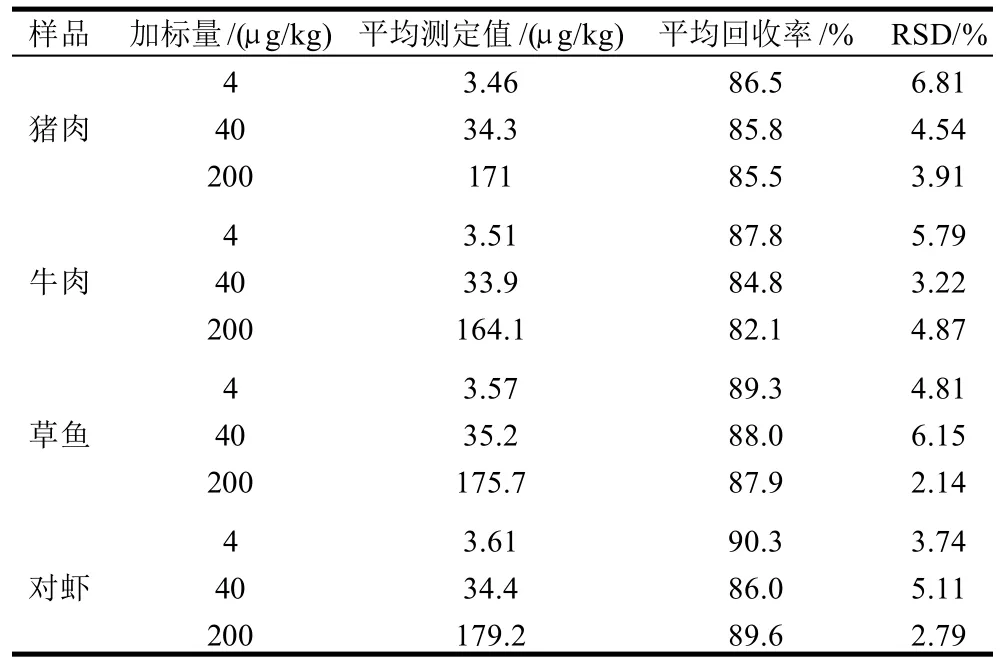
表1 樣品中添加回收率及方法的精密度實驗(n=6)Table 1 Recovery rates and precision of the determination method(n=6)
2.5 樣品測定
利用本方法對從舟山市場上購得的豬肉、牛肉、草魚、對蝦各20個樣品進行MQCA測定,沒有陽性樣品檢出。結果表明該批次樣品沒有喹乙醇安全隱患,可利用本方法對市場繼續檢測監控。
3 結 論
建立動物組織中喹乙醇標示殘留物MQCA的高效液相色譜測定方法,使用酸水解法提取組織中的MQCA,可有效地將MQCA從肌肉組織中分離;MAX固相萃取柱凈化能去除大量雜質和色素,減少基質效應。利用方法對本地80個實樣進行檢測,未發現有陽性樣品。本方法具有重現性好、精密度高、抗雜質干擾等優點,可滿足目前的檢測要求。
[1] Commission Regulation (EC) No.2788/98 of 22 December 1998 amending Council Directive 70/524/EEC concerning additives in feedingstuffs as regards the withdrawal of authorisation for certain growth promoters[J].Off J Eur Commun, 1998, 347: 31-32.
[2] YUAN Zonghui, WU Yulian, WANG Yujie, et al. Development of an HPLC-UV method for simultaneous quantification of quinoxaline-2-carboxylic acid and 3-methyl-quinoxiline-2-caboxylic acid in muscle and liver of swine, chicken and fish[J]. Journal of Veterinay Pharmacology and Therapeutics, 2006, 29: 142-143.
[3] WU Yujie, YU Huang, WANG Yulian, et al. Development of a highperformance liquid chromatography method for the simultaneous quantification of quinoxaline-2-carboxylic acid and methyl-3-quinoxaline-2-carboxylic acid in animal tissues[J]. Journal of Chromatography A,2007, 1146(1): 1-7.
[4] 殷居易, 倪梅林, 壽成杰, 等. 雞肉中喹乙醇、卡巴多及其代謝物的殘留檢測[J]. 中國獸藥雜志, 2006, 40(1): 11-15.
[5] BOISON J O, LEE S C, GEDIR R G. A determinative and confirmatory method for residues of the metabolites of carbadox and olaquindox in porcine tissues[J]. Analytica Chimica Acta, 2009, 637: 128-134.
[6] HUTCHINSON M J, YOUNG P B, KENNEDY D G. Confirmation of carbadox and olaquindox metabolites in porcine liver using liquid chromatographyelectrospray, tandem mass spectrometry[J]. Journal of Chromatography B, 2005, 816: 15-20.
[7] YAMAGATA M, LOW L K. Automated and ultrasensitive detection of methyl-3-quinoxaline-2-carboxylic acid by using gold nanoparticles probes SIA-rt-PCR[J]. Biosensors and Bioelectronics, 2009, 24(9): 2858-2863.
[8] 王霄旸, 張麗芳, 薛飛群, 等. 采用高效液相色譜-串聯質譜法檢測鯽魚組織3-甲基喹噁啉-2-羧酸殘留量[J]. 中國獸醫科學, 2007, 37(8): 718-720.
[9] 歐陽姍, 龐國芳, 謝麗琪, 等. 動物組織中卡巴氧和喹乙醇以及相關代謝產物的液相色譜-串聯質譜檢測方法[J]. 分析測試學報, 2008,27(6): 590-594.
Determination of Olaquindox Marker Residue in Animal Tissues by HPLC
ZHANG Xiao-jun1,2,ZHENG Bin3,*,CHEN Xue-chang1,YU Hai-xia4,MEI Guang-ming1
(1. Marine Fisheries Research Institute of Zhejiang, Zhoushan 316100, China; 2. College of Food Science and Biotechnology,Zhejiang Gongshang University, Hangzhou 310035, China;3. Zhejiang Marine Development Research Institute, Zhoushan 316000, China;4. Zhoushan Ocean Research Institute, Zhejiang University, Zhoushan 316000, China)
A high performance liquid chromatography (HPLC) method was developed to determine olaquindox marker, methyl-3-quinoxaline-2-carboxylic acid (MQCA) residue in animal tissues. MQCA in muscle tissues were extracted by hydrochloric acid hydrolysis, purified by MAX SPE, and then quantitatively determined by HPLC. The recovery rate of spiked MQCA at the addition range of 4.0-200μg/kg was 82.1%-90.3% with the relative standard deviation (RSD) of less than 7%. The limit of detection (LOD) was 4.0 μg/kg.
high performance liquid chromatography (HPLC);marker residue of olaquindox;methyl-3-quinoxaline-2-carboxylic acid (MQCA)
TS251.7
A
1002-6630(2010)24-0289-04
2010-04-22
浙江省分析測試科技計劃項目(2008F70030);浙江省科技計劃項目(2009C32008)
張小軍(1982—),男,工程師,博士研究生,研究方向為水產品安全檢測。E-mail:xiaojun3627@163.com
鄭斌(1968—),男,教授級高工,碩士,研究方向為水產品安全及標準化。E-mail:6369958@163.com

