大豆水酶法提取副產物 -水溶性糖工藝優化及機理研究
李 楊江連洲,張兆國吳 霞吳海波許 晶
(東北農業大學食品學院1,哈爾濱 150030)
(國家大豆工程中心2,哈爾濱 150030)
(東北農業大學農業工程學院3,哈爾濱 150030)
大豆水酶法提取副產物 -水溶性糖工藝優化及機理研究
李 楊1江連洲1,2張兆國3吳 霞1吳海波2許 晶1
(東北農業大學食品學院1,哈爾濱 150030)
(國家大豆工程中心2,哈爾濱 150030)
(東北農業大學農業工程學院3,哈爾濱 150030)
水酶法提油條件溫和,油料蛋白的性能幾乎不發生變化,無論是水相中直接加工利用,還是回收分離蛋白再利用,效果都十分理想,但有關水酶法提取植物油脂和蛋白質的副產物 -水溶性糖的相關研究較少,故針對擠壓膨化后水酶法提取大豆油脂和蛋白質的副產物 -大豆水溶性糖進行研究。利用響應面分析方法對酶法提取副產物 -大豆水溶性糖得率進行了優化。建立了相應的數學模型,為以后的中試以及工業化生產提供理論基礎,并且得到了最優酶解工藝條件為加酶量為 2.1%,溫度為 58℃,酶解時間為 3.5 h,料水比為1:6.4,pH為 10,響應面有最優值在(20.98±1.03)%。經過驗證與對比試驗可知在最優酶解工藝條件下水溶性糖得率可達到 19.97%左右,比相同酶解條件下未經擠壓膨化預處理水溶性糖得率以及堿提工藝水溶性糖得率均有顯著提高。利用超微結構能譜分析為手段,針對水溶性糖得率提高機理進行了研究,經研究表明:①擠壓膨化再粉碎后大豆細胞組織破壞,水溶性糖與蛋白復合物中蛋白質與蛋白酶作用位點較充分暴露,有利于其酶解使得水溶性糖與蛋白復合物破壞。②大豆中水溶性糖部分以糖與蛋白復合物形式存在,而想提取此類大豆水溶性糖需要將蛋白水解。
大豆水溶性糖 響應曲面 水酶法
大豆水溶性糖主要包括低聚糖 (水蘇糖、棉子糖、蔗糖等)和水溶性多糖 (半乳糖、阿拉伯糖、半乳糖醛酸、鼠李糖、海藻糖、木糖等)[1]。大豆水溶性糖具有多種生物活性,是一種天然的功能性成分[2],它可以改善食品的食用品質、加工特性和外觀特性,能夠用于抑制脂類氧化[3]和穩定酸性飲料中的蛋白質[4],還可以作為食品中分散劑、乳化劑、穩定劑、黏附劑[5]。因此在食品中具有廣泛的應用前景。
水酶法提油條件溫和,油料蛋白的性能幾乎不發生變化,無論是水相中直接加工利用,還是回收分離蛋白再利用,效果都十分理想,所以水酶法提取研究逐步成為當前國內外食品工業的熱點[6-12]。但有關水酶法提取植物油脂和蛋白質的副產物 -水溶性糖的相關研究較少,所以針對擠壓膨化后水酶法提取大豆油脂和蛋白質的副產物 -大豆水溶性糖進行研究。應用響應曲面分析方法對酶解過程中大豆水溶性糖得率進行優化,并且利用掃描電子顯微鏡 -能譜連儀對水解后水溶性糖與蛋白復合物進行轟擊,考察大豆水溶性糖在水解過程中與蛋白的分離機理。
1 材料與方法
1.1 材料、試劑
大豆:黑龍江農業科學院培植的墾農 42;Alca2 lase堿性內切蛋白酶:丹麥 novo公司。
1.2 主要儀器設備
精密電動攪拌機:江蘇省金壇市榮華儀器制造有限公司;近紅外分析儀:美國 FOSS公司;紫外可見光分光光度計:UV-2401PC,日本島津公司;錘片式粉碎機:中國天津泰斯特儀器有限公司;掃描電子顯微鏡 -能譜連儀:Quanta 200;剖分式雙螺桿擠壓機:自制(見圖1)。
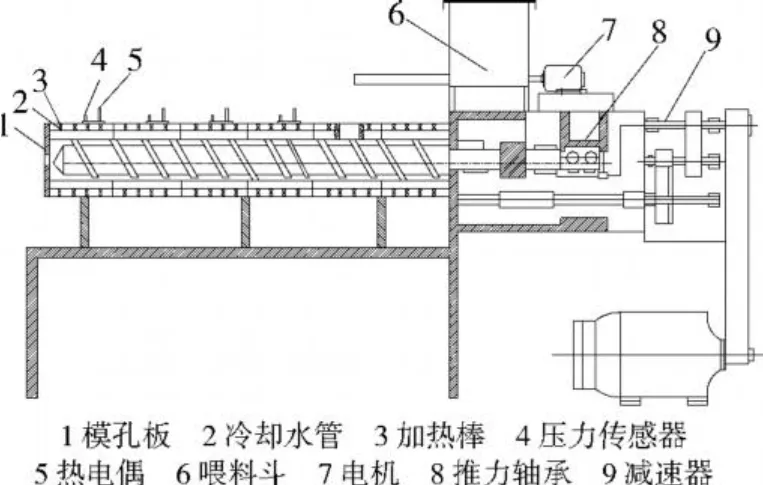
圖1 剖分式雙螺桿擠壓機
1.3 試驗方法
1.3.1 大豆的成分測定
原料成分測定:利用近紅外分析儀進行測定。

表1 原料大豆主要成分
1.3.2 樣品含量糖量測定
采用蒽酮法測定水溶性糖含量[13]
蒽酮試劑:稱取 0.2 g蒽酮和 1 g硫脲置于燒杯中,慢慢加入 100 mL濃硫酸,邊加邊攪拌,溶解后為黃色透明溶液。
葡萄糖標準溶液:先配成 1 g·L-1的葡萄糖溶液,然后分別吸取 1、2、4、6、8和 10 mL,分別置于100 mL容量瓶中,用蒸餾水定容,可得 10、20、40、60、80和 100 mg·L-1的葡萄糖溶液。
測定:吸取樣液,系列標準糖液、蒸餾水各 1 mL,分別置于八支試管中,沿壁各加入 5 mL冷的蒽酮試劑,混勻,于試管口蓋上玻璃蓋,在沸水浴中加熱 10 min,取出在流水中冷卻 20 min后,在 620 nm波長下,以試劑空白調零,測定吸光值,作標準曲線。與標準對照,求出樣品含糖量。
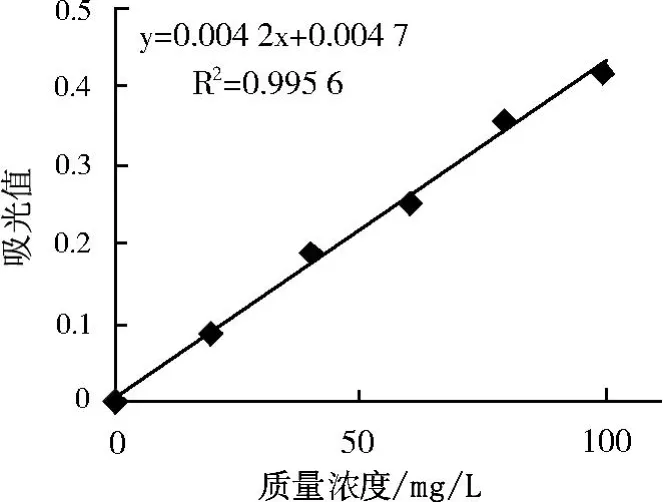
圖1 標準曲線
1.3.3 工藝流程
大豆→清理→粉碎→水分調節→擠壓膨化 (模孔孔徑 18 mm、套筒溫度 90℃、物料含水率 14%、螺桿轉速 100 r/min)→粉碎→調節 pH值和溫度→酶解(根據對不同酶的水解效果比較研究,選定 Al2 calase堿性內切蛋白酶)→滅酶→離心 (除去大豆油脂和乳狀液)→收集上清夜→調節為等電點 pH蛋白沉淀→離心→取上清液 (測定水溶性糖)→95%乙醇沉淀→大豆水溶性多糖
↓
上清液離子交換 (脫鹽、脫色)→真空濃縮→大豆低聚糖
1.3.4 計算公式
根據制作的標準曲線來計算大豆粉中水溶性糖得率:

1.3.5 酶解工藝的響應面優化試驗
在單因素研究的基礎上,結合水酶法提取大豆油和蛋白質的酶解工藝參數,選取加酶量、酶解溫度、酶解時間、料水比和酶解 pH 5個因素為自變量,以總蛋白提取率為響應值,根據中心組合設計原理,設計響應面分析實驗,其因素水平編碼表見表 2。
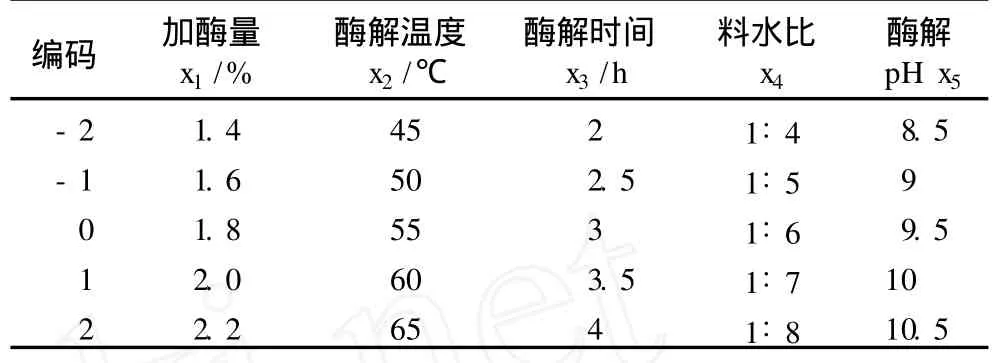
表2 因素水平編碼表
2 結果與分析
2.1 響應面試驗安排及試驗結果
應用響應面優化法進行過程優化。以 x1、x2、x3、x4、x5為自變量,以水溶性糖得率為響應值 Y,響應面試驗方案及結果見表 3。1~26號為析因試驗,27~36號為 10個中心試驗,用以估計試驗誤差。
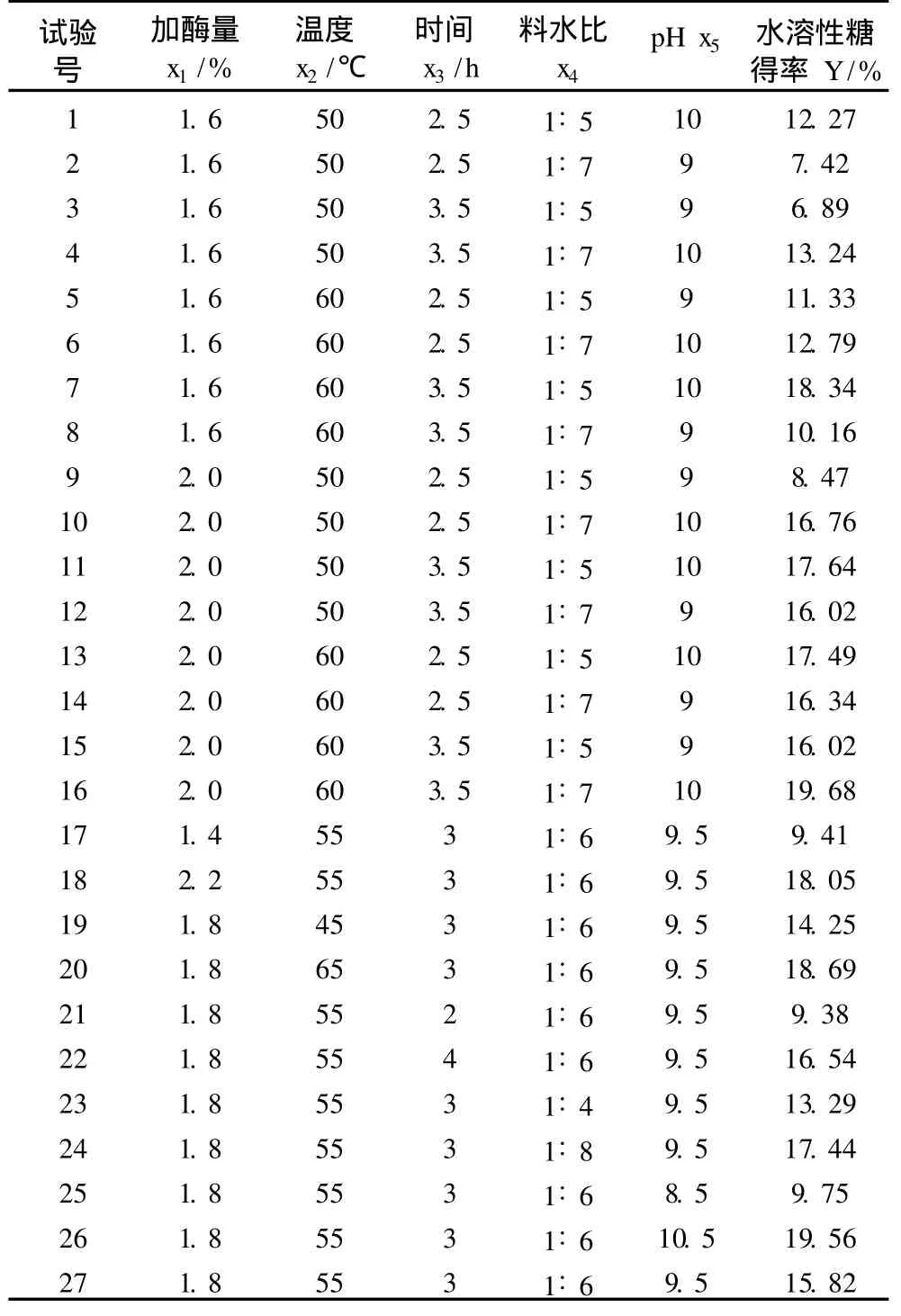
表 3 響應面試驗方案及試驗結果
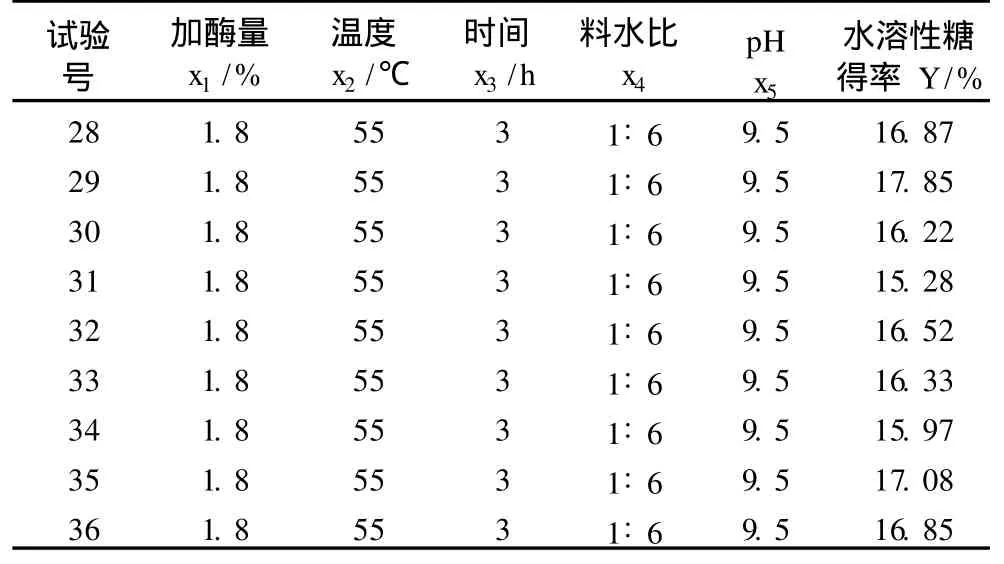
續表
通過統計分析軟件 SAS9.1進行數據分析,建立二次響應面回歸模型如下:
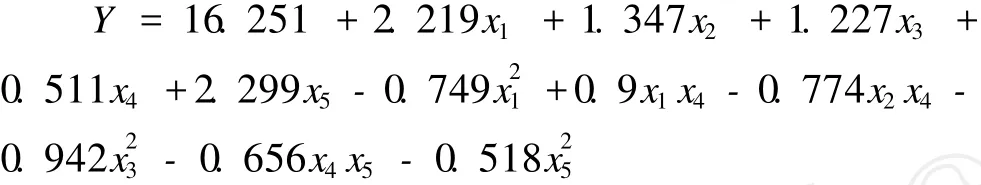
回歸與方差分析結果見表4,響應面尋優見表5,降維分析見圖3,交互顯著項的響應面分析見圖4~圖6。
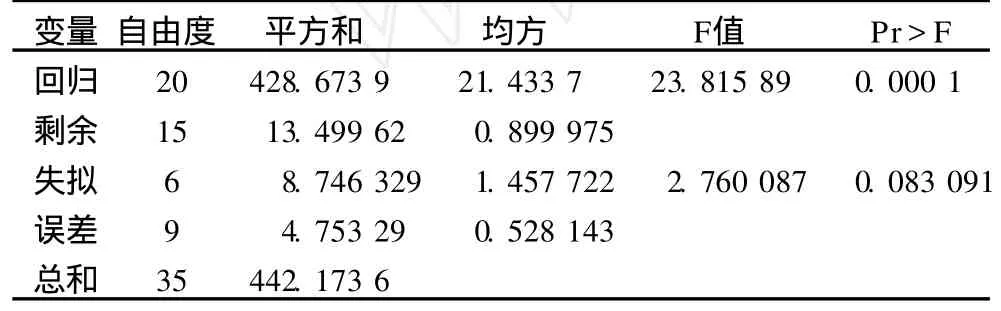
表4 回歸與方差分析結果
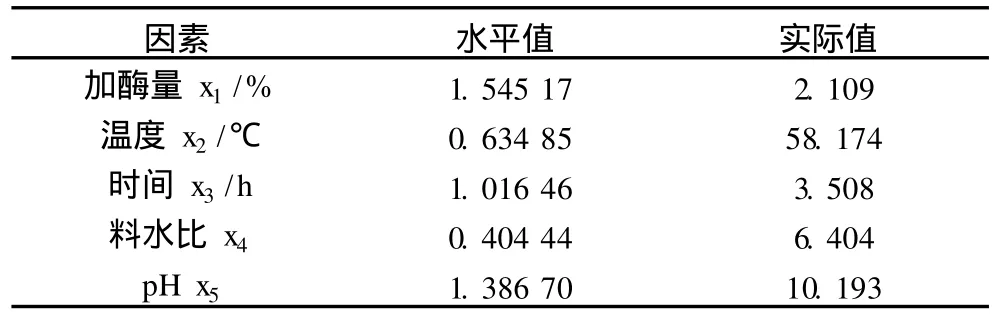
表5 響應面尋優結果
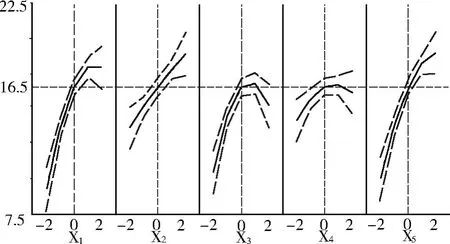
圖3 各因素對考察指標的降維分析
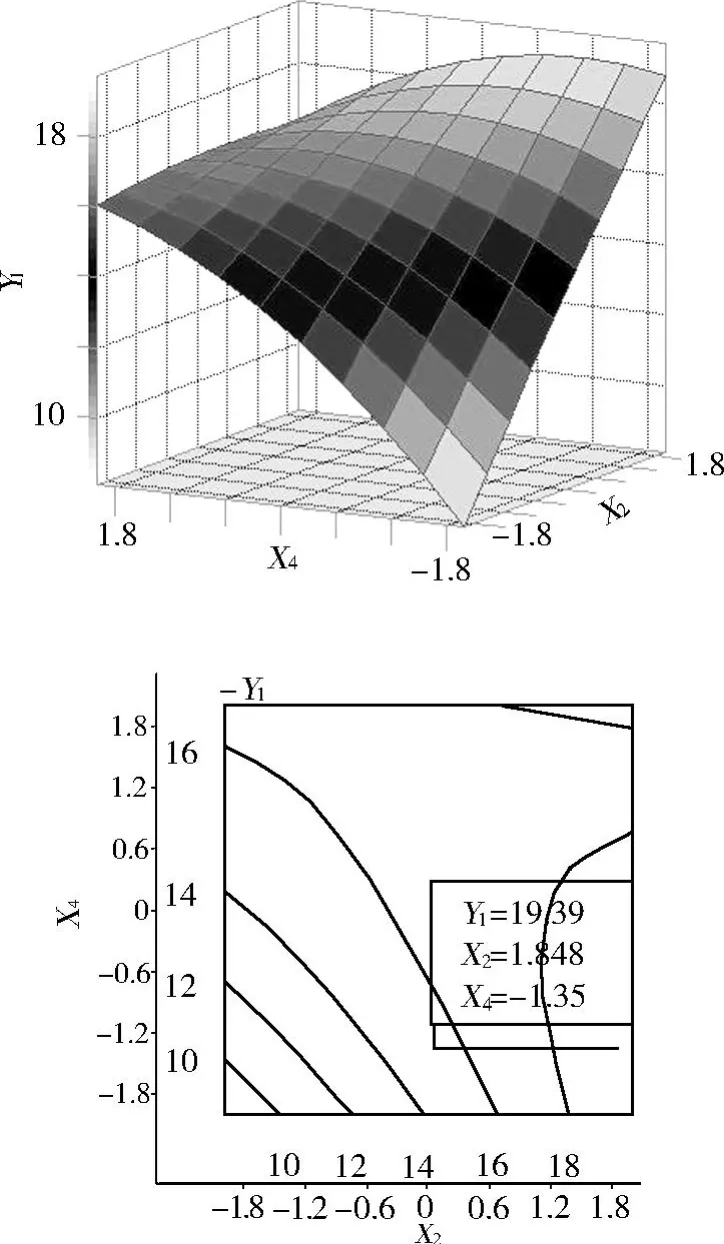
圖 5 Y=f(x2,x4)的響應面與等高線
由表 4可知,方程因變量與自變量之間的線性關系明顯,該模型回歸顯著 (P<0.000 1),失擬項不顯著,并且該模型 R2=96.95%,=92.88%,說明該模型與試驗擬合良好,自變量與響應值之間線性關系顯著,可以用于該反應的理論推測。由 F檢驗可以得到因子貢獻率為:x5>x1>x2>x3>x4,即pH>加酶量 >酶解溫度 >酶解時間 >料液比。由圖 3可以看出各因素對考察指標大豆水溶性糖得率的影響規律。且由降維分析結果可知,酶解過程中大豆水溶性糖得率隨加酶量增加先增加后不變,其原因是蛋白質水解到一定程度已經與水溶性糖分離充分。溫度越高越有利于水溶性糖提取,但溫度過高影響蛋白酶解效果,所以響應面尋優溫度為 58℃。酶解時間對水溶性糖提取有較大值,出現在 3.5 h附近,因為在 3.5 h水解的大部分蛋白肽已經可以與水溶性糖分離。料液比對水溶性糖得率影響先增大后不變,因為載體水增多有利于酶與蛋白作用,而過多的水使底物與酶均被稀釋。水溶性糖得率隨 pH增大而增加,因為堿性條件下利于水溶性糖的提取與蛋白質溶解,但堿性過大對酶解不利,所以經過響應面優化 pH在 10附近有較大水溶性糖得率。
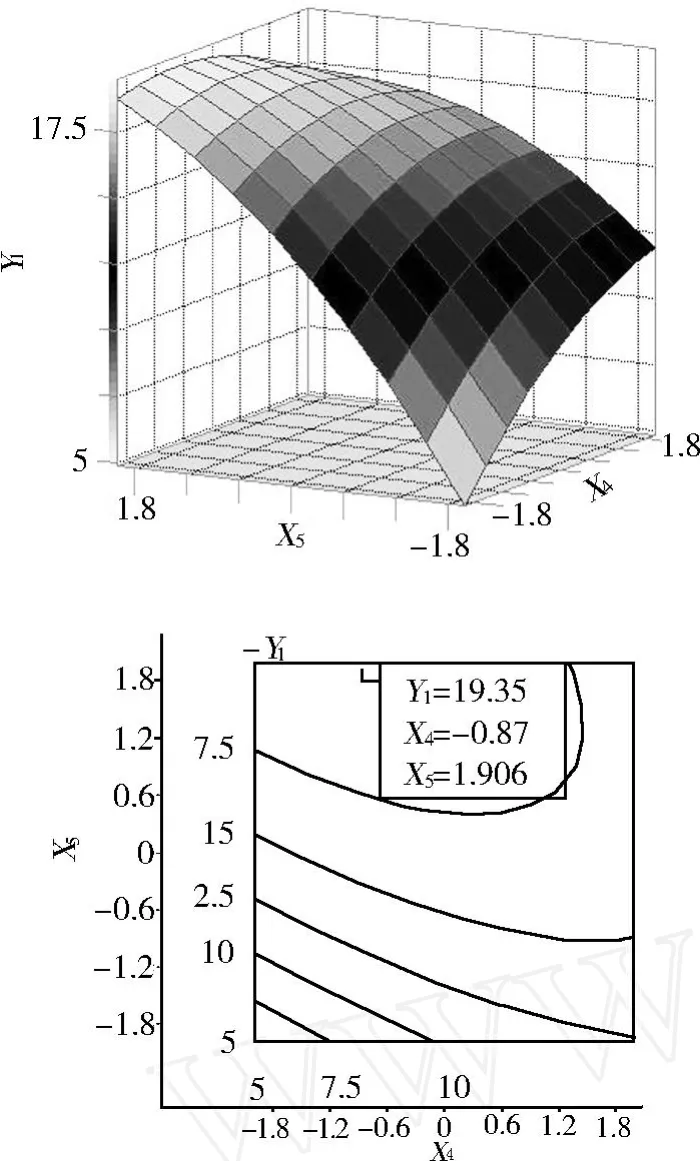
圖 6 Y=f(x4,x5)的響應面與等高線
應用響應面尋優分析方法對回歸模型進行分析,尋找最優響應結果見表 5,由表 5實際值整理可知當加酶量為2.1%,溫度為 58℃,酶解時間為 3.5 h,料水比為1:6.4,pH為 10,響應面有最優值在(20.98± 1.03)%。
由圖 4可知加酶量與料液比呈現“協同”作用,并且在 1.8臨界值附近出現“脊嶺”區域,這與降維分析結果基本相同,但響應曲面優化與其結果矛盾,其原因是此兩個因素與其他因素交互作用以及蛋白的水解程度對水溶性糖提取率影響造成的。由圖 5可知酶水解溫度與料液比呈現“拮抗”作用,并且其“脊嶺”區域與響應面優化結果矛盾,說明水溶性糖的堿提最優溫度和料液比與蛋白水解最優溫度和料液比均對水溶性糖得率有很大影響,并且影響規律不一致。由圖 6可知料液比與 pH對水溶性糖得率影響規律同降維分析結果以及響應曲面優化結果均一致,但 pH偏大,因為水溶性糖的堿提最優 pH與Alcalase堿性內切蛋白酶的水解最優 pH有差異。
2.2 驗證試驗與對比試驗
在響應面分析法求得的最佳條件下,加酶量2.1%,溫度 58℃,酶解時間 3.5 h,料水比 1:6.4, pH 10,水溶性糖得率有最優值在 (20.98±1.03)%。在此條件下進行3次平行試驗,水溶性糖得率3次平行試驗的平均值為 19.97%。驗證值與預測值之間的標準偏差為 -1.01,在合理范圍內,說明響應值的實驗值與回歸方程預測值吻合良好。在相同的酶解條件下利用非擠壓膨化物料進行酶解水溶性糖得率僅為15.43%。根據降維分析結果,結合以往堿提工藝條件,在堿提條件為:溫度 80℃,時間 3.5 h,pH 10.5,料液比1:8條件下,水溶性糖得率僅為13.52%。
3 超微結構能譜分析
由圖 7和表 6中 a與 b可以看出大豆膨化預處理前后N元素含量相同,而本試驗轟擊位點均為非蛋白體位點 (說明此部位為蛋白與水溶性糖混合物),說明擠壓膨化預處理并沒有使水溶性糖與蛋白復合物破壞,但擠壓膨化再粉碎后大豆細胞組織破壞水溶性糖與蛋白復合物中蛋白質與蛋白酶作用位點較充分暴露,有利于其酶解使得水溶性糖與蛋白復合物破壞。由圖 7中 c與 d可以看出膨化后大豆水解液中大顆粒與小顆粒 N元素含量差別很大,小顆粒含氮元素明顯大于大顆粒,說明大顆粒為蛋白與水溶性糖混合物,而小顆粒為多肽。由此結果可以看出大豆中水溶性糖部分以糖與蛋白復合物形式存在,而要提取此部分大豆水溶性糖需要將蛋白水解。因此擠壓膨化預處理工藝與水酶法提取工藝均有利于大豆水溶性糖得率的提高。擠壓膨化過程中部分不溶性纖維降解為水溶性纖維同樣可使水溶性糖得率提高。擠壓膨化工藝參數對不溶性大豆纖維降解率影響規律需要進一步研究。
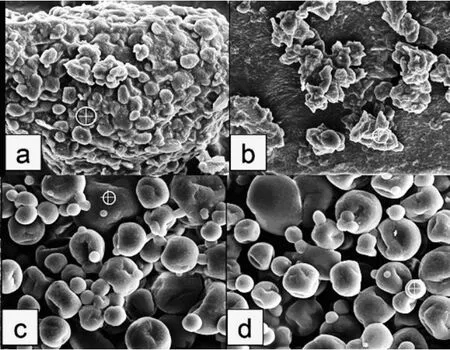
圖7 掃描電鏡觀察與能譜分析結果
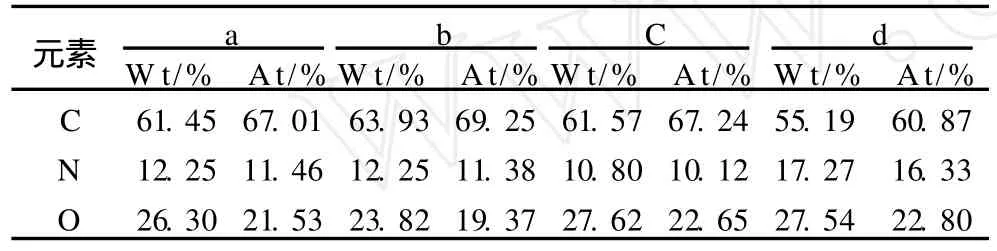
表6 能譜分析數據
4 結論
利用響應面分析方法對擠壓膨化后大豆水酶法提取副產物 -水溶性糖得率進行了優化。建立了相應的數學模型為以后的中試以及工業化生產提供理論基礎,并且得到了最優酶解工藝條件為加酶量為2.1%,溫度為 58℃,酶解時間為 3.5 h,料水比為1:6.4,pH為 10,響應面有最優值在 (20.98± 1.03)%。經過驗證與對比試驗可知在最優酶解工藝條件下水溶性糖得率可達到 19.97%左右,比相同酶解條件下未經擠壓膨化預處理水溶性糖得率以及堿提取工藝水溶性糖得率均有顯著提高。利用超微結構能譜分析為手段,針對水溶性糖得率提高機理進行了研究,經研究表明:①擠壓膨化再粉碎后大豆細胞組織破壞水溶性糖與蛋白復合物中蛋白質與蛋白酶作用位點較充分暴露,有利于酶解使得水溶性糖與蛋白復合物破壞。②大豆中水溶性糖部分以糖與蛋白復合物形式存在,而想要提取此類大豆水溶性糖需要將蛋白水解。所以擠壓膨化預處理工藝與水酶法提取工藝均有利于大豆水溶性糖得率的提高。擠壓膨化過程中部分不溶性纖維降解為水溶性纖維同樣可使水溶性糖得率提高。擠壓膨化工藝參數對不溶性大豆纖維降解程度的影響規律需要進一步研究。
[1]H.Maeda.Soluble soybean polysaccharide[M].Japan. Fuji oil Co,Ltd.1999:309-319
[2]郭盡力.微波提取水溶性大豆水溶性糖工藝研究[J].煙臺大學學報(自然科學與工程版),2004,17(4):298-300
[3]MatsumuraY,Egami M,Satake C,et al,Inhibitory effects of Peptide bound polysaccharides on lipid oxidation in emul2 sions[J].Food Chemistry,2003,83:107-119
[4]NakamuraA,FurutaH,Ka toM,et al.Effectof soybean sol2 uble polysaccharides on the stability ofmilk protein under a2 cidic conditions.Food Hydrocolloids,2003,17:333-343
[5]Maeda,H.Soluble soybean polysaccharide:Properties and applications of SOYAFB IE-S[J].The Food Industry, 1994,37(12):71-74
[6]Stephanie Jung,Abdullah A.Mahfuz.Low temperature dry extrusion and high-pressure processing prior to enzymeassisted aqueous extraction of full fat soybean flakes[J]. Food Chemistry,2008,044(10):1-8
[7]Rosenthal,A.,D.L.Pyle,and K.Niranjan,Aqueous and Enzymatic Processes for EdibleOil Extraction,Enz.Microb. Technol.,1966,19:402-420
[8]Sinero J,H Dominguez,MJ Nunez,et al.Lema,Optimiza2 tion of the Enzymatic Treatment During Aqueous Oil Extrac2 tion from Sunflower Seeds,Food Chem.,1988,61:467-474
[9]Guderjan M,Elez-Martinez P,Knorr D.Application of pulsed electric fields at oil yield and content of functional food ingredients at the production of rapeseed oil.Innovative Food Science and Emerging Technologies,2007,8:55-62
[10]Shah S,Sharma A,GuptaM N Extraction of oil from Jatro2 pha curcasL.seed kernels by combination of ultrasonication and aqueous enzymatic oil extraction.Bioresource Technolo2 gy,2005,96(1):121-123
[11]Valentova O,Novotna Z,Svoboda Z,et al.Microwave heating and c-irradiation treatment of rapeseed(Brassica napus).Journal of Food Lipids,2000,7:237-245
[12]B PLamsal,L A Johnson.Separating oil from Aqueous Ex2 traction Fractions of soybean[J].Journal of the American oil Chemist’s society 2007,84(8):785-792
[13]施翠娥,蔣立科,李苗苗.大豆多糖提取分離工藝的優化研究[J].安徽農學通報.2009,15(3):148-150.
Enzyme-AssistantAqueous Extraction of Polysaccharides from Soybean By-product: Opti mization andMechanis m Study
Li Yang1Jiang Lianzhou1,2Zhang Zhaoguo3Wu Xia1Wu Haibo2Xu Jing1
(Food Science College NortheastAgriculture University1,Harbin 150030)
(The National Research Center of Soybean Engineering and Technology2,Harbin 150030)
(College of Engineering,NortheastAgriculturalUniversity3,Harbin 150030)
The conditions of enzyme-assistant aqueous extraction for oil are mild,and the protein in raw ma2 terial is hardly denatured during the extraction and the protein in the liquid phase after extraction can be reused or withdrawn after separation.However,there is little research on the soluble polysaccharides in the liquid phase.This experiment was aimed to study the soluble polysaccharides in the liquid phase after the enzyme-assistant aqueous ex2 traction of soybean oil and protein.Response surface methodology was used to optimize the soluble polysaccharides extraction with enzyme hydrolysis,and a correspondingmathematicalmodelwas established to provide practical rec2 ommendation and theoretical basis.Results:The optimal technologicalparameters for the soybean soluble polysaccha2 rides extraction are enzyme concentration 2.1%,temperature 58℃,enzyme hydrolysis time 3.5 h,material towater ratio 1∶6.4,and pH 10.Opti mal value of 20.98±1.03%was obtained on response surface.The soluble polysac2 charides extraction yield reaches 19.97%under the optimal conditions.The soluble polysaccharides extraction yield with extrusion and expansion pretreatment is significantly higher than that without extrusion and expansion pretreat2 ment.A mechanism study bymicrostructure and energy spectrum analysison the reasons about the increase of soluble polysaccharides yield was carried out.Results show the reasons are:1)Soybean cells are destroyed under extrusion and expansion followed by grounding during which action sites of soluble polysaccharides and protein compounds for protease are exposed and favorable to disruption of soluble polysaccharides and compounds.2)Part of soybean solu2 ble polysaccharides exists as form of compounds of soluble polysaccharides and protein.In order to obtain more solu2 ble polysaccharides,the compound protein needs to be hydrolyzed.
soybean soluble polysaccharides,response surface,enzyme-assistant aqueous extraction method
TS229 文獻標識碼:A 文章編號:1033-0174(2010)06-0031-06
農業部現代大豆產業技術體系建設項目(nycytx-004)
2009-07-08
李楊,男,1981年出生,博士,糧食、油脂及植物蛋白工程
江連洲,男,1960年出生,教授,博士生導師,糧食、油脂及植物蛋白工程

