華北典型地表水藻類群落演替特征
范振強,崔福義,馬 華,何文杰,陰沛軍
(1.哈爾濱工業大學城市水資源與水環境國家重點實驗室,哈爾濱 150090;2.天津自來水集團有限公司,天津 300040)
如何安全高效又經濟地去除富營養化原水的藻類是當前飲用水處理的熱點之一。在除藻實踐和研究中,水中不同的藻類通常被不加區分地視為一個整體去除對象。然而原水中不同藻類之間存在的生理或生態特征差異,可導致同一工藝對不同藻類去除效率的不同,如混凝工藝對銅綠微囊藻的去除效果就不如綠藻。另外,原水中某些藍藻能產生藻毒素,除藻工藝選擇不當可造成藻毒素的大量釋放[4-5]和消毒副產物產生[6],從而威脅飲用水水質安全。因此,有必要對原水中的藻類群落結構特征變化以及相關影響因素進行全面了解。該研究對引灤原水藻類群落結構變化進行了調查,分析了藻類含量、藻類群落結構、生物多樣性變化趨勢及影響因素,為提高除藻效率和除藻工藝選擇的針對性提供了有價值的參考。
1 材料與方法
1.1 樣品的取得
在天津某水廠進水口取引灤原水樣品,采樣時間為2006年2月至2006年10月。
1.2 水質參數的測定
水溫、濁度、pH 值、高錳酸鹽指數、總磷、葉綠素a等參數的檢測均按照國家標準方法進行[7]。
依據《湖泊(水庫)富營養化評價方法及分級技術規定》對引灤原水的富營養化水平指數(T LI)進行計算。評價標準:TLI<30,貧營養,30≤TLI≤50,中營養;50<TLI≤60,輕度富營養;60<T LI≤70,中度富營養;TLI>70,為重度富營養。
1.3 藻類的鑒定與計數
取水樣量為1 L,加魯哥氏碘液固定。從該水樣中取500 mL,用醋酸纖維膜(孔徑 0.65μm)過濾 。然后將帶有浮游植物的濾膜放入50 mL燒杯中,加高純水定容至30 mL。將該盛有濾膜的燒杯放入超聲波清洗器中(CBL,C5860A型)振蕩10 min,取出。以微量移液器吸取0.1 mL樣品注入0.1 mL藻類計數框(中科院武漢水生所定制),在顯微鏡(OLYMPUS,BX41型)10×40倍鏡下分類計數,其中,對群體水華微囊藻也是按細胞計數。鏡檢50個視野,根據藻類標準圖譜[8]進行鑒定并分別計數各種藻類的數量,再折算出1 L水樣中的藻類數量。
1.4 多樣性指數的計算
采用Shannon指數表征引灤原水藻類生物多樣性,計算方法如下:
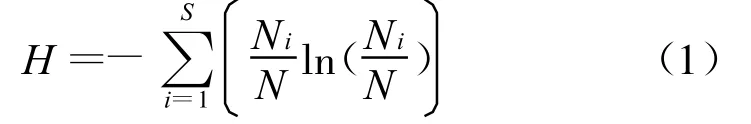
式中:H為Shannon多樣性指數,S為藻類種數,N為藻類總量,Ni為第i種藻的藻類含量。
以多樣性指數判斷污染程度的標準:當H為0~1時,說明水體受到嚴重污染,當H為1~2時為中等污染,當H為2~3時為輕度污染,當H大于3時說明水體比較清潔。
2 結果與分析
2.1 引灤原水水質
引灤原水水溫呈現春季上升,夏季最高,秋季下降的趨勢,如表1所示。其中8月份平均水溫最高,達27.3℃,最高水溫(28.2℃)出現在8月中下旬。引灤原水的pH值在2月-4月間是上升的,但從4月下旬開始,pH值呈現與水溫相反的變化趨勢。隨著水溫上升,濁度也在上升,并在春季4月份出現一個小高峰,峰值出現在9月。高錳酸鹽指數變化幅度并不大,總磷的高峰期出在夏季,二者的變化趨勢與濁度相似。
基于總磷和高錳酸鹽指數計算得到的富營養化水平指數(TLI)表明,引灤原水處于中營養~輕度富營養狀態,見表1。關于水質變化,將在下文中結合藻類進行深入討論。
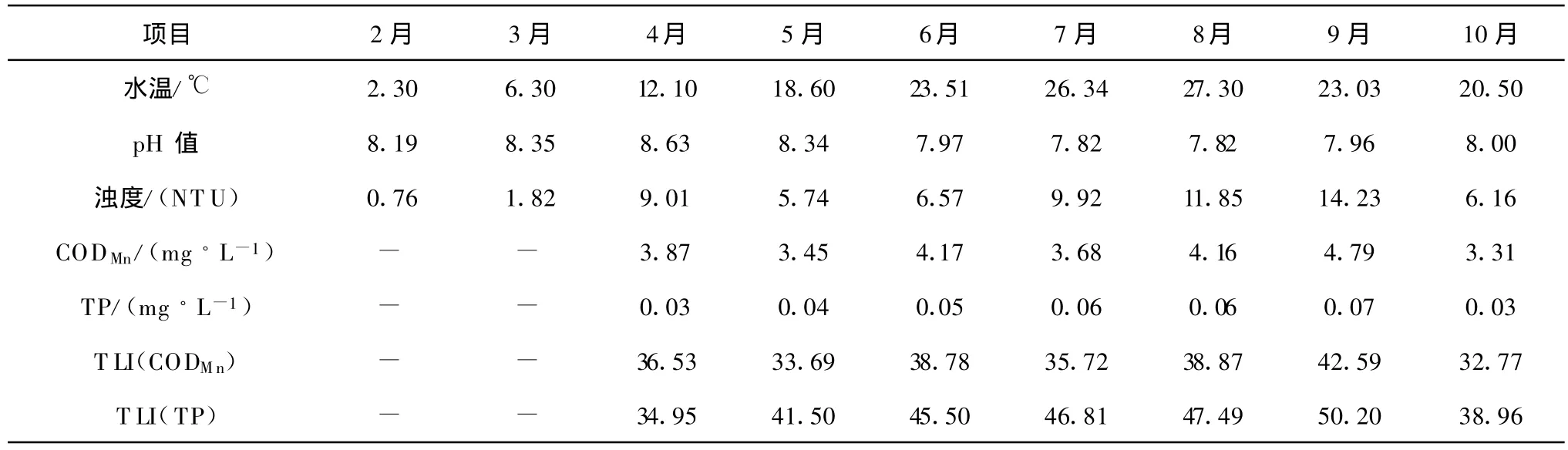
表1 引灤原水水質逐月變化
2.2 引灤原水中的藻類
取樣期間,在引灤原水中檢出藻類共7門43屬68種,其中藍藻門7屬11種,綠藻門21屬36種,硅藻門7屬10種,隱藻門1屬1種,裸藻門5屬8種,甲藻門1屬1種,黃藻門1屬1種。藻類組成的逐月變化見表2。需要注意的是,在Palmer[9]所列的能耐污的20個屬中,引灤原水中就檢出13屬。
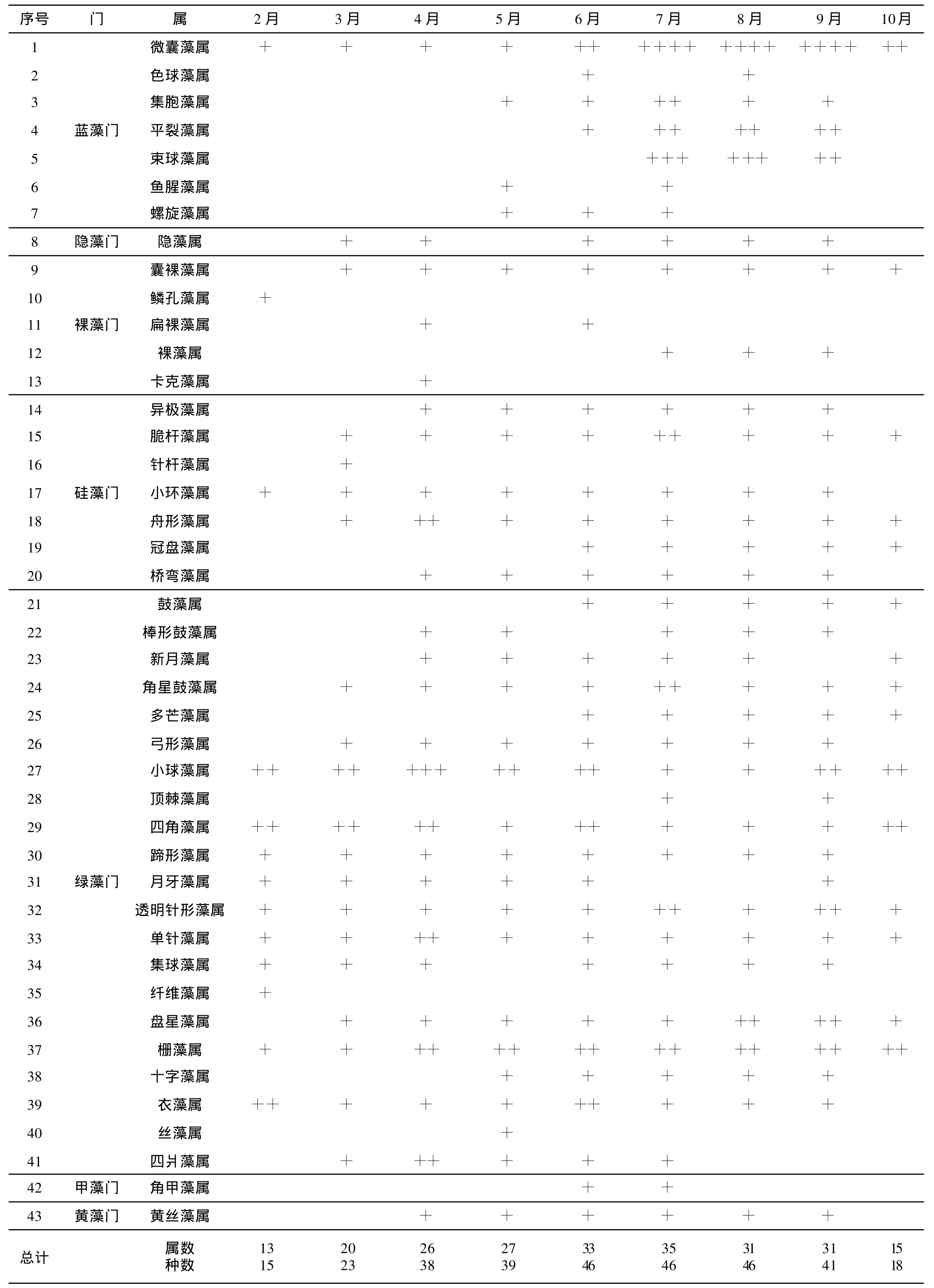
表2 引灤原水藻類組成逐月變化
引灤原水中以綠藻最為常見。在9個月的研究過程中,每個月都出現的藻種類中屬于綠藻的有小球藻、細小四角藻、直透明單針藻和四尾柵藻,屬于藍藻的有水華微囊藻。出現過7~8個月的藻種類屬于裸藻的有不定囊裸藻,屬于硅藻的有短線脆桿藻、梅尼小環藻、短小舟形藻,屬于綠藻的有纖細角星鼓藻、三角四角藻、扭曲蹄形藻、布朗單針藻、集球藻、單角盤星藻、二角盤星藻纖細變種、豐富柵藻、雙對柵藻和球衣藻。
結合表1和表2分析可知,引灤原水中檢出的藻類種數與水溫有一定的相關性,水溫高的月份檢出的藻類種數多,水溫低的月份檢出的藻種數相對較少。
2.3 藻類含量及群落結構變化過程
由于引灤原水中葉綠素a與藻類總量變化趨勢相似,因此下文將重點分析藻類含量(C)及群落結構變化。
取樣期間,引灤原水藻類群落結構呈現季節性的演替過程。如圖1所示(橫坐標中(m-d)表示月-日),引灤原水中春季及秋季以綠藻為優勢類群,藻類含量較低;夏季時藍藻為優勢類群,藻類含量高。
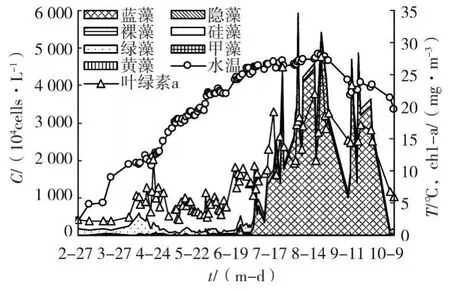
圖1 2006年引灤原水藻類含量變化
根據上述特點,按照春季(7月3日之前)、夏季(7月 3日-9月26日)和秋季(9月26日之后)分段描述引灤原水藻類群落結構變化過程。
2.3.1 春季(7月3日之前)
如圖1及表3所示,雖然水溫持續上升,然而引灤原水春季藻類含量較低,平均含量為189.4×104cells/L。自2月末至4月上旬,引灤原水中藻類含量保持在較低水平,見圖2。由于綠藻的恢復性增長,藻類總量在4月份出現一個高峰,達591.6×104cells/L,此后藻類總量又降到較低水平。6月中下旬,當水溫上升至25℃附近時,由于藍藻(特別是水華微囊藻)的增殖,藻類含量有所上升。
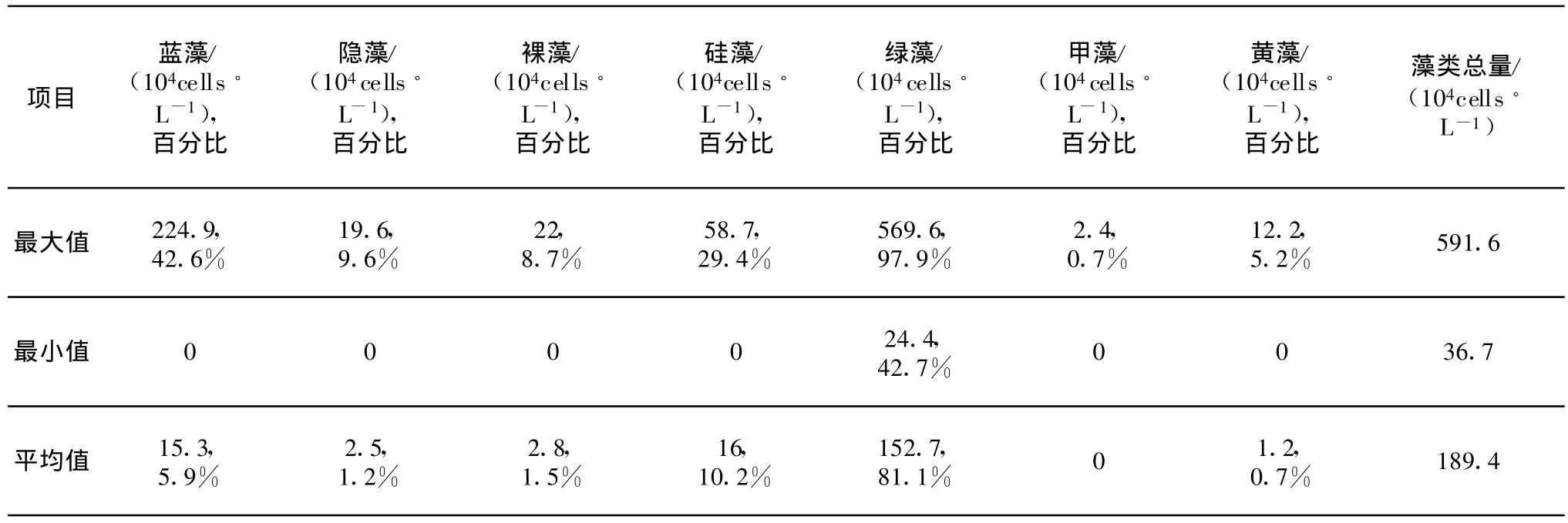
表3 2006年春季引灤原水藻類結構
春季引灤原水中檢出藻類7門40屬61種,其中綠藻是優勢類群,硅藻和藍藻含量次之。裸藻、隱藻、黃藻和甲藻的含量較低。
春季引灤原水中綠藻平均含量為152.7×104cells/L,占藻類總量的比例平均為81.1%,最高值出現在4月份,達569.6×104cells/L,占到藻類總量的96.3%,見圖2及圖3,共檢出綠藻20屬34種,優勢種有小球藻、細小四角藻、四尾柵藻、球衣藻、雙對柵藻等。其中小球藻、四尾柵藻及細小四角藻較為常見。小球藻的平均含量為66.9×104cells/L、四尾柵藻的平均含量為17.4×104cells/L。
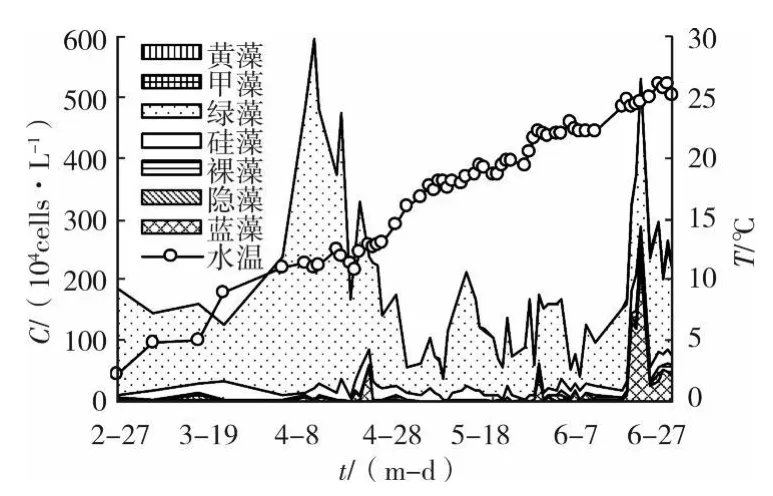
圖2 2006年春季引灤原水藻類組成變化
如圖3所示,春季引灤原水中的硅藻含量及所占比例都比較平穩,其含量平均為16×104cells/L(最高58.7×104cells/L),占藻類總量的比例平均為10.2%(最高29.4%)。共檢出硅藻有7屬 10種,其中常見的硅藻種類有短線脆桿藻和短小舟形藻,又以短小舟形藻的平均含量最高,為5.1×104cells/L。

圖3 2006年引灤原水藻類比例變化圖
藍藻是春季引灤原水中含量占第3位的藻類,占藻類總量的比例平均為5.9%(最高42.6%),共檢出藍藻有4屬6種。春季藍藻的最高含量出現在6月份。
春季引灤原水中裸藻、隱藻、黃藻和甲藻的含量較低,占藻類總量比例的平均值分別為1.5%、1.2%、0.7%以及不到0.1%。春季引灤原水中,共檢出裸藻5屬8種,隱藻1屬1種,黃藻1屬1種,甲藻1屬1種。
2.3.2 夏季(7月3日-9月26日)
夏季的引灤原水中共檢出藻類7門37屬55種,比春季少了6種。從藻類總量看,夏季明顯高于春季,藻類總量的平均值為2724.8×104cells/L(最高5933×104cells/L),是春季藻類總量平均值189.4×104cells/L的14.4倍。所以,也可稱夏季為高藻期。
藍藻在夏季引灤原水中占絕對優勢地位,其占藻類總量的比例在53.3%~98.1%之間,平均為90.0%,見圖3、圖4及表4。藍藻含量在夏季的平均值為2587.6×104cells/L(最高5810.8×104cells/L)。
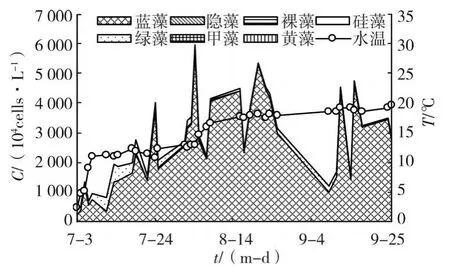
圖4 2006年夏季引灤原水藻類組成變化
夏季引灤原水中共檢到藍藻7屬11種,其中以水華微囊藻和圓胞束球藻比較常見,它們的平均含量分別為2320.8×104cells/L和168.3×104cells/L。
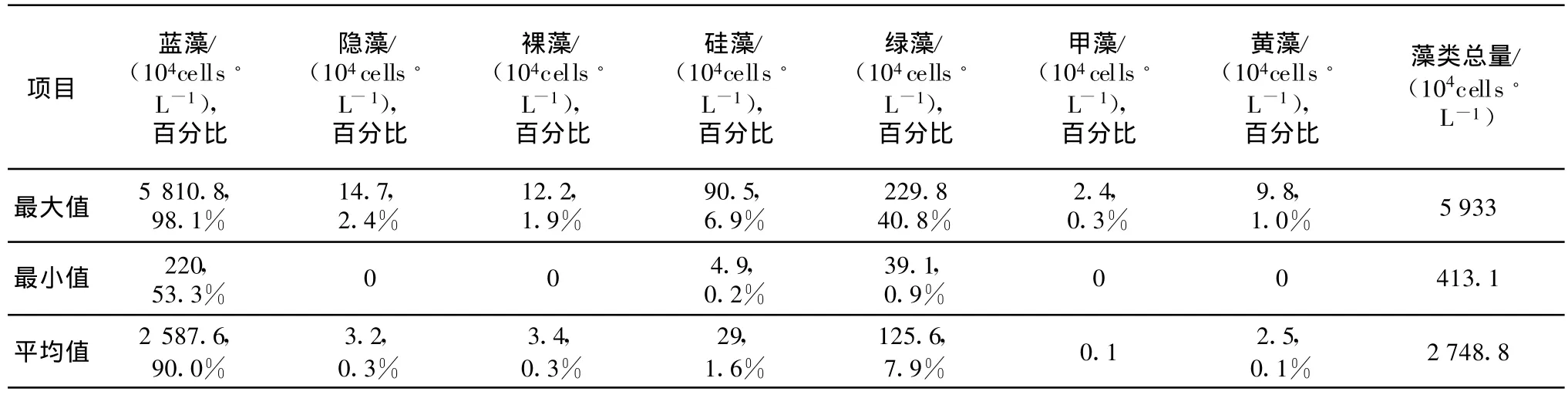
表4 2006年夏季引灤原水藻類結構
藍藻在夏季引灤原水中成為優勢類群是高溫條件下水華微囊藻大幅增殖并發揮競爭優勢的結果。多項研究[10-11]表明,水溫高于25℃是微囊藻水華暴發的重要條件。有研究表明,微囊藻通過分泌藻毒素可以抑制綠藻的生長,甚至微囊藻還可以抑制魚腥藻的生長[12]。在培養小球藻和銅綠微囊藻時,雖然小球藻最初對磷的利用效率和生長速度都高于銅綠微囊藻,但最后還是銅綠微囊藻占優勢地位[13]。而銅綠微囊藻與柵藻共培養時,銅綠微囊藻在高溫條件下獲得了優勢地位[14]。在6月下旬水溫上升到25℃左右時,引灤原水中的水華微囊藻開始增殖。隨著水溫的上升,水華微囊藻的含量開始快速增加,到7月3日,水華微囊藻含量占引灤原水藻類含量的50.3%,成為優勢藻,而藍藻也取代了綠藻在原水中的優勢地位。整個夏季看,水華微囊藻占引灤原水藻類總量比例的平均值為80.9%,占藍藻含量比例的平均值為89.7%。
由于水華微囊藻的競爭抑制作用,夏季引灤原水中的綠藻含量明顯低于春季,平均含量為125.6×104cells/L(最高229.8×104cells/L),占藻類總量的比例也降為7.9%。夏季引灤原水中共檢到綠藻19屬29種,其中以四尾柵藻、雙對柵藻、細小四角藻、小球藻、單角盤星藻比較常見。
硅藻在夏季引灤原水中藻類含量占第3位,夏季引灤原水中共檢到硅藻6屬9種。其中以短線脆桿藻、梅尼小環藻和窄異極藻較為常見。裸藻、隱藻、黃藻和甲藻在夏季引灤原水中占藻類總量的比例都低于0.5%。在夏季引灤原水中共觀察到裸藻2屬 3種,隱藻 1屬種,黃藻1屬 1種,甲藻 1屬1種。
2.3.3 秋季(9月26日之后)
秋季采樣雖然只有兩次(10月9日與10月12日),但也能大致反映秋季引灤原水藻類群落結構特征。水溫下降不再適合微囊藻生長[15],導致水中微囊藻含量急劇下降,因而引灤原水藻類總量下降為145.5×104cells/L。而綠藻含量受水溫影響不大,仍保持在100~200×104cells/L左右。綠藻在秋季引灤原水中重新成為為優勢類群,藻類群落結構特征與春季相似,如表5所示。秋季引灤原水中共檢出藻類15屬18種。
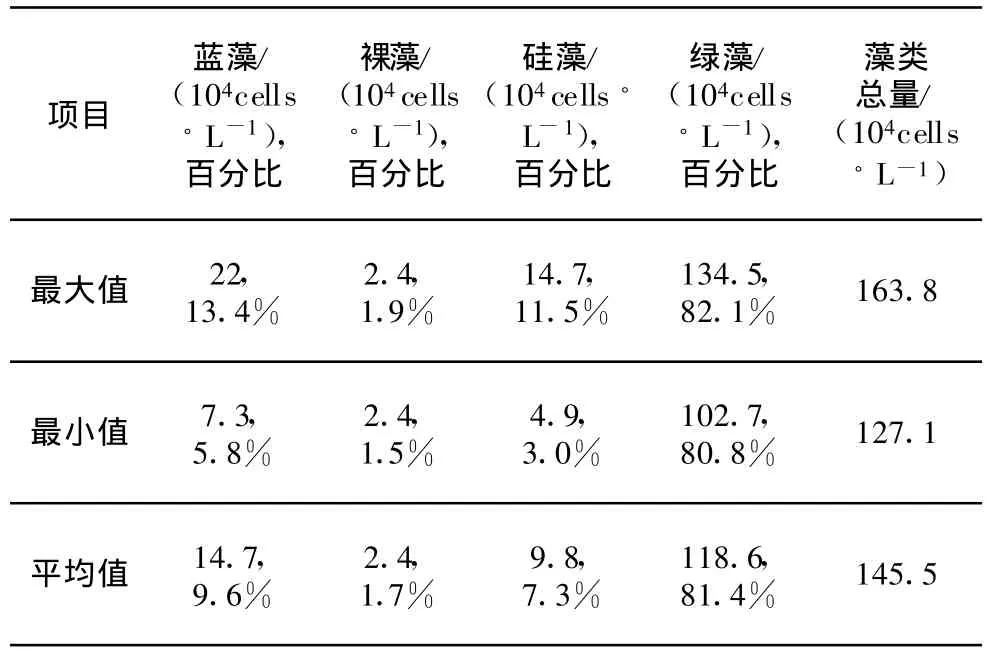
表5 2006年秋季引灤原水藻類結構
2.4 藻類生物多樣性
生物多樣性是測量生態系統中有機體間相對多樣性的尺度。原水的藻類生物多樣性指數在一定程度上能夠反映水體污染程度。該研究采用廣泛應用的Shannon指數表征藻類生物多樣性,該指數包含了物種豐富性和物種均勻性2方面的信息。對引灤原水藻類的Shannon指數進行計算的結果如圖5所示。
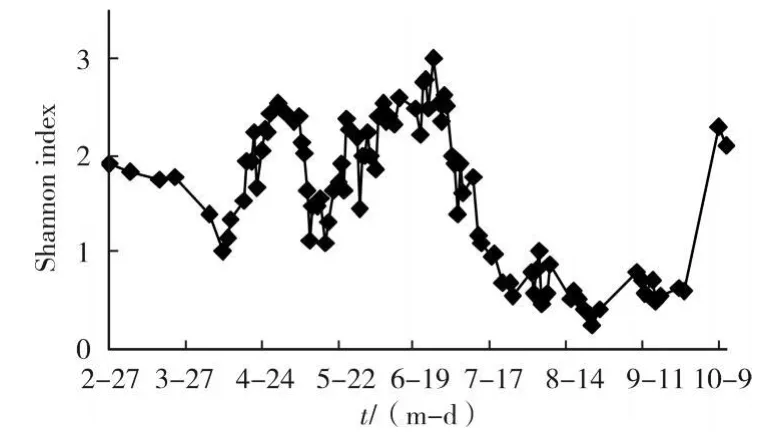
圖5 2006年引灤原水藻類多樣性指數變化
引灤原水藻類的Shannon指數在春季、夏季和秋季的平均值分別為2.03、0.855和2.193。根據多樣性指數的評價標準,引灤原水在春秋季屬于輕度污染,而夏季屬于嚴重污染。從表2可知,夏季的引灤原水中藻類種數明顯高于春季,然而多樣性指數卻降到最低。這是因為春季綠藻優勢類群由多種藻類組成,藻種之間保持了相對均勻,而夏季水華微囊藻的大量增殖影響了這種均勻,從而導致群落結構不平衡。引灤原水多樣性指數和水華微囊藻含量之間呈顯著的負相關關系(r=-0.793,p<0.001),水華微囊藻的大量增殖導致了多樣性指數的降低。
2.5 水質與藻類的相互影響
由前述可知,水溫對引灤原水藻類群落結構的變化有重要影響。水溫相對較低的春季和秋季,引灤原水中綠藻為優勢類群、藻類含量相對較低;而水溫較高的夏季,藍藻為優勢類群、藻類含量相對較高。這種趨勢性的判斷也得到了Pearson相關性分析的數據支持。如表6所示,水溫同藻類總量,藍藻含量及葉綠素a含量有顯著的正相關關系,同綠藻呈弱的負相關關系。由于藍藻對高水溫的適應和競爭優勢的發揮,水溫升高促進了藍藻、藻類總量和葉綠素a含量的升高,而導致綠藻含量有所下降。
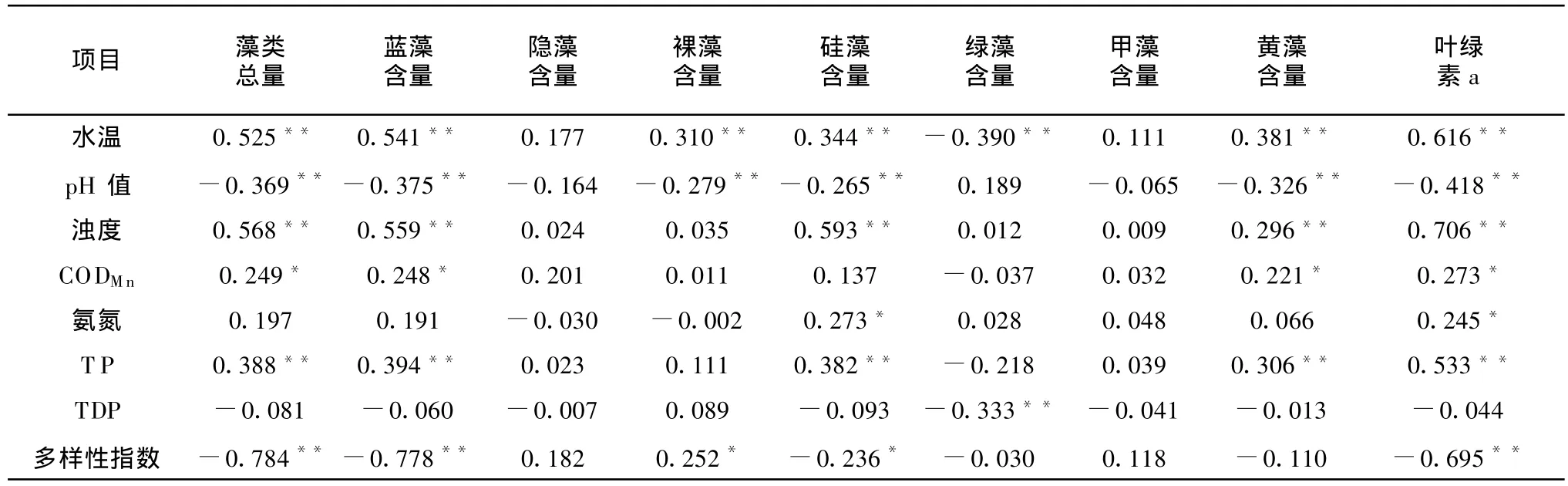
表6 引灤原水藻類含量與水質參數相關系數
在2月-4月間,引灤原水pH值隨著藻類的復蘇性增長而升高。但此后pH值與藻類含量并未呈正相關關系。一般情況下,由于藻類光合作用消耗CO2,藻類含量增加導致pH值升高,即藻類含量與pH值之間呈現正相關關系。然而,由表6可知,引灤原水藻類總量、藍藻及葉綠素a含量同pH值呈負相關關系。為進一步了解水溫、藻類總量對pH值的影響,進行了偏相關分析。首先控制藻類總量的影響,對水溫和pH值進行偏相關分析,二者呈負相關關系(r=-0.555,p<0.01);控制了水溫的影響后,對藻類總量和pH值進行偏相關分析,二者無相關關系(r=-0.047,p=0.648)。偏相關分析表明,藻類總量對引灤原水pH值并無影響,而水溫與pH值有一定的相關性,這仍與其他水體中的常見趨勢不同。推測原因,可能是由于在長距離引水的某個環節中其他因素影響了引灤水的pH值,從而破壞了自然水體中藻類總量與pH值之間固有的相關關系。
濁度與總磷這2項參數與藻類總量、藍藻、硅藻及葉綠素a含量呈正相關關系。然而控制了水溫的影響,分別對濁度與藻類總量以及總磷與藻類總量進行偏相關回歸分析之后發現,濁度與藻類總量仍然呈正相關關系(r=0.465,p<0.01),總磷與藻類總量之間幾乎沒有了相關關系(r=0.120,p=0.29)。這是由于水溫升高導致了濁度和藻類含量的同步增加,而濁度升高并不影響藍藻的增殖。偏相關分析表明,總磷并不是引灤水中藻類含量增加的限制性因素,與前述富營養化水平指數(TLI)分析結果一致。
氮和磷是對藻類的生長有著決定性的影響營養元素,很多情況下,藻類的生長處于氮限制或磷限制的狀態。如表1所示,引灤原水處于中營養-輕度富營養狀態,藻類生長過程中營養充足甚至相對過剩。因此,文中引灤原水的高錳酸鹽指數、氨氮和總溶解性磷等參數與藻類含量之間沒有表現出明顯的相關性,是可以理解的。
需要指出的是,這里的相關分析是指線性相關,上述的相關性較弱或無相關性都是從線性相關而言,并不表示它們之間不存在更為復雜的非線性相關關系。
3 討論
引灤原水藻類群落結構變化有很強的季節特點,春季以綠藻為優勢類群,雖然在4月份出現過一個復蘇性的藻類小高峰,但整個春季中引灤原水藻類含量平均小于200×104cells/L,這個含量不影響給水處理工藝的正常運行。到了夏季,由于水華微囊藻的大量增殖,藍藻成為優勢類群,引灤原水藻類含量平均達到2748.8×104cells/L,最高時曾接近6000×104cells/L,如此高的藻類含量當然會影響給水處理工藝的正常運行。由于水溫降低,秋季中藍藻優勢不再,綠藻重新成為優勢類群,藻類含量也降低到不再明顯影響給水處理工藝正常運行的水平。因此,對于引灤原水,應該針對夏季以微囊藻為優勢藻的高藻期進行除藻研究或除藻方案制定,并且在選擇有可能破壞藍藻細胞的除藻工藝(如預氧化)時應該特別慎重。
4 結論
根據對引灤原水藻類群落結構的調查及分析,可以得出如下結論:
1)引灤原水中溫度對藻類群落結構變化有重要影響。引灤原水中的藻類在春、秋季以綠藻為主,藻類含量較低;夏季由于水華微囊藻的大幅增殖,藍藻成為優勢類群,藻類含量較高。
2)夏季水華微囊藻的大幅增殖導致引灤原水藻類生物多樣性指數下降。
3)總磷不是引灤水中藻類含量增加的限制性因素,pH值與藻類群落結構變化之間也未體現出自然水體中常見的相關關系。
[1]趙志偉,崔福義,任剛,等.預氧化對灤河天津段高藻期藻類的控制效果[J].沈陽建筑大學學報,2006,22(4):617-621.ZHAO ZHI-WEI,CUI FU-YI,REN GANG,et al.Control alga in Tianjin Luanhe river during high alga period by preoxidation[J].Journal of Shenyang Jianzhu University,2006,22(4):617-621.
[2]張錦,陳忠林,范潔,等.高錳酸鉀及其復合藥劑強化混凝除藻除嗅對比[J].哈爾濱工業大學學報,2004,36(6):736-738.ZHANG JIN,CHEN ZHONG-LIN,FAN Jie,et al.Comparison between removals of algae and odor by coagulation and enhanced coagulation ofpotassium permanganate and its composite chemical[J].Journal of Harbin Institute of Technology,2004,36(6):736-738.
[3]王玉恒,王啟山,吳玉寶,等.分段回流式逆流氣浮工藝處理高藻水的研究[J].環境科學,2008,29(11):3071-3076.WANGYU-HENG,WANGQI-SHAN,WUYUBAO,et al.T reatment of high algae-laden water by step-recycle counter current flotation[J].Environmental Science,2008,29(11):3071-3076.
[4]侯翠榮,賈瑞寶.化學氧化破壞藻體及胞內藻毒素釋放特性研究[J].中國給水排水,2006,22(13):98-101.HOUCUI-RONG,JIA RUI-BAO.Mechanism of discomposing of cyanobacterium cells and release of intracellular Microcystins bychemical oxidation for drinking watertreatment[J].China Water &Wastewater,2006,22(13):98-101.
[5]DALY R I,HO L,and BROOKES D.Effect of Chlorination on Microcystis aeruginosa Cell Integrity and Subsequent Microcystin Release and Degradation[J].Environmental Science&Technology.,2007,41(12):4447-4453.
[6]方晶云,馬軍,王立寧,等.臭氧預氧化對藻細胞及胞外分泌物消毒副產物生成勢的影響[J].環境科學,2006,27(6):1127-1132.FANG JING-YUN,M A JUN,WANG LI-NING,et al.Effect of preozonation on disinfection by-products formation potential ofalgae cells and extracellular organic matter[J].Environmental Science,2006,27(6):1127-1132.
[7]國家環保總局.水和廢水監測分析方法[M].4版.北京:中國環境科學出版社,2002.
[8]胡鴻鈞,魏印心.中國淡水藻類[M].北京:科學出版社,2006
[9]PA LMER C M.A composite rating of algae tolerating organic pollution[J].Journal of Phycology,1969,5(1):78-82.
[10]王得玉,馮學智,周立國,等.太湖藍藻爆發與水溫的關系的 MODIS遙感[J].湖泊科學,2008,20(2):173-178.WANG DE-YU,FENG XUE-ZHI,ZHOU LI-GUO,et al.Relationship between blue algal bloom and water temperature in Lake Taihu based on MODIS[J].Journal of Lake Sciences,2008,20(2):173-178.
[11]陳橋,韓紅娟,翟學晶,等.太湖地區太陽輻射與水溫的變化特征及其對葉綠素a的影響[J].環境科學學報,2009,29(1):199-206.CHENQIAO,HANHONG-JUAN,ZHAIXUEJING,et al.Influence of solar radiation and water temperature on chlorophyll-a levels in LakeTaihu,China[J].Acta Scientiae Circumstantiae,2009,29(1):199-206.
[12]LAM C W Y,SILVESTER W B.Growth interactions among blue-green(Anabaena Oscillarioides,Microcystis aeruginosa)and green(Chlorellasp.)algae[J].Hydrobiologia,1979,63(2):135-143.
[13]QIAN S,KONG F,SHIX,et al.Interspecific interaction between microcystis aeruginosa and Chlorella Pyrenoidosa in Different Phosphate Media[J].Journal of Freshwater Ecology,2008,23(4):635-642.
[14]譚嘯;孔繁翔;曹煥生,等.利用流式細胞儀研究溫度對兩種藻競爭的影響[J].湖泊科學,2006,18(4):419-424.TANXIAO,KONGFAN-XIANG,CAOHUANSHENG,etal.Influences of temperatures on the competition between species of algae assayed by flow cytometry[J].Journal of Lake Sciences,2006,18(4):419-424.
[15]WU Z,SONG L and LI R.Different tolerances and responses to low temperature and darkness between waterbloom forming cyanobacterium microcystis and a green alga Scenedesmus[J].Hydrobiologia,2008,596(1):47-55.

