納米Ag-SiO2導尿管在家兔導尿管相關性尿路感染中抗菌性的研究
郭云童,劉 春,張 利 (山西醫科大學第一臨床醫學院泌尿外科,太原 030001;通訊作者,E-mail:sxtyliuchun@126.com)
留置導尿管所發生的導尿管相關性尿路感染(catheter-associated urinary tract infections,CAUTIs)約占整個醫院感染病例的42%,成為僅次于呼吸道感染的醫源性感染[1]。導尿管作為泌尿外科常用的一種體內植入物,隨著留置時間的延長,細菌會在導尿管表面形成一層生物膜[2](bacteria biofilm,BBF),存在于生物膜內的細菌通過特殊的耐藥機制和緩慢釋放,引起患者泌尿系乃至全身的反復感染,成為臨床上的難治性感染。制備一種穩定、長效及安全的抗感染導尿管以有效防治CAUTIs的發生是國內外眾多研究者的研究方向,本研究通過實驗觀察納米Ag-SiO2導尿管與普通醫用導尿管對家兔CAUTIs的發生率,選取炎性因子白細胞介素10(IL-10)和腫瘤壞死因子α(TNF-α)作為免疫組化監測指標,探討納米Ag-SiO2導尿管效抗菌性,為臨床防治導尿管相關性尿路感染提供理論依據,報道如下。
1 材料與方法
1.1 材料 3-4月齡雄性家兔40只,體重2-3 kg,山西醫科大學實驗動物中心提供;納米Ag-SiO2導尿管由太原理工大學材料學院提供,普通醫用F8導尿管;IL-10和TNF-α均購自北京博奧森生物技術有限公司。
1.2 方法
1.2.1 分組 將2-3 kg的雄性家兔按照留置導尿管周數的不同,隨機分為1周組、2周組、3周組、4周組,每組各10只;每組再隨機分為實驗組和對照組,每組各5只。實驗組留置納米Ag-SiO2導尿管,對照組留置普通醫用F8導尿管,分別固定導尿管。1.2.2 實驗方法 分別于留置導尿管后第1,2,3,4周解剖各組中的家兔尿道,尿道組織標本經4%中性甲醛固定48 h后行脫水、透明、石蠟包埋后免疫組織化學染色(Envision法)。
1.2.3 結果評定方法 免疫組化結果評定:抗體的表達在尿道黏膜細胞中以細胞質或核膜棕黃色染色為陽性信號,細胞質和核膜藍染為不表達。在捷達801專業數碼凝膠成像與分析系統3.3下,觀察陽性細胞分布部位及表達特征,計算同一解剖部位、5個不同視野內陽性細胞的平均密度(OD)。OD值越高,表示IL-10或TNF-α表達量越多。
2 結果
2.1 IL-10表達 對IL-10表達的平均密度值進行析因設計方差分析,實驗組與對照組比較F=73.515,P組別<0.001,認為 IL-10 在實驗組和對照組的表達存在差異(見表1);不同周數間比較,F=64.045,P周數<0.001,認為 IL-10 在不同周數的表達也存在差異,具有統計學意義;同一時間點,實驗組IL-10的表達顯著高于對照組(P<0.05);IL-10 總體表達趨勢比較,F=4.076,P組別×周數=0.015,認為實驗組和對照組IL-10表達的平均密度值存在交互作用,實驗組和對照組IL-10的表達均呈下降趨勢,但實驗組較對照組下降趨勢要小;對實驗組第4周和對照組第2周的IL-10表達平均密度值進行t檢驗,t=2.244,P=0.065,尚不能認為二者之間的差異具有統計學意義。
表1各組家兔尿道黏膜IL-10表達的平均密度值(±s,n=5)Tab 1The expression of IL-10 in urethral mucosa in different groups(±s,n=5)

表1各組家兔尿道黏膜IL-10表達的平均密度值(±s,n=5)Tab 1The expression of IL-10 in urethral mucosa in different groups(±s,n=5)
與對照組比較,▲P <0.05
1周 2周 3周 4周實驗組 0.325±0.039▲ 0.200±0.021▲ 0.177±0.016▲ 0.149±0.002▲對照組 0.212 ±0.049 0.145 ±0.004 0.122 ±0.006 0.106 ±0.010
2.2 TNF-α 表達 對TNF-α 表達的平均密度值進行析因設計方差分析,實驗組與對照組比較,F=536.223,P組別<0.001,認為 TNF-α 在實驗組和對照組的表達存在統計學差異(見表2);不同周數比較,F=101.956,P周數<0.001,認為 TNF-α 在不同周數的表達也存在差異,具有統計學意義;同一時間點,實驗組TNF-α的表達低于對照組,差異具有統計學意義(P<0.05);TNF-α 總體表達趨勢比較,F=4.412,P組別×周數=0.010,認為實驗組和對照組所表達的TNF-α平均密度值存在交互作用,實驗組和對照組TNF-α的表達均呈上升趨勢,但實驗組較對照組上升趨勢要小;對實驗組第4周和對照組第1周的TNF-α表達平均密度值進行t檢驗,t=1.652,P=0.154,尚不能認為二者之間的差異具有統計學意義。
表2各組家兔尿道黏膜TNF-α表達的平均密度值(±s,n=5)Tab 2The expression of TNF-α in urethral mucosa in different groups(±s,n=5)
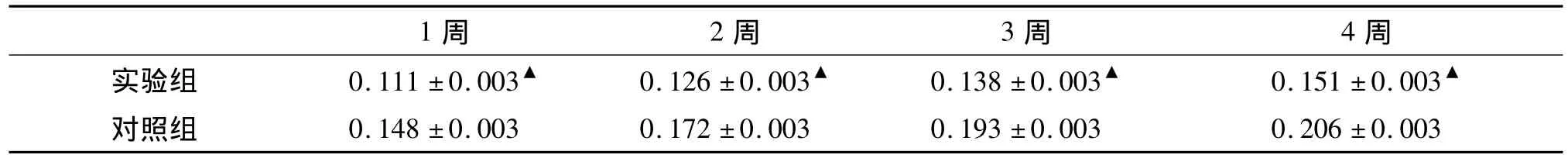
表2各組家兔尿道黏膜TNF-α表達的平均密度值(±s,n=5)Tab 2The expression of TNF-α in urethral mucosa in different groups(±s,n=5)
與對照組比較,▲P <0.05
1周 2周 3周 4周實驗組 0.111±0.003▲ 0.126±0.003▲ 0.138±0.003▲ 0.151±0.003▲對照組 0.148 ±0.003 0.172 ±0.003 0.193 ±0.003 0.206 ±0.003
3 討論
隨著醫用體內植入物的廣泛應用,醫源性感染已經成為臨床治療工作中的一個突出問題。其中,導尿管相關性尿路感染(CAUTIs)的發病率已成為僅次于呼吸道感染的醫源性感染[1]。尿路感染的發生率與導尿管的留置時間長短具有相關性,留置時間越長,發生感染的機率也越大。徐敏等[3]報道插管第3天菌尿發生率為26.7%,第7天菌尿發生率為66.7%,第10天菌尿發生率高達93.3%。國外文獻報道,開放留置導尿管5 d以上泌尿系統感染率接近 100%[4]。
導尿管作為人體異物,在導尿管表面容易形成細菌生物膜(BBF)[2]。生物膜中細菌的生物特性不同于自由細菌,具有較強的耐藥性,而且容易躲避人體免疫系統的殺傷[5]。置入體內的生物材料一旦形成生物膜,存在于生物膜內的細菌通過其特殊的耐藥機制和緩慢釋放,引起泌尿系乃至機體全身的感染,經久不愈。同時,因為抗菌藥物難以進入生物膜,即使使用大量的抗感染藥物也難以治愈,久之,還會產生耐藥性,成為臨床上的難治性感染。因此,防治尿路感染的關鍵在于阻止細菌生物膜的形成,而阻止生物膜形成的一個重要方法便是改變導尿管的表面結構及組成,使其具有殺滅病原微生物的作用[6,7]。
抗感染導尿管材料的研究,諸如普通硅膠導尿管經呋喃西林、美滿霉素和利福平等包被處理,可有效降低短期(<2-3周)留置尿管發生CAUTIs的風險,但長期使用不可避免地出現微生物耐藥菌屬的產生;在普通導尿管表面鍍銀或滲銀的技術制備抗感染導尿管,如Sandblom等[8]制備的銀-水凝膠鍍膜尿管、Rupp等[9]制備的銀合金-水凝膠鍍膜尿管,可以使CAUTIs的發生下降,然而,由于制備工藝的缺陷,鍍銀層極易脫落而喪失抗感染功能,該導尿管在體內留置7 d以后,導尿管表面仍能形成細菌生物膜[10]。
納米Ag-SiO2,是將納米二氧化硅載體與具有較強殺菌能力的銀離子吸附制得的,Ag+由于其活潑的化學性質,容易從載體中緩慢釋放、游離至導尿管的表面,當與微生物接觸時,導尿管表面材料緩慢釋放出 Ag+[11],當微量 Ag+到達微生物細胞膜時,因后者帶負電荷,依靠庫侖引力,使二者牢固吸附,Ag+穿透細胞壁進入胞內[12]。而Ag+的抗菌性則從Ag+對細胞膜呼吸產能相關的電子傳輸系統影響、與細胞膜上物質運輸相關蛋白的相互作用、破壞細菌外膜蛋白的合成、與RNA和DNA形成不溶復合物而使菌體細胞死亡或生長受到抑制等多方面發揮作用的[13-15]。
前期本科研小組已經進行了納米Ag-SiO2抗感染導尿管體外抑菌性能檢測分析的實驗,實驗結果顯示,納米Ag-SiO2粉末對金黃色葡萄球菌和大腸桿菌均有抑菌性[16]。
本研究比較家兔留置納米載銀二氧化硅(納米Ag-SiO2)導尿管和普通醫用導尿管后,不同時間(1周、2 周、3 周、4 周)白細胞介素10(IL-10)和腫瘤壞死因子 α(TNF-α)在尿道黏膜的表達情況。IL-10作為一種抑炎因子主要對單核巨噬細胞發揮影響,抑制后者的黏附、激活及多種細胞因子的生成。IL-10可通過抑制單核/巨噬細胞激活和增殖來下調炎癥反應,同時還能拮抗炎性介質的作用,但二者是通過不同途徑進行的[17]。IL-10作為一種理想的抑炎因子,一方面抑制炎性細胞的激活、遷移與黏附;另一方面抑制炎癥因子的合成與釋放[18]。TNF-α生物活性主要表現為抗感染,引起炎癥反應和抗腫瘤,是促炎性因子,是炎癥反應過程中出現最早的且最重要的細胞因子,被認為是炎癥反應中最重要的啟動因子[19]。IL-10 為炎癥抑制因子,TNF-α 為炎癥促進因子,是一對相互調節的細胞因子,他們具有多種生物學活性,二者共同作用介導著炎癥的發展[20,21]。
本實驗結果顯示:①實驗組和對照組IL-10和TNF-α的表達在不同周數間均存在統計學差異;②同一時間點,實驗組IL-10的表達高于對照組,實驗組TNF-α的表達低于對照組,差異均具有統計學意義;③實驗組和對照組IL-10或TNF-α的表達存在交互作用,且實驗組IL-10表達的下降趨勢和TNF-α表達的上升趨勢均明顯小于對照組;④實驗組第4周TNF-α與對照組第1周比較,實驗組第4周IL-10表達與對照組第2周比較尚不能認為存在統計學差異。
因而,研究認為納米Ag-SiO2導尿管具有抗菌性,應用納米Ag-SiO2導尿管可顯著減少導尿管相關性尿路感染的發生率。
4 結論
①納米Ag-SiO2導尿管具有抗菌性;②應用納米Ag-SiO2導尿管可顯著減少導尿管相關性尿路感染的發生率。
[1] Sedor J,Mulholland SG.Hospital-acquired urinary tract infections associated with the indwelling catheter[J].Urol Clin North Am,1999,26:821-828.
[2] Costerton JW,Stewart PS,Greenberg EP.Bacterial biofilm:A common cause of persistent infection[J].Science,1999,284:1318-1321.
[3] 徐敏,徐榕,張優琴.留置導尿管與醫院泌尿系感染的關系[J].中華醫院感染學雜志,2001,11(5):368-369.
[4] 吳曉華,鄧豫.留置導尿時間及病區環境對留置導尿后尿路逆行感染的影響[J].南方護理學報,2002,9(4):348-351.
[5] 武建國.細菌生物膜及其臨床問題[J].臨床檢驗雜志,2003,31(4):48-49.
[6] Nicolle LE.Catheter-related urinary tract infection[J].Drugs Aging,2005,22(8):627-639.
[7] Greenberg EP.Bacterial communication and group behavior[J].J Clin Invest,2003,112(9):1288-1290.
[8] Sandblom G,S?rensen J,Lundin N.Positron emission tomography with c 11-acetate for tumor detection and localization in patients with prostate-specific antigen relapse after radical prostatectomy[J].Urology,2006,67(5):996-1000.
[9] Rupp ME,Fitzgerald T,Marion N,et al.Effect of silver-coated urinary catheters:Efficacy,cost-effectiveness,and antimicrobial resistance[J].Am J Infect Control,2004,8(32):445-450.
[10] 張萍,吳雪紅,姜培齊.橡膠導尿管表面被覆銀后殺菌效力試驗[J].中華醫院感染學雜志,2001,89(3):207-208.
[11] Yoon KY,Byeon JH,Park JH,et al.Susceptibility constants of escherichia coli and bacillus subtilis to silver and copper nanoparticles[J].Sci Total Environ,2007,373:572-575.
[12] Dibrov P,Dzioba J,Gosink KK,et al.Chemiosmotic mechanism of antimicrobial activity of Ag+in vibrio cholerae[J].Antimicrob Agents Chemother,2002,46:2668-2670.
[13] Holt KB,Bard AJ.Interaction of silver(I)ions with the respiratory chain of Escherichia coli:an electrochemical and scanning electrochemical microscopy study of the antimicrobial mechanism of micromolar Ag+[J].Biochemistry,2005,44:132-134.
[14] Lok CN,Ho CM,Chen R,et al.Proteomic analysis of the mode of antibacterial action of silver nanoparticles[J].J Proteome Res,2006,5:916.
[15] Thomas V,Yallapu MM,Sreedhar B,et al.A versatile strategy to fabricate hydrogel-silver nanocomposites and investigation of their antimicrobial activity[J].J Colloid Interf Sci,2007,315:389.
[16] 劉春,邊海龍,牛梅,等.納米Ag-SiO2抗感染導尿管體外抑菌性能檢測分析[J].中國藥物與臨床,2009,9(8):777-778.
[17] Heper Y,Akalin EH,Mistik R,et al.Evaluation of serum creactive protein,procalcitonin,tumor necrosis factor alpha,and interleukin-10 levels as diagnostic and prognostic parameters in patients with community-acquired sepsis,severesepsis,and septic shock[J].Eur J Clin Microbiol Infect Dis,2006,25(8):481-491.
[18] Monneret G,Finck ME,Venet F,et al.The anti-inflammatory response dominates after septic shock:association of low monocyte HLA-DR expression and high interleukin-10 concentration[J].Immunol Lett,2004,95(2):193-198.
[19] Pujol BR,Todd I,Doshi M,et al.HLA classⅡ induction in human islet cel1 by interferon-γ plus tumor necrosis factor or lymphotoxin[J].Nature,1987,326:305.
[20] Stoycheva M,Murdjeva M.Serum levels of interferon-gamma,interleukin-12,tumour necrosis factor-alpha,and interleukin-10,and bacterial clearance in patients with gastroenteric salmonella infection[J].Scand J Infect Dis,2005,37(1):11-14.
[21] Buyne OR,Bleichrodt RP,Verweij PE,et al.A peritonitis model with low mortality and persisting intraabdominal abscesses[J].Int J Exp Pathol,2006,87(5):361-368.
- 山西醫科大學學報的其它文章
- 雙J管對腎盂壓力的影響及臨床意義
- 妊娠晚期婦女心電圖短P-R間期的臨床意義

