Nb2O5/γ-Al2O3表面鈮氧物種的分散狀態與酸性特征
何 杰 范以寧
(1安徽理工大學化學工程學院,安徽淮南 232001;2南京大學化學化工學院,介觀化學教育部重點實驗室,南京 210093)
Nb2O5/γ-Al2O3表面鈮氧物種的分散狀態與酸性特征
何 杰1,2,*范以寧2
(1安徽理工大學化學工程學院,安徽淮南 232001;2南京大學化學化工學院,介觀化學教育部重點實驗室,南京 210093)
負載型Nb2O5是多種催化反應的有效催化劑.以草酸鈮為前驅物,γ-Al2O3為載體,通過浸漬法制備不同負載量的Nb2O5/γ-Al2O3催化劑.采用粉末X射線衍射(XRD)、激光拉曼光譜(LRS)和吡啶吸附傅立葉變換紅外(Py-IR)光譜方法對催化劑表面鈮氧(NbOx)物種的分散特征、酸性特征進行表征,通過異丁烯(IB)與異丁醛(IBA)縮合生成2,5-二甲基-2,4-己二烯(DMHD)反應評價催化劑表面酸催化活性.結果表明,Nb在γ-Al2O3表面的單層分散容量(ΓNb)為7.6 μmol·m-2,與“嵌入模型”理論分析Nb5+分散在γ-Al2O3優先暴露晶面(110)上八面體空位中的單層分散容量值7.5 μmol·m-2接近,即分散的Nb5+離子鍵合在γ-Al2O3表面八面體空位中.在低負載量下,分散在γ-Al2O3表面的Nb2O5主要以孤立的NbOx物種形式通過Nb—O—Al鍵與載體表面鍵合,與LRS結果一致.處于孤立狀態下的NbOx物種使表面Lewis酸位量下降.隨負載量的增加,孤立的NbOx物種通過Nb—O—Nb鍵連接而聚集,并形成表面Br?nsted酸位,隨著NbOx聚集度增加,表面Br?nsted酸密度增加,酸性增強,對IBA與IB縮合反應催化活性增加.當負載量超過單層分散容量時,NbOx物種呈現三維聚集狀態,DMHD的轉化頻率(TOF)降低,同時表面Br?nsted酸性增強,導致目標產物DMHD的選擇性降低.Nb2O5/γ-Al2O3催化劑表面Br?nsted酸特征與NbOx物種聚集狀態密切相關.
表面酸性;Nb2O5/γ-Al2O3;表面NbOx物種;烯醛縮合反應
鈮氧化物及其材料在許多催化應用領域均是有效的催化劑[1-5],如酸催化、選擇性氧化、光催化等.除了直接用作催化劑外,鈮氧化物還用于二維氧化鈮覆蓋層[6-11]、氧化物載體[12]或混合氧化物[13-14]以及催化劑的促進劑[15]等.在鈮氧化物眾多的催化反應中,酸催化是其重要應用之一.作為一種酸性氧化物,Nb2O5的酸性與大多數氧化物不同,晶相Nb2O5幾乎不呈現酸性,以無定型態存在的鈮酸(Nb2O5· nH2O)具有較強的酸性且對一些反應具有較高的酸催化活性,同時它具有很好的耐水性[16-17],如作為烯烴水合、醇脫水、脂肪酸與醇酯化以及烯醛縮合等反應的催化劑,因此,在有機合成及石油化工等領域鈮酸作為酸催化劑有非常良好的應用前景.將Nb2O5負載于金屬氧化物載體上,因表面NbOx物種與載體之間的相互作用使得表面鈮氧化物的物理化學性質與本體相明顯不同,并隨著載體性質、負載量以及制備條件不同,表面鈮氧化物的結構狀態以及催化性質發生變化[7,9-10,18-19].負載型Nb2O5主要起酸催化劑的作用,表面NbOx物種的狀態與酸特征之間存在著密切的關系[6,9-11],而酸性特征與催化性能密切聯系.本研究在運用X射線衍射(XRD)相定量分析等方法討論NbOx物種在TiO2表面分散狀態的基礎上[9],進一步采用該方法并結合激光拉曼光譜(LRS)技術以及“嵌入模型”研究Nb2O5/γ-Al2O3催化劑表面NbOx物種的分散狀態及其與載體/γ-Al2O3之間的相互作用;通過異丁烯(IB)與異丁醛(IBA)縮合生成2,5-二甲基-2,4-己二烯(DMHD)反應的酸催化性能以及吡啶吸附紅外光譜表征催化劑表面酸性特征,探討γ-Al2O3表面NbOx物種的分散狀態、表面酸性特征以及酸催化活性之間的關系.
1 實驗部分
1.1 負載型Nb2O5/γ-Al2O3催化劑制備
將一定量鈮酸(AR)溶于0.5 mol·L-1H2C2O4(AR)溶液制成草酸鈮溶液,將直徑約為2 mm的γ-Al2O3小球(天津化工研究院,SBET=232 m2·g-1)浸入計量的上述溶液中,于333-343 K旋轉蒸發除去水分,再經393 K干燥12 h,在設定溫度空氣氣氛中焙燒一定時間,得到負載型鈮氧化物催化劑.高負載量的催化劑由多次浸漬焙燒方法制備.
1.2 催化劑表征
X射線粉末衍射(XRD)測定在Shimadzu XD-3A型X射線衍射儀上進行,Cu Kα,λ=0.15418 nm,Ni濾波,管電壓35 kV,管電流15 mA.以晶相V2O5為內標求得不同負載量樣品中Nb2O5(202)面與V2O5(001)面衍射峰的相對強度INb2O5(202)/IV2O5(001),用外推法求得Nb2O5在γ-Al2O3載體表面的單層分散容量.紅外光譜測試在德國Bruker公司Vector 22型紅外光譜儀上進行.催化劑樣品經研磨后壓成自支撐片(約6 mg)于573 K、10-3Pa下抽空處理2 h,降至室溫后攝取本底紅外光譜.處理后的樣品室溫下吸附吡啶飽和蒸汽(蒸汽壓為612 Pa)30 min,然后分別于298、423和573 K下抽空1 h,冷卻至室溫攝譜.減去樣品的本底譜即得樣品吸附吡啶的紅外光譜(Py-IR).分辨率4.0 cm-1,掃描次數:120.激光拉曼光譜(LRS)測試在法國JY公司JY HR800型激光Raman光譜儀上進行,激發光源波長546 nm.
1.3 催化性能評價
IB/IBA縮合生成DMHD反應在一臺直型不銹鋼反應裝置上進行,反應條件見文獻[20].
2 結果與討論
實驗考察Nb2O5在γ-Al2O3載體表面的分散狀態以及晶相形成條件,將Nb負載量ΓNb為19.5 μmol·m-2的樣品于不同溫度焙燒24 h后,用XRD方法檢測表面Nb2O5晶相形成溫度.結果表明,在 873 K及以下溫度未觀察到明顯的晶態Nb2O5形成,當焙燒溫度達973 K時,Nb2O5在載體γ-Al2O3表面形成γ-Nb2O5晶相.
不同負載量的Nb2O5/γ-Al2O3樣品經973 K焙燒24 h后的XRD測定結果示于圖1.由圖1可見,當Nb負載量在6.5 μmol·m-2以下時,未見晶相Nb2O5衍射峰,當Nb負載量達9.7 μmol·m-2時, XRD譜中出現了Nb2O5衍射峰,且其強度隨著Nb2O5負載量增加而明顯增強.以晶相V2O5為內標物測定Nb2O5/γ-Al2O3中Nb2O5(202)與V2O5(001)面衍射峰相對強度(INb2O5(202)/IV2O5(001))與Nb2O5負載量的關系,結果示于圖2.用外推求得Nb在γ-Al2O3表面的單層分散容量為7.6 μmol·m-2.
Nb2O5/γ-Al2O3催化劑LRS譜示于圖3.Nb負載量在分散容量7.6 μmol·m-2以下時,Nb2O5/γ-Al2O3催化劑僅在906 cm-1處出現一拉曼峰,該峰歸屬于載體γ-Al2O3表面八面體NbO6物種[21].隨負載量增加,906 cm-1拉曼峰位置峰強度增加,這是由于載體表面NbO6物種濃度增加.當負載量超過單層分散容量時,Nb2O5/γ-Al2O3催化劑在600-700 cm-1范圍出現一個寬的拉曼峰(圖3d),該峰與無定形鈮酸和晶相Nb2O5中聚集的NbOx物種Nb—O—Nb拉曼位移相近,表明超出分散容量的這部分鈮氧物種以三維聚集體或晶相形式存在,結果與XRD結果一致.
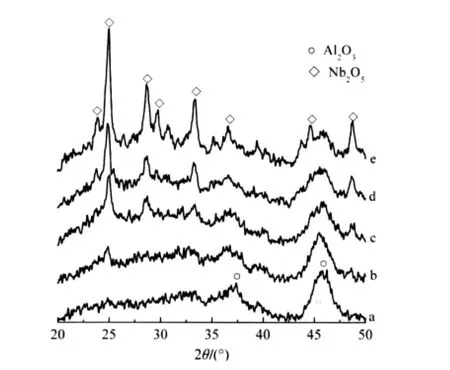
圖1 不同負載量的Nb2O5/γ-Al2O3樣品XRD圖Fig.1 XRD patterns of Nb2O5/γ-Al2O3catalysts with different Nb2O5loadingΓNb/(μmol·m-2):(a)6.5,(b)9.7,(c)13.0,(d)16.2,(e)19.5
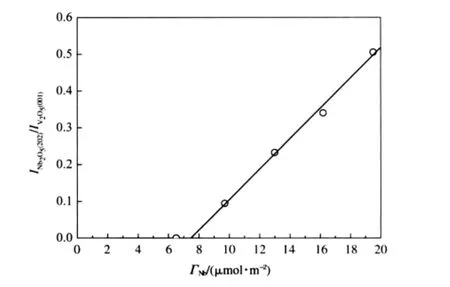
圖2 Nb2O5/γ-Al2O3催化劑XRD定量分析結果Fig.2 XRD quantitative phase analysis result for Nb2O5/γ-Al2O3catalysts
研究氧化物與載體之間的相互作用,載體表面結構是一個不可或缺的重要因素,嵌入模型[22]從載體的優先暴露晶面討論氧化物在載體上的分散.該模型認為,負載型離子化合物在載體表面上分散過程是其陽離子進入載體表面空位,相伴的陰離子定位其上以保持電中性.據此,離子型化合物在氧化物載體表面的分散容量與載體表面空位密切相關.
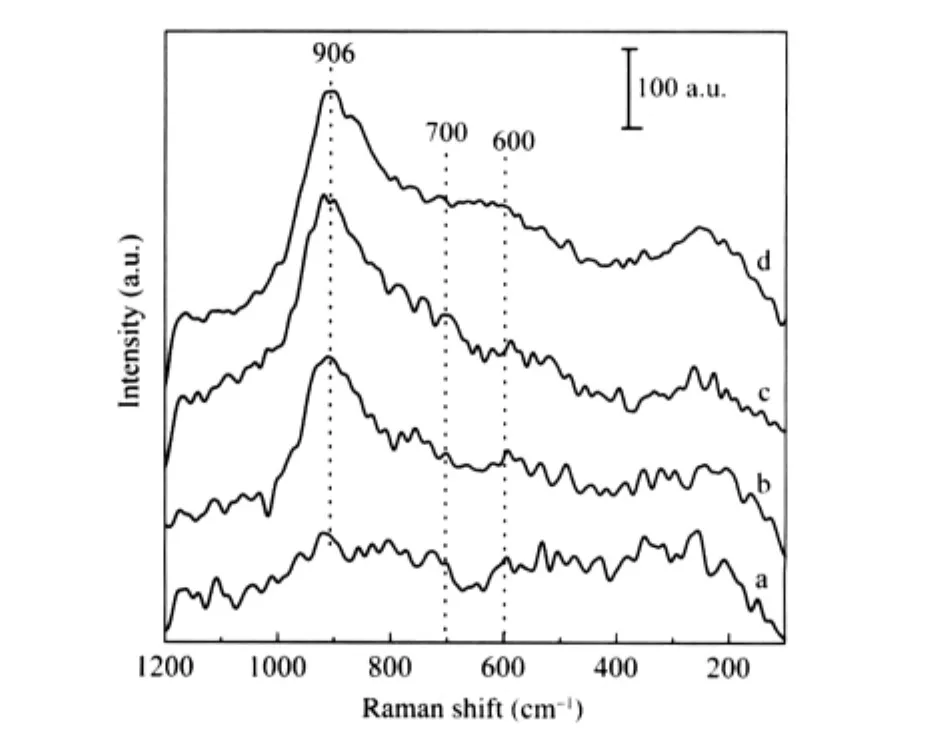
圖3 Nb2O5/γ-Al2O3催化劑的LRS譜Fig.3 LRS of Nb2O5/γ-Al2O3samples with different Nb2O5loadingΓNb/(μmol·m-2):(a)1.7,(b)3.6,(c)5.7,(d)8.1
γ-Al2O3具有缺陷尖晶石結構[23],屬立方晶系.在每一個單胞中含有32個O原子和64/3個Al原子,其中Al原子占據著四面體和八面體位置. Jimenez-Conzalez等[24]的研究表明,γ-Al2O3表面主要(約90%)呈(110)面取向.該面有兩層結構:C層和D層,其離子排列方式示于圖4.Schuit等[25]認為C層和D層所占比例相等.C層單位網格中有2個八面體(Oct.)空位和6個四面體(Tet.)空位,而D層單位網格中有2個八面體空位和8個四面體空位.按Al3+半徑0.055 nm和O2-半徑0.14 nm[26]可計算出γ-Al2O3的C層和D層結構中空位密度分別為31.2和 34.2 μmol·m-2.其中,八面體空位密度均為7.5 μmol·m-2.由于該載體表面存在四面體與八面體兩種空位,半徑大小不同的陽離子分散組分的嵌入存在著擇位問題.已經發現,分散的金屬陽離子優先占據γ-Al2O3表面的四面體空位還是八面體空位與被分散的金屬氧化物的性質和負載量以及樣品的焙燒溫度有關[27].圖3結果表明,NbOx氧物種在γ-Al2O3表面呈六配位的八面體結構,可以認為Nb5+進入八面體空位而形成具有八面體結構的NbOx物種.根據“嵌入模型”,在γ-Al2O3的C層與D層每嵌入1個Nb5+離子,將有2.5個O2-離子以保持電中性,當所有可用的八面體空位都被Nb5+離子占據后,覆蓋O2-離子形成密置單層,如圖4所示.據此可以估算出Nb在γ-Al2O3表面的分散容量為7.5 μmol·m-2,與實測值甚為一致.
為探討Nb2O5/γ-Al2O3催化劑NbOx物種所處狀態與催化性能的關系,以 IB與IBA縮合生成DMHD反應為探針,研究不同負載量的Nb2O5/γ-Al2O3催化劑對IB與IBA縮合反應催化性能.由于晶相Nb2O5表面幾乎不具有酸性,在制備Nb2O5/γ-Al2O3系列催化劑,將焙燒溫度控制在773 K,焙燒時間控制在6 h,以保證負載量超過單層分散容量時的Nb2O5在γ-Al2O3載體表面處于無定型狀態.
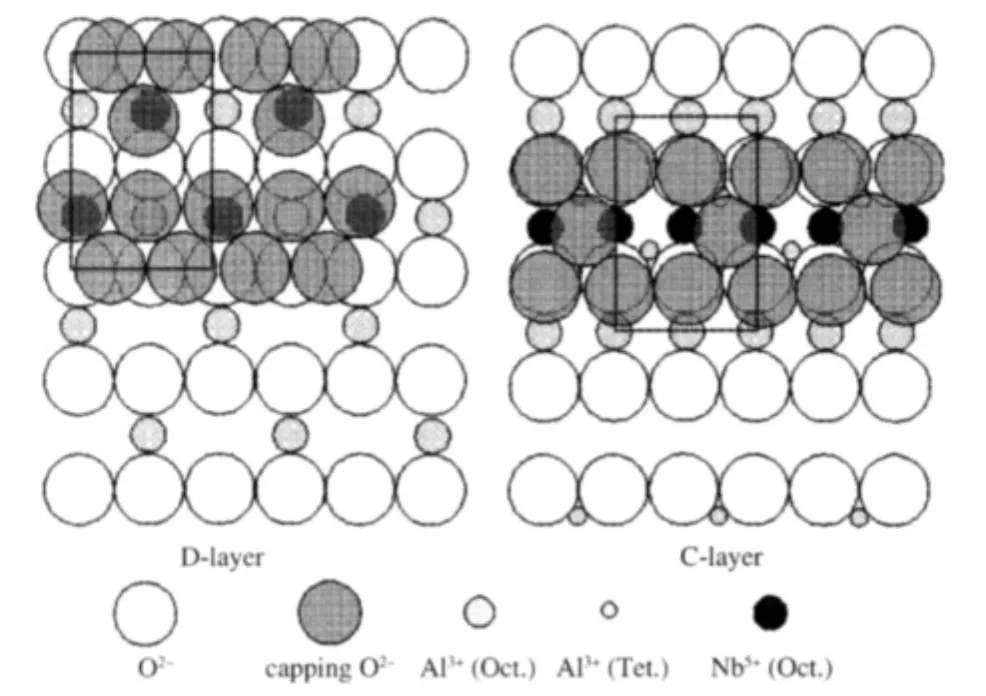
圖4 Nb2O5在γ-Al2O3的(110)面上分散的示意圖Fig.4 Schematic structure of the dispersed Nb2O5on γ-Al2O3(110)
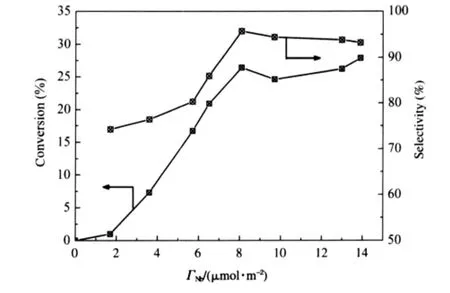
圖5 Nb2O5/γ-Al2O3催化劑的IB與IBA縮合生成DMHD的催化性能Fig.5 Catalytic acitivity of Nb2O5/γ-Al2O3catalysts for condensation reaction of IB and IBA to DMHD
載體γ-Al2O3對IB與IBA縮合反應幾乎不具有催化活性,而晶相Nb2O5雖有一定催化活性但反應物IBA的轉化率(10.0%)和產物DMHD的選擇性(51.4%)均明顯偏低,而在無定型形態的鈮酸上,IBA的轉化率和產物DMHD的選擇性分別為66.2%和86.8%,均比晶相Nb2O5的高得多.負載型Nb2O5/γ-Al2O3催化劑對IB與IBA縮合反應的催化活性和產物DMHD的選擇性與Nb2O5負載量密切相關,結果示于圖5.以催化劑單位時間每個Nb5+離子的DMHD產物收率估算催化活性(轉化頻率TOF),結果示于圖6.隨負載量的增加,TOF呈線性上升,當負載量超過單層分散容量時TOF值下降,這是催化劑表面NbOx物種利用率降低的結果.圖中還顯示,隨樣品中Nb的負載量不同,這種變化表現為兩條斜率不同的直線線形變化,兩線相交于7.5 μmol· m-2附近,與XRD測定和按嵌入模型所預測的Nb2O5在γ-Al2O3上的分散容量相近.
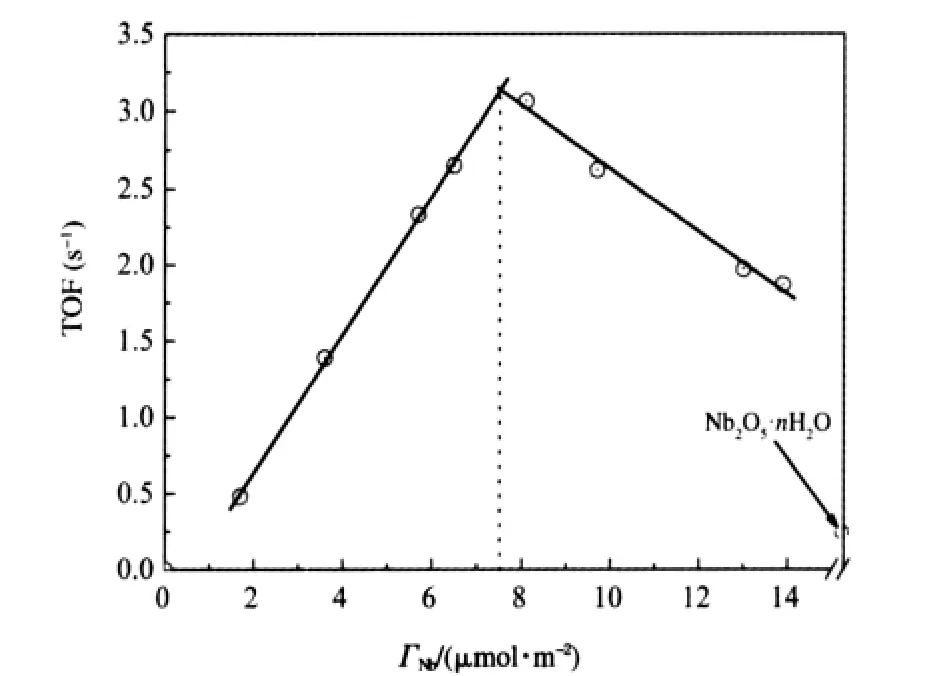
圖6 Nb2O5/γ-Al2O3催化劑上IB與IBA縮合成DMHD的TOF隨Nb2O5負載量的變化Fig.6 Turnover frequency(TOF)of DMHD from IB and IBA condensation on Nb2O5/γ-Al2O3catalysts with Nb2O5loading
IB與IBA縮合形成DMHD反應是一典型的酸催化反應[9,20,28].為考查負載量不同的Nb2O5/γ-Al2O3催化劑中表面NbOx物種酸催化性能的差異,測定了一系列催化劑樣品吸附吡啶后的紅外光譜(Py-IR),分別以1440-1460和1535-1550 cm-1特征吸收峰面積與樣品表面積之比表示L酸位和B酸位相對酸量,并以不同溫度下的酸量變化反映酸強度變化[20,28],結果示于圖7.從圖7可見,載體γ-Al2O3表面未觀察到B酸位,但具有最大的L酸位量.將Nb2O5分散到γ-Al2O3表面后,導致Nb2O5/γ-Al2O3樣品表面可檢測到的L酸位量下降,這可能是Nb5+填充到γ-Al2O3表面八面體空位的結果.在單層分散之前,樣品表面L酸位量隨著Nb2O5負載量的增加先下降而后增加.在單層分散后,樣品的表面酸特征由NbOx物種控制.Nb2O5負載到γ-Al2O3表面后在改變催化劑表面L酸位量的同時,在較高的負載量下形成了B酸位.Nb負載量為1.7 μmol·m-2的樣品未檢測到PyH+振動吸收峰,可以認為其表面B酸位量低于檢測范圍,負載量為3.6 μmol·m-2的樣品表面B酸位量很小,而負載量為5.7 μmol·m-2的樣品表面B酸位量明顯增加,此后,增加Nb2O5的負載量,表面B酸位量進一步增加.
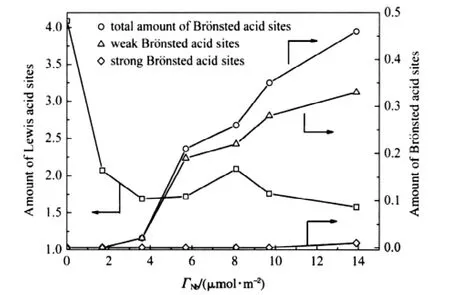
圖7 Nb2O5/γ-Al2O3催化劑表面酸特征與負載量的關系Fig.7 Acidity feature of the Nb2O5/γ-Al2O3catalyst with Nb2O5loading
從圖7還可見,Nb負載量為3.6 μmol·m-2的樣品表面只有強度較弱的B酸位.隨著負載量的增加,在B酸位濃度增加的同時強度增加,Nb負載量為13.9 μmol·m-2的樣品上出現了類似于鈮酸表面較強的B酸位.因此,Nb2O5/γ-Al2O3催化劑表面的B酸位量與Nb2O5在γ-Al2O3表面的分散狀態密切相關.
負載型氧化物催化劑表面的B酸位來自于其表面的可質子化羥基.Kataoka等[29]認為,表面羥基是否具有B酸酸性可通過其鍵強度大小來判斷,只有鍵強度在0.1-0.4 v.u.(valence unit)之間的羥基才有可能產生B酸性,鍵強度越接近于0.1 v.u.,B酸酸性越強.在負載型Nb2O5/γ-Al2O3催化劑表面存在著Al—OH、Nb—OH端羥基和Al—OH—Al、Nb—OH—Al、Nb—OH—Nb橋羥基[18,30-31].按Kataoka等方法計算,端羥基Al—OH和Nb—OH的鍵強度分別為1.50和1.17 v.u.,表明這些端羥基不具有B酸酸性.橋羥基Al—OH—Al、Nb—OH—Al和Nb—OH—Nb的鍵強度分別為1.0、0.67和0.33 v.u.,只有Nb—OH—Nb橋羥基的鍵強度在0.1-0.4 v.u.范圍,即在這些橋羥基中,只有Nb—OH—Nb橋羥基呈現明顯的B酸酸性,而Nb—OH—Al橋羥基幾乎不呈現B酸性,理論預測與實驗結果一致.這一結果表明,在Nb2O5/γ-Al2O3催化劑表面,B酸位由Nb—OH—Nb橋羥基產生.在低負載量下,Nb2O5在γ-Al2O3表面以孤立的NbOx物種形式存在,與表面形成Nb—O—Al鍵,因而沒有可觀測到的B酸位.隨著Nb2O5負載量增加,相鄰的Nb—O—Al鍵間形成Nb—O—Nb鍵,從而在催化劑表面形成了B酸位.結果表明,當負載量增加到一定值時,載體γ-Al2O3表面孤立的NbOx物種結合形成了聚集態NbOx的物種,即形成Nb—O—Nb鍵,這一值即為表面B酸位形成的閾值,超過這一閾值表面出現了可觀測量的B酸位,并且B酸位量隨Nb2O5負載量的增加,表面NbOx物種聚集程度增加,B酸量增加,同時B酸位強度增強.在單層分散容量以上,NbOx物種聚集體向三維方向增長,形成了多層Nb—O—Nb鍵結構,結果每一個Nb原子周圍的Nb原子數增加,有利于B酸位的形成,表面B酸位增加,強度增強,并出現了較強的B酸位,具有無定型體相結構的鈮酸(Nb2O5·nH2O)具有最大的表面B酸位量和最強的B酸強度.
IB與IBA縮合生成DMHD的反應是B酸催化反應[20,28],催化劑表面B酸位量與催化活性呈現良好的相關性,通過比較圖5與圖7結果可以看出這一相關性,即在Nb2O5/γ-Al2O3催化劑上,隨著Nb2O5負載量的增加,表面Nb—O—Nb物種增加,表面B酸位量增加,導致IB與IBA反應生成DMHD的TOF值增加.在單層分散容量以上,由于表面形成了較強的B酸位,使DMHD的選擇性降低.我們認為,在IB與IBA縮合生成DMHD的反應中,聚集狀態NbOx物種形成的Nb—OH—Nb橋羥基比孤立的NbOx物種形成的Nb—OH—Al橋羥基具有更高的催化活性.
3 結 論
(1)由XRD定量分析方法測得Nb在γ-Al2O3表面的單層分散容量為7.6 μmol·m-2,與“嵌入模型”按Nb5+離子進入γ-Al2O3優先暴露面(110)面C層和D層的八面體空位估算值7.5 μmol·m-2一致.
(2)當Nb2O5的負載量遠低于其分散容量時,高度分散于γ-Al2O3表面八面體空位的NbOx物種主要通過Nb—O—Al鍵與γ-Al2O3表面連接,隨著負載量的增加,孤立的NbOx物種傾向于與近鄰的NbOx通過Nb—O—Nb鍵相連而聚合.當Nb2O5的負載量超過其單層分散容量,表面NbOx物種通過Nb—O—Nb鍵聚合形成三維聚集態NbOx物種結構.
(3)Nb2O5/γ-Al2O3催化劑表面的B酸位特征與載體表面NbOx物種聚集狀態密切相關.只有聚集狀態的NbOx物種形成的Nb—OH—Nb橋羥基才呈現明顯的B酸酸性.隨著負載量增加,NbOx物種聚合度增大,更多的Nb—O—Al鍵轉化為Nb—O—Nb鍵,表面B酸酸量增加,強度增強,IB與IBA縮合形成DMHD轉化頻率(TOF)增加.
(4)當Nb2O5的負載量超過其單層分散容量,其中只有部分NbOx物種位于表面,與二維NbOx物種相比較其表面利用率下降,Nb2O5/γ-Al2O3催化劑活性(TOF)下降,同時表面出現較強的B酸位,導致DMHD的選擇性降低.
1 Izabela,N.;Maria,Z.Chem.Rev.,1999,99:3603
2 Ziolek,M.Catal.Today,2003,78:47
3 Tanabe,K.Catal.Today,2003,78:65
4 Ding,Q.P.;Yuan,Y.P.;Xiong,X.;Li,R.P.;Huang,H.B.;Li,Z. S.;Yu,T.;Zou,Z.G.;Yang,S.G.J.Phys.Chem.C,2008,112: 18846
5 Jang,J.S.;Kim,H.G.;Reddy,V.R.;Bae,S.W.;Ji,S.M.;Lee,J. S.J.Catal.,2005,231:213
6 Abdel-Rehim,M.;Santos,A.C.B.;Camorim,V.L.L.;Faro Jr.,A. C.Appl.Catal.A-Gen.,2006,305:211
7 Onfroy,T.;Manoilova,O.V.;Bukallah,S.B.;Hercules,D.M.; Clet,G.;Houalla,M.Appl.Catal.A-Gen.,2007,316:184
8 Braga,V.S.;Dias,J.A.;Dias,S.C.L.;Macedo,J.L.Chem. Mater.,2005,17:690
9 He,J.;Fan,Y.N.;Qiu,J.H.;Chen,Y.Acta Chim.Sin.,2004,62: 1311 [何 杰,范以寧,邱金恒,陳 懿.化學學報,2004,62: 1311]
10 Onfroy,T.;Clet,G.;Houalla,M.J.Phys.Chem.B,2005,109: 14588
11 Sumiya,S.;Oumi,Y.;Sadakane,M.;Sano,T.Appl.Catal.A-Gen., 2009,365:261
12 Chary,K.V.R.;Srikanth,C.S.;Rao,V.V.Catal.Commun., 2009,10:459
13 Carreon,M.A.;Guliants,V.V.;Guerrero-Perez,M.O.;Ba?ares, M.A.Catal.Commun.,2009,10:416
14 Martos,M.;Julián,B.;Dehouli,H.;Gourier,D.;Cordoncillo,E.; Escribano,P.J.Solid State Chem.,2007,180:679
15 Guerrero-Pérez,M.O.;Ba?ares,M.A.Catal.Today,2009,142: 245
16 Tanabe,K.;Okazaki,S.Appl.Catal.A-Gen.,1995,133:191
17 Okuhara,T.Chem.Rev.,2002,102:3641
18 Burcham,L.J.;Datka,J.;Wachs,I.E.J.Phys.Chem.B,1999, 103:6015
19 Carniti,P.;Gervasini,A.;Marzo,M.J.Phys.Chem.C,2008,112: 14064
20 He,J.;Fang,Y.N.;Qiu,J.H.Acta Petrolei Sinica(Petroleum Processing Scetion),2006,22:18 [何 杰,范以寧,邱金恒.石油學報(石油加工),2006,22:18]
21 Jehng,J.M.;Wachs,I.E.J.Phys.Chem.,1991,95:7373
22 Dong,L.;Chen,Y.Chin.J.Inorg.Chem.,2000,16:250 [董 林,陳 懿.無機化學學報,2000,16:250]
23 Chen,Y.;Zhang,L.F.Catal.Lett.,1992,12:51
24 Jimenez-Conzalez,J.;Schmeiber,D.Surf.Sci.,1991,250:59
25 Schuit,G.A.;Gates,B.C.AIChE J.,1973,19:417
26 Zhang,X.Y.Handbook of applied chemistry.Beijing:National Defense Industry Press,1988:25 [張向宇.應用化學手冊.北京:國防工業出版社,1988:25]
27 Xia,W.S.;Chen,Y.;Wan,H.L.J.Mol.Catal.A-Chem.,1999, 138:185
28 He,J.;Fan,Y.N.;Qiu,J.H.;Chen,Y.Chin.J.Inorg.Chem., 2004,20:789 [何 杰,范以寧,邱金恒,陳 懿.無機化學學報,2004,20:789]
29 Kataoka,T.;Dumesic,J.A.J.Catal.,1988,112:66
30 Bernholc,J.;Horsley,J.A.;Murrell,L.L.;Sherman,L.G.;Soled, S.J.Phys.Chem.,1987,91:1526
31 Turek,A.M.;Wachs,I.E.;DeCanio,E.J.Phys.Chem.,1992,96: 5000
August 28,2009;Revised:December 3,2009;Published on Web:January 4,2010.
Dispersion and Acidity of Niobia on Nb2O5/γ-Al2O3
HE Jie1,2,*FAN Yi-Ning2
(1School of Chemical Engineering,Anhui University of Science and Technology,Huainan 232001,Anhui Province,P.R.China;2Key Laboratory of Mesoscopic Chemistry of the Ministry of Education,School of Chemistry and Chemical Engineering, Nanjing University,Nanjing 210093,P.R.China)
Supported niobium pentoxide materials are effective catalysts for a variety of reactions.Nb2O5/γ-Al2O3catalysts with different Nb2O5loadings were prepared by aqueous solution impregnation using niobium oxalate as a precursor on γ-Al2O3.The samples were characterized with respect to the dispersion state of the niobium oxide species on γ-Al2O3by X-ray power diffraction(XRD)and laser Raman spectroscopy(LRS).The nature of the surface acidity was investigated using Fourier-transform infrared spectroscopy of pyridine adsorption(Py-IR).The catalytic activity of the as-prepared catalysts was evaluated by the condensation reaction of iso-butene(IB)and iso-butyraldehyde(IBA)to form 2,5-dimethyl-2,4-hexadiene(DMHD).Results reveal that the dispersion capacity(ΓNb)of Nb on γ-Al2O3is about 7.6 μmol·m-2.This value is almost identical to the density of the octahedral vacant sites of the preferentially exposed (110)plane(7.5 μmol·m-2)on the surface of the γ-Al2O3support.Additionally,the“incorporated model”suggests that Nb5+cations are located on the vacant sites of the(110)plane on γ-Al2O3.These results suggest that isolated niobia (NbOx)species are present and are bound to the surface of the γ-Al2O3support through Nb—O—Al bonds at a loading well below that corresponding to monolayer dispersion.This is consistent with the result from LRS.The formation of isolated NbOxspecies,which binds to the surface of the support through Nb—O—Al bonds,causes a decrease in the amount of surface Lewis acid sites(LAS)on the Nb2O5/γ-Al2O3catalysts.With an increase in Nb2O5loading,polymeric NbOxspecies are formed by the Nb—O—Nb bridging of neighboring isolated NbOxspecies and Br?nsted acid sites(BAS)are generated.We found that the catalytic activity towards the condensation reaction of IB and IBA to form DMHD increased because the amount and strength of the Br?nsted acid sites increased as the number of polymeric niobia species increased.When the loading exceeds the monolayer dispersion capacity,the catalytic activity(turnoverfrequency(TOF)ofDMHD)decreasedbecause of the formation of the three-dimensional NbOxspecies. Additionally,the selectivity of DMHD decreased because of an increase in the strength of the Br?nsted acid sites.We suggest that the strength of the Br?nsted acid sites are related to the state of NbOxon the surface of the Nb2O5/γ-Al2O3catalysts.
Surface acidity; Nb2O5/γ-Al2O3; NbOxsurface species; Olefin-aldehyde condensation
[Article] www.whxb.pku.edu.cn
*Corresponding author.Email:jhe@aust.edu.cn;Tel:+86-554-6668497.
The project was supported by the National Key Basic Research Program of China(G1999022400).
國家重點基礎研究發展計劃(G1999022400)資助項目
O643

