腫瘤乏氧顯像劑18F-FAZA的自動化合成
劉振鋒,趙 葵,董孟杰,王國林,楊樹業
浙江大學醫學院附屬第一醫院PET中心,浙江杭州 310003
腫瘤乏氧顯像劑18F-FAZA的自動化合成
劉振鋒,趙 葵,董孟杰*,王國林,楊樹業
浙江大學醫學院附屬第一醫院PET中心,浙江杭州 310003
為了制備1-α-D-[5’-脫氧-5’-氟阿拉伯呋喃糖基]-2-硝基咪唑(18FAZA),采用兩鍋法與氟多功能模塊,以4~6 mg前體在115℃氟化反應10 min,用C-18柱捕獲中間產物,用NaOH水解,HCl中和,進行HPLC分離,得到18FAZA注射液體。總合成時間45 min,放化產率和放射化學純度分別大于10%與98%。采用兩鍋法自動合成18F-FAZA,能夠滿足科研與臨床研究的需要。
乏氧;18F-FAZA;PET顯像
多數惡性腫瘤組織實質生長迅速,間質生長相對緩慢,導致腫瘤局部血供與需求失衡,發生缺氧;另外,惡性腫瘤代謝旺盛,消耗大量的氧,導致供血不足,使腫瘤局部處于乏氧狀態。分子生物學研究發現,乏氧不僅使腫瘤產生針對放、化療的保護蛋白,增加對放、化療的抵抗性,而且使腫瘤內氧調節蛋白(ORP)、血管內皮生長因子(VEGF)等表達增加,從而使腫瘤自身的侵襲性也增加。腫瘤組織的乏氧程度決定了腫瘤對放療或化療的敏感程度,采用乏氧顯像劑,進行 PET顯像,可以了解腫瘤的乏氧程度,并勾畫生物靶區,制訂最有效的放化療方案。1-α-D-[5’-脫氧-5’-氟阿拉伯呋喃糖基]-2-硝基咪唑(18FAZA)顯像劑[1-2]與18F-FMISO[3]相比,具有更快的血液與非靶組織清除率,18F-FMISO主要通過肝臟代謝,而18FAZA則主要經腎臟排泄,腸道內無放射性,腹部腫瘤18F-FAZA圖像應優于18F-MISO[4]。
Kumar等[5]對微波輔助下18FAZA的放射性制備做了初步研究,對放射標記中的反應時間、反應條件進行了探索,發現應用微波技術標記比常規放射性標記的標記率要高。Reischl等[6]對18FAZA應用一鍋法進行了18FAZA的自動化合成,標記溫度為100℃,標記時間為5 min,產率為20%。18FAZA在國外已經被合成并應用到多種腫瘤的調強放療中,國內尚未見到這方面的報道。應用一鍋法合成18FAZA,由于反應成分復雜,會影響合成的重復性與產品的純度。本研究應用氟多功能模塊,采用兩鍋法,先用C-18柱對氟標記的中間體進行提純,再對其進行堿水解,自動化合成18FAZA,以改善合成的重復性與產品純度。
1 實驗材料
1.1 試劑和儀器
H218O,豐度95%,美國 Isotec公司;4,7,13,16,21,24-六氧雜-1,10二氮雙環[8,8,8]二十六烷(K222),分析純,德國 ABX公司;NaOH、HCl,分析純,乙醇為 HPLC級,北京化工廠;二甲基亞砜(DMSO)、絕對無水乙腈,比利時Acros公司;硅膠板 ,英國 Whatman 公司;1-α-D-[5’-O-對甲苯磺酰基-2’、3’乙酰阿拉伯呋喃糖基]-2-硝基咪唑 ,德國 ABX公司;1-α-D-[5’-脫氧-5’-氟阿拉伯呋喃糖基]-2-硝基咪唑,德國ABX公司;Sep-Pak QMA柱,C18 Sep-Pak柱,美國Waters公司。
RDS111加速器,美國CTI公司;雙反應管18F多功能化學合成單元(chemistry process control unit,CPCU),北京派特生物有限公司;活度計,美國Bioscan公司;Aligent 1200高效液相色譜、G1311A四元泵、G1316A柱溫箱、G1314BVWD檢測器、G1328B手動進樣器、Flow-Count放射性檢測器(BioScan),分析柱為 Agilent eclipse SB-C18(5μm,4.6 mm×150 mm),美國Aligent公司。
1.2 實驗動物
KM小鼠,雌雄各半,體重18~22 g,浙江省醫學科學院動物中心提供。
2 實驗方法
2.1 合成路線
18FAZA的合成路線示于圖1。

圖1 18FAZA的放射化學合成路線Fig.1 Radiosynthesis of18FAZA
2.2 18F-F-的生產
采用RDS111醫用回旋加速器通過18O(p,n)18F核反應,用11 MeV、35μA的質子束流連續轟擊靶15 min,用氣動方式將18F-F-傳輸到氟多功能合成模塊(圖2)中,18F-F-被吸附到Sep-Pak light QMA柱上,等待被淋入反應管中。
2.3 18FAZA的自動化合成
用氟多功能合成模塊進行18FAZA的放射化學合成,具體標記操作如下:
(1)加速器生產的18F被QMA柱捕獲;
(2)用1號瓶中的1 mL溶液(12.5 mg K222加2.5 mg K2CO3溶于0.1 mL水和0.9 mL乙腈的混合溶液)將18F淋洗到反應管中;
(3)將反應管中的溶液于116℃氮氣吹干;
(4)反應管中加入2號瓶中2 mL干燥乙腈,于116℃氮氣吹干;
(5)反應管中加入3號瓶中5 mg FAZA前體和0.8 mL干燥DMSO,于115℃反應10 min;
(6)反應管中分3次加入5號瓶30 mL水,將混合液體通過V1與V2閥門之間的C-18柱,標記中間體被捕獲在C-18柱上;
(7)反應管中加入2 mL乙醇溶液,將C-18柱上的標記物從反應管1轉移到反應管2中;
(8)將反應管2中溶液于120℃氮氣吹干;
(9)加入6號瓶中1 mL 0.5 mol/L的NaOH溶液水解2 min;
(10)加入7號瓶中1 mL 0.5 mol/L的 HCl溶液中和;
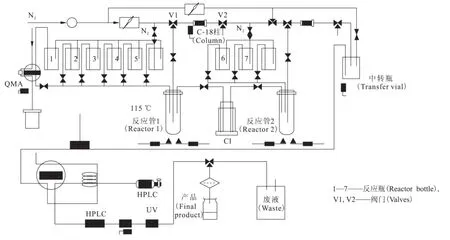
圖2 18FAZA的自動合成裝置示意圖Fig.2 Scheme of disposable cassette of18FAZA
(11)將粗產物轉移到中轉瓶中,啟動 HPLC純化,Alltima C18柱(250 mm×10.0 mm,10μm);流動相為V(乙醇) ∶V(水)=8∶92;流速4 mL/min。
2.4 產品的質量控制
用精密p H試紙測定注射液的p H值,目測其顏色和澄清度;取即時制備的18FAZA注射液,用活度計測定不同時間點的活度值,用半對數作圖法估測半衰期和核純度;用 HPLC系統與標準品對照鑒定產品,并用其與 TLC測定注射液的放射化學純度。HPLC分析條件:C-18分析柱,流動相為10%的乙醇溶液,流速為1 mL/min,紫外(UV)檢測波長為320 nm;在室溫下,測定注射液在8 h內不同時間的放化純度,觀測其穩定性;TLC的條件為V(乙酸乙酯)∶V(乙醇)=9∶1。
2.5 產物的體外穩定性評價
將所制備的18FAZA稀釋到37 GBq/L,取0.2 mL,加入到1 mL的小牛血清中,在37℃溫育,每隔2 h應用 TLC測量產物的放射化學純度,觀察8 h后穩定性,TLC的展開劑為V(乙酸乙酯)∶V(乙醇)=9∶1。
2.6 18FAZA的異常毒性實驗
KM小鼠(體重18~22 g,給藥前未禁食禁水)5只,尾靜脈注射18FAZA的注射液3.7×106Bq(0.5 mL),觀察48 h后處死并解剖。
3 結果和討論
3.1 18FAZA的合成
通過國產多功能模塊進行乏氧顯像劑18FFAZA藥物的自動化合成,總合成時間小于45 min,由于前體比較昂貴,選用少量的前體4~6 mg,不校正產率可大于10%(n=10),應用制備型的 HPLC分離18FAZA,18FAZA的 HPLC的保留時間為12 min,隨著前體用量的增加,產率也增加(表1),當前體量為15 mg時,不校正產率可以達到25%;用干燥的乙腈做溶劑,在密閉條件下120℃反應10 min,產率只有1%,可能是溶劑內部溫度不如DMSO高的原因,用 HPLC級的DMSO進行反應,沒有產物,原因是反應必須在無水條件下進行,水參與競爭反應,因而得不到產物。與 Reischl等[6]采用一鍋法合成比較,本合成中采用兩鍋法合成18FAZA,可以先將親核標記生成的中間體,初步捕獲到C-18柱上,除去 K222、DMSO、K2CO3等雜質,消除這些雜質對下一步中間體進行堿性水解的干擾,有效地提高了反應的重復性,同時也使得最終產品經 HPLC提純更方便,純化后化學純度與放射化學純度更高。如果不用 HPLC分離提純,而采用固相萃取技術對產物進行快速的分離提純,合成時間將會大大縮短,合成產率將得到進一步的提高,我們正在進行這方面的探索。
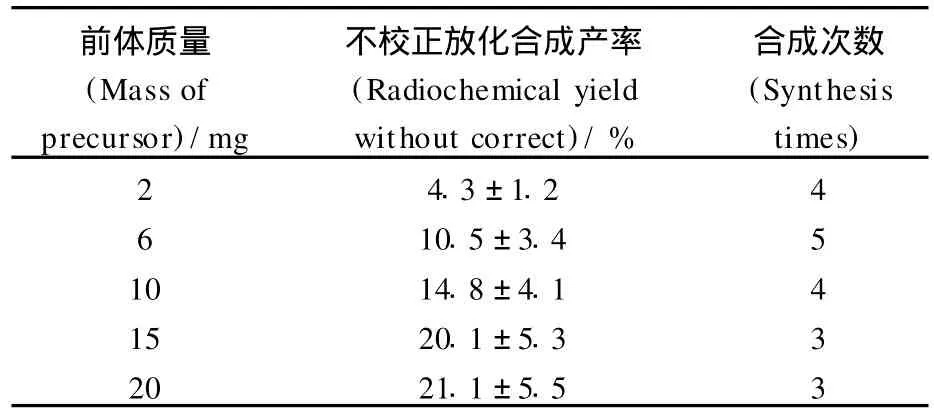
表1 前體用量對不校正放化合成產率的影響Table 1 Radiochemical yield dependence on the amount of precursor without correct
3.2 18FAZA的質量控制與穩定性
18FAZA注射液為無色溶液,p H≈7.0,放射性濃度大于74 GBq/L,比活度不小于7.4×1010kBq/mol。用時間衰變法測定18F半衰期約為110 min,放射性核純度大于99%。HPLC鑒定測量結果示于圖3。由圖3看出,參比FAZA標準品的紫外吸收峰(320 nm)與18FAZA放射性峰(tR=7.6 min)一致,為同一物質(由于物質先經過紫外檢測器,后經放射性檢測器,兩者之間管線體積為0.3 mL,所以放射性tR比紫外tR時間滯留0.3 s)。18FAZA的 HPLC與放射性 TLC譜圖(圖4)顯示放射化學純度大于98%,TLC圖譜中18FAZA的Rf=0.75,未標記的18F的Rf=0。18FAZA在小牛血清中8 h后,放射化學純度仍然大于96%,穩定性良好。
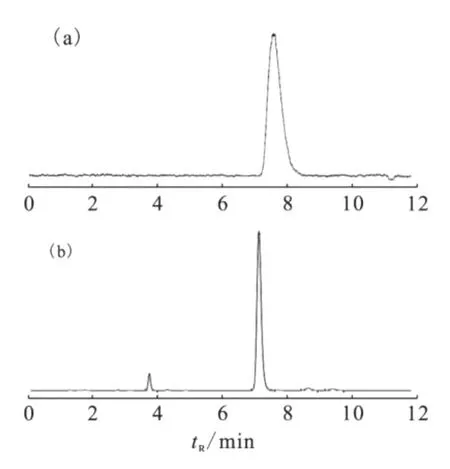
圖3 FAZA的HPLC譜圖Fig.3 HPLC of FAZA
3.3 異常毒性檢查
尾靜脈給予18FAZA注射液后,觀察48 h,小鼠生長正常,無死亡及不良反應現象發生,解剖后觀察,未見任何器官損傷。
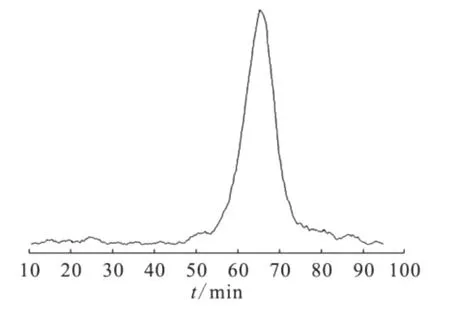
圖4 18FAZA的TLC譜圖Fig.4 TLC chromatogram of18FAZA
4 結 論
應用兩鍋法,通過氟多功能模塊進行乏氧顯像劑18F-FAZA藥物的自動化合成,總合成時間小于45 min,放化產率和放射化學純度分別大于10%與98%,藥物的體外穩定性良好,急毒性實驗顯示藥品安全,利用該法自動合成的18FAZA注射液能滿足科研和臨床PET顯像的需要。
[1]Piert M,Machala H J,Picchio M,et al.Hypoxia-Specific Tumor Imaging With18F-Fluoroazomycin Arabinoside[J].J Nucl Med,2005,46(1):106-113.
[2]Piert M,Machulla H-J,Kumar P,et al.18F Labeled Fluoroazomycinarabinoside(FAZA):A Novel Marker of Tumor Tissue Hypoxia[J].J Nucl Med,2001,42:1 091-1 100.
[3]Yeh S H,Liu R S,Wu L C,et al.Fluorine-18 Fluoromisonidazole Tumour to Muscle Retention Ratio for the Detection of Hypoxia in Nasopharyngeal Carcinoma[J].Eur J Nucl Med,1996,23:1 378-1 383.
[4]Sorger D,Patt M,Kumar P,et al.[18F]Fluoroazomycinarabinofuranoside(18FAZA)and[18F]Fluoromisonidazole(18FMISO):A Comparative Study of Their Selective Uptake in Hypoxic Cells and PET Imaging in Experimental Rat Tumors[J].Nucl Med Biol,2003,30:317-326.
[5]Kumar P,Wiebe L I,Asikoglu M,et al.Microwave-Assisted(Radio)Halogenation of Nitroimidazole-Based Hypoxia Markers[J].Appl Radiat Isot,2002,57:697-703.
[6]Reischl G,Ehrlichmann W,Bieg C,et al.Preparation of the Hypoxia Imaging PET Tracer[18F]FAZA:Reaction Parameters and Automation[J].Appl Radiat Isot,2005,62:897-901.
Automated Synthesis of18F-Labelled FAZA as Hypoxia Imaging Agent
LIU Zhen-feng,ZHAO Kui,DON G Meng-jie*,WANG Guo-lin,YANG Shu-ye
PET Center,the First Affiliated Hospital,College of Medicine,Zhejiang University,Hangzhou 310003,China
1-(5-[18F]fluoro-5-deoxy-α-D-arabinofuranosyl)-2-nitroimidazole was synthesized by“two pot”method at a multifunctional CPCU made in China and by using 1-(2,3-di-O-acetyl-5-O-tosyl-α-D-arabinofuranosyl)-2-nitroimidazole as precursor.The precursor(4-6 mg)was fluorinated at 115℃for 10 min.The F-18 labeled intermediate was traped by a C-18 column,then was hydrolyzed using NaOH.The reaction mixture was neutralized by adding HCl,and was purified through HPLC.The pure18FAZA is obtained for no more than 45 min.The overall radiochemical yield is more than 10%,and the radiopurity is higher than 98%.18FAZA is successfully autosynthesized through“two pot”method.It can be used in clinical and scientific research.
hypoxia;18F-FAZA;positron emission tomography
R817.4
A
0253-9950(2011)03-0184-04
2010-09-02;
2010-12-16
國家自然科學基金資助項目(30870730);浙江省醫藥衛生基金資助項目(2007A063);浙江省科技廳基金資助項目(2009C33109)
劉振鋒(1980—),男,山東德州人,碩士,主管藥師,主要從事正電子藥物研發
*通信聯系人:董孟杰(1972—),男,山西萬榮人,博士,主治醫師,從事正電子藥物研發與臨床研究

