不同類型黃酒中雜醇油含量分析及其機制初探
夏小樂,朱小明,張斌,夏梅芳,楊海麟,趙慧,沈蒙蒙,王武
1(江南大學生物工程學院,工業生物技術教育部重點實驗室,江蘇無錫,214122)2(南通如皋白蒲水明樓黃酒有限公司,江蘇如皋,226500)
黃酒是中國獨有的酒種,按照含糖量多少和發酵工藝,可分為干型、半干型、半甜型、甜型[1]。它具有低酒精度、營養豐富等特點。
黃酒的傳統釀造是采用多菌種,邊糖化、邊發酵的三邊工藝,除產生乙醇、功能寡肽和大量各類香氣物質外,還會產生一些不利人體健康的物質,典型的如過量的雜醇油、甲醇、醛類和游離的嘌呤類物質等,這些有害物質在一定程度上影響了黃酒的飲用和發展。黃酒飲用后相較其他酒而言普遍反映有易上頭、易醉和嚴重的“后反功”,而造成黃酒上頭的主要物質是過量的雜醇油。雜醇油是一類高沸點的混合物,是淡黃色至棕褐色的透明液體,是3個碳以上的一元醇類物質的總稱,其主要成分是正丙醇、正丁醇、異丁醇、仲丁醇、戊醇、異戊醇、活性戊醇、辛醇、苯乙醇、色醇、酪醇等高級醇[2-3];它們在黃酒中普遍存在,其在黃酒中正常的生成和合理存在無疑對酒質呈香呈味有積極作用,但是過量就會影響酒質和對人體產生危害[7]。雜醇油生成機制被認為主要通過Ehlrich途徑和糖合成途徑形成中間產物α-酮基酸,繼而產生雜醇油[5]。國內外對雜醇油有較多報道,己經證實飲酒上頭與雜醇油含量直接相關,一些酒類標準也對雜醇油含量進行了限制[6]。
殷德榮等采用氣相色譜法測定紹興黃酒中正丙醇含量為 128.1 mg/L,異丁醇 118.7 mg/L,異戊醇284.5 mg/L[7]; 郭 翔 等[8]利 用 固 相 微 萃 取 技 術(SPME)結合GC-MS測定半干型黃酒中醇和酯,其中丙醇為3.3 ~16.3mg/L,異丁醇45.1 ~150.6 mg/L,異戊醇 162.3 ~295.5 mg/L;夏小樂等[9]等利用外標氣相色譜法測定了清爽型黃酒中的乙醛和雜醇油含量,乙醛含量達到40.5 mg/L,雜醇油達到38.3 mg/100mL。上述研究均未涉及黃酒類型和工藝間的差異,未能全面深入的對雜醇油的含量和生成因素進行分析。黃酒經過多年的發展,已存在多種類型、傳統工藝與現代工藝并存的格局,因此發酵周期和酵母生長繁殖存在較大差異,黃酒中的雜醇油含量和生成機制也各不相同[10]。
本研究建立了一種頂空進樣毛細管氣相色譜法測定黃酒中雜醇油的含量的方法,通過比較不同類型黃酒中雜醇油含量的差異,探討雜醇油生成機制和影響因素,對在生產中控制雜醇油的含量提供建議和思路。
1 材料和方法
1. 1 儀器與試劑
島津 GC2010氣相色譜儀,FID檢測器,DANI HSS86.50頂空進樣器;毛細管色譜柱:PEG-20(25 m ×0.53 mm ×1 μm),正丙醇、異丁醇、異戊醇均為色譜純(迪馬科技,China),其余試劑均為市售分析純。黃酒樣品均為超市購買,詳見表1。
1. 2 標準溶液配制
用6%的乙醇溶液分別配成濃度為2.0 g/L的正丙醇、異丁醇和異戊醇標準儲備溶液,儲存與4℃冰箱待稀釋用。準確移取上述標準儲備溶液至50 mL容量瓶中,用6%乙醇溶液定容,配制成正丙醇、異丁醇、異戊醇標準溶液濃度均為20.0 mg/L的標準溶液,置冰箱中保存備用。
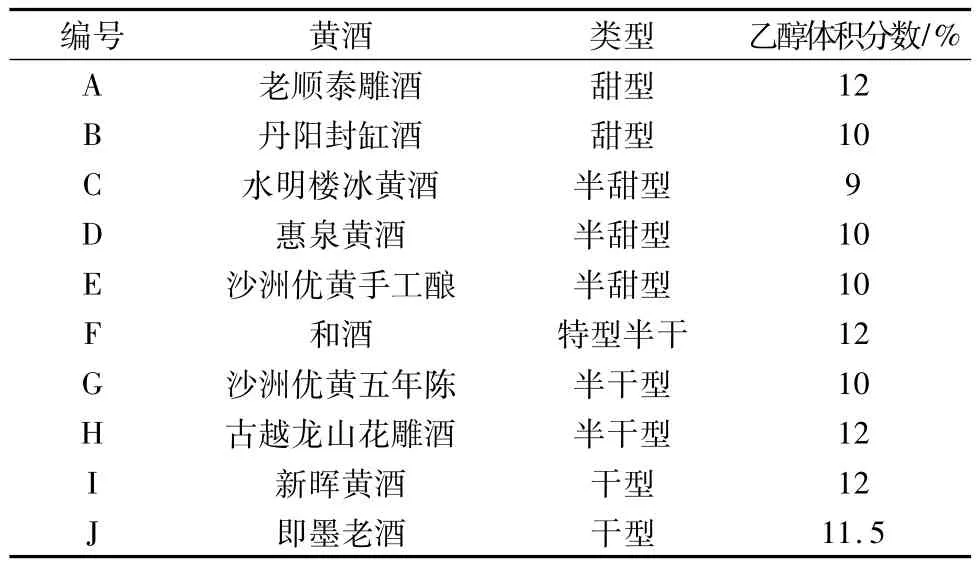
表1 黃酒樣品列表
1. 3 氣相色譜分析
1.3.1 氣相色譜測定條件
柱溫:起始40℃,保持5 min,再以10℃/min升溫至180℃,保持5 min。進樣口溫度:200℃;檢測器溫度:250℃;載氣為氮氣,流速1.5 mL/min(恒流);氫氣:30 mL/min;空氣300 mL/min;尾吹氣28.0 mL/min;頂空:70 ℃保持30 min,分流比1∶1,頂空進樣。
1.3.2 回歸方程和線性范圍
移取標準品50mL于容量瓶中,用6%乙醇溶液定容,配制成標準儲備液系列濃度為:20.0、50.0、100.0、200.0、400.0、500.0、1000.0mg/L。在上述色譜條件下依次測定,繪制標準曲線并得到回歸方程。
1.3.3 精密度和回收率
取一黃酒樣品于50 mL容量瓶中稀釋定容,在穩定的條件下按上述色譜條件測定其含量,平行實驗5次,計算平均值及相對標準偏差(RSD)。在黃酒樣品中加入一定量的標準品,然后進行加標回收率實驗,平行實驗5次。
1.3.4 黃酒樣品測定
將各黃酒樣品均稀釋到乙醇體積分數為6%,50mL容量瓶定容。將標準樣品和各酒樣通過0.45m濾膜過濾,然后分別取4 mL進行頂空進樣分析,重復3次。
2 結果與討論
2. 1 利用保留時間定性分析
通過外標法測定黃酒中雜醇油的含量,結果見圖1。各組分按出峰先后順序依次為乙酸乙酯、乙醇、正丙醇、異丁醇、異戊醇。在上述色譜分離條件下,按照國家相關標準,測定的雜醇油指標為正丙醇、異丁醇、異戊醇 3種,其保留時間分別為 7.563 min,8.779 min和11.111 min,各峰分離效果很好。圖2為黃酒樣品中各組分氣相色譜圖,對照標準色譜圖可知所要分析的3種高級醇均得到很好的分離。
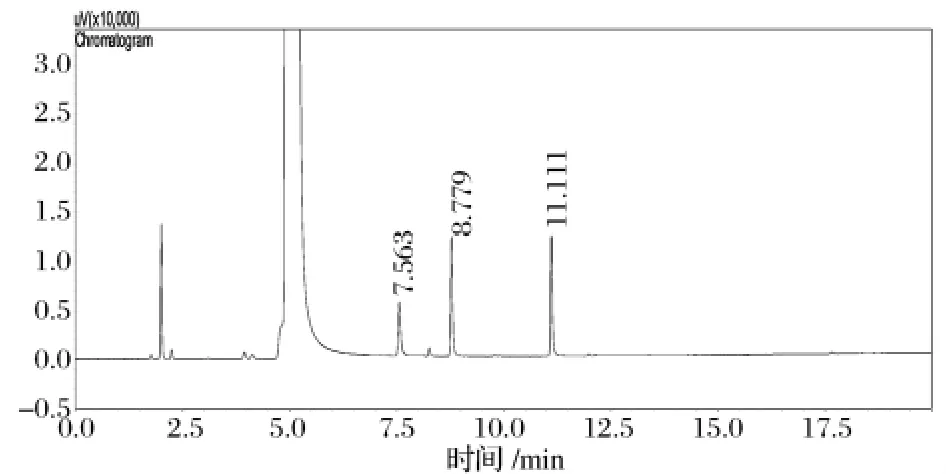
圖1 混合標樣色譜圖
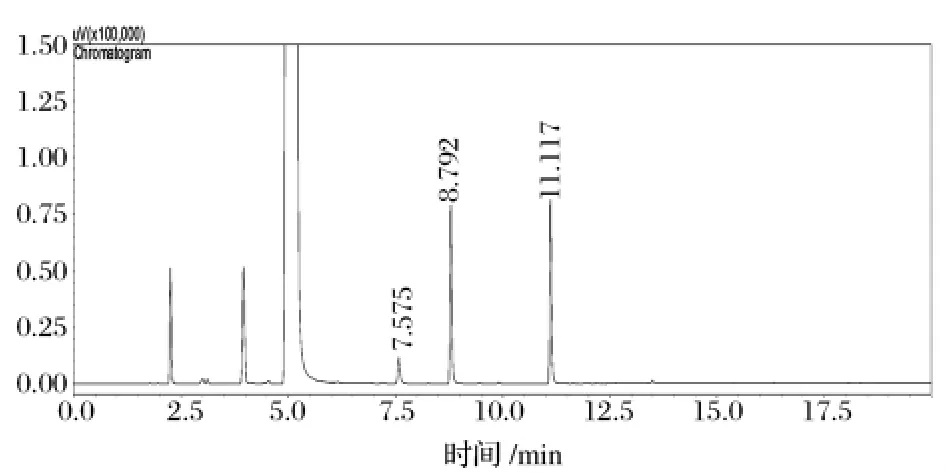
圖2 黃酒樣品色譜圖
2. 2 定量分析
2.2.1 回歸方程、線性范圍
在上述色譜條件下進行測定,得到標準曲線的回歸方程如表2所示,其中標準曲線中y為峰面積比(AP/AI),x為濃度比(CP/CI)。由表2中數據可以看出回歸方程相關系數均在0.995以上,相關性較好。
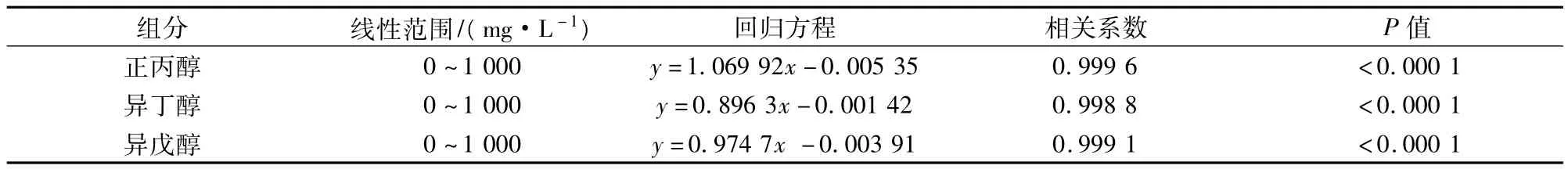
表1 雜醇油各組分的回歸方程、線性范圍
2.2.2 精密度和回收率
取一黃酒樣品50mL容量瓶稀釋定容,在穩定的條件下按上述色譜條件測定其含量,平行實驗5次,計算平均值及相對標準偏差(RSD)。如表2所示,RSD 在1.09% ~1.72%,結果良好。
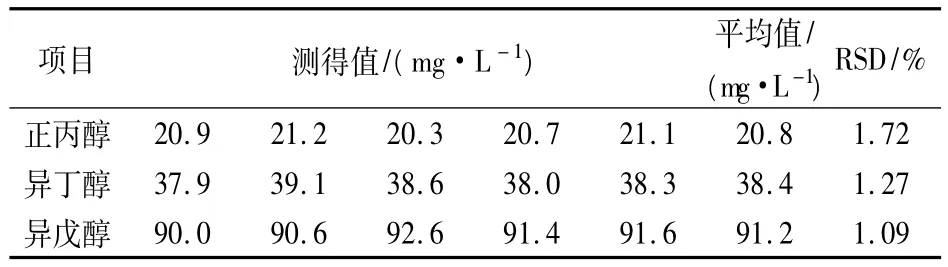
表2 分析方法的精密度檢驗(n=5)
在黃酒樣品中加入一定量的標準品,然后進行加標回收率實驗,平行實驗5次,結果如表3所示,本方法加標回收率均大于96%。綜合上述實驗,證明所建立的方法準確可靠。
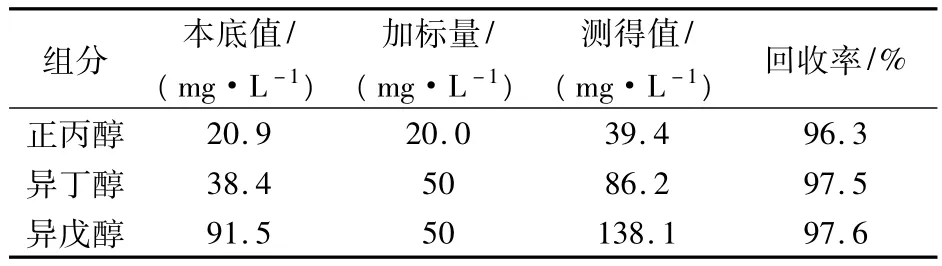
表3 黃酒樣品加標回收率
2. 3 酒樣測定
按上述方法,對市場上的10種黃酒中的雜醇油含量進行測定。如表4所示,檢測的10個黃酒樣品中,均呈現異戊醇>異丁醇>正丙醇,雜醇油的總含量差異明顯。以12%的體積分數計算,編號為J的雜醇油含量最低,為152.8mg/L,編號為A的雜醇油含量最高,為528.4mg/L,是黃酒J的3.45倍。如表4所示,雜醇油含量按黃酒類型,基本呈現出干型<半干型≈半甜型<甜型的現象,這說明黃酒工藝對于其雜醇油含量存在較大的影響。
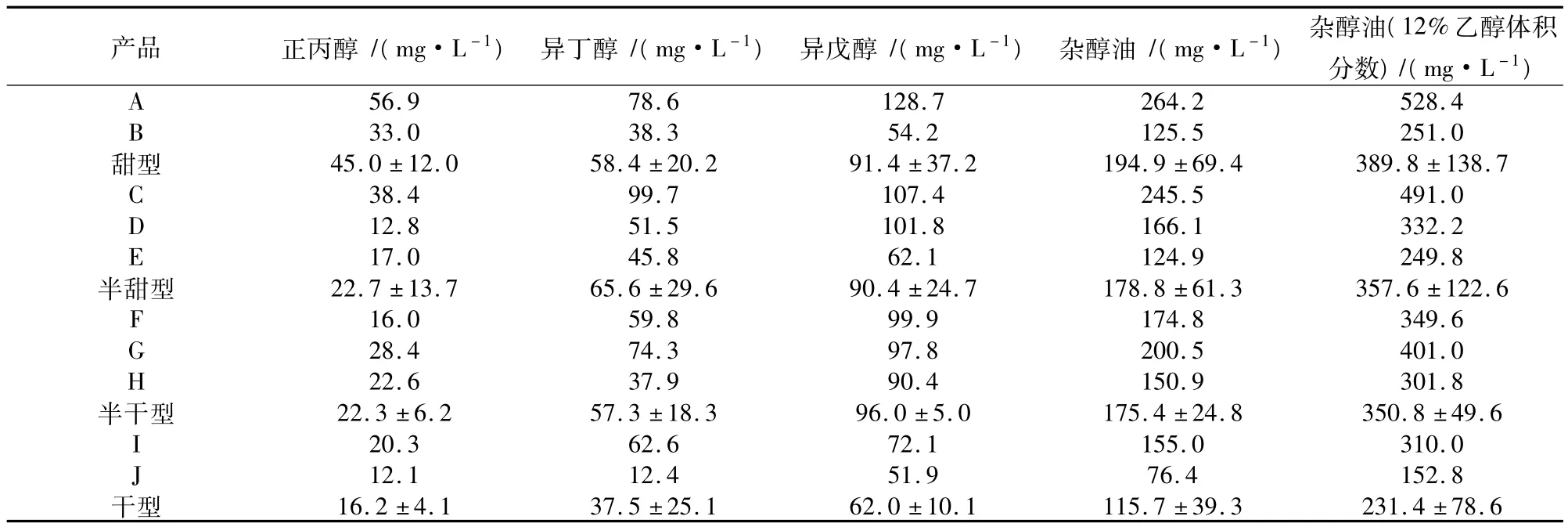
表4 黃酒樣品雜醇油檢測結果
一般認為,干型黃酒發酵醪液較稀,發酵溫度較低,開耙時間較短,酵母發酵繁殖較好,因此雜醇油含量較低。同時認為其酵母生長充分,殘糖較低,因此雜醇油可能主要通過糖合成途徑生成。甜型黃酒則剛好相反,發酵中以酒代水,抑制了酵母菌的生長,發酵不充分,因此易于生成雜醇油;酒醪中的殘糖量較高,酵母代謝不旺盛,因此雜醇油較難通過糖合成途徑,應當主要通過Ehlrich途徑生成[11]。考慮到目前甜型和半甜型仍占據相當大的市場份額,那么抑制Ehlrich途徑是今后工作的方向和重點。
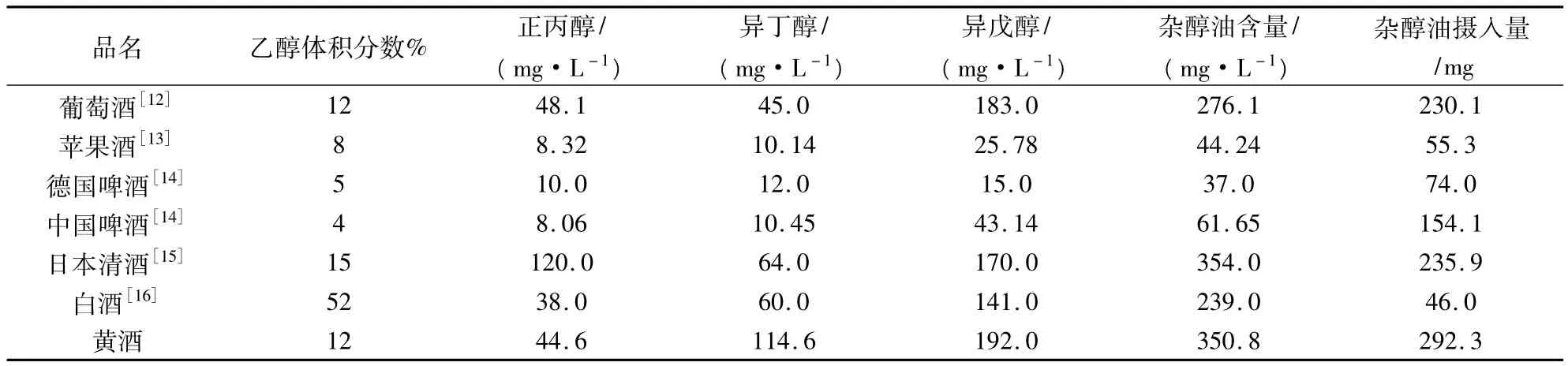
表5 各種酒的雜醇油含量
普遍反映,黃酒飲后舒適度較差,那么是否是雜醇油含量造成的呢?如表5所示,與其他酒相比較,除了清酒之外,其它酒中也呈現異戊醇>異丁醇>正丙醇的現象。以單次飲用100 mL酒精量的酒計算,攝入的雜醇油含量黃酒最高,為292.3 g,是白酒的6.3倍,德國啤酒的3.9倍。雖然也有報道,飲后所帶來的不適感,不僅與雜醇油相關,也與酒中酯、醇的含量、組成密切相關。但是不可忽視的是,雜醇油仍是其中最重要的影響因素之一。
為何黃酒會產生如此高含量的雜醇油,經分析主要是工藝上的差異造成的。黃酒是邊糖化邊發酵,發酵醪的濃度較高,酵母生長不旺盛,促進了雜醇油的產生。相比較而言,以啤酒為例,啤酒釀造是純種發酵,酵母量充足,繁殖世代少,同時糖分消耗迅速,對氨基酸作用不充分,這在一定程度上均降低了雜醇油的產生。黃酒的主發酵溫度相對于啤酒更高也促進了雜醇油的生成。因此改善黃酒等是降低雜醇油含量的一個重要措施,也已有一些工作報道出現[17],也可以借鑒其它酒種的發酵工藝等或通過改造酵母菌種等措施來降低雜醇油含量。
3 結論
實驗結果表明,頂空進樣毛細管氣相色譜法對黃酒中雜醇油的檢測,免除了繁雜的樣品前處理過程,具有進樣準確、重復性好、使用方便等優點。本實驗中對不同來源、類型的10個酒樣中的雜醇油進行了測定,結果表明:黃酒中雜醇油含量在200~500 mg/L之間。所有酒樣的雜醇油分布均表現為異戊醇>異丁醇>正丙醇,雜醇油含量在黃酒中的分布呈現出干型<半干型≈半甜型<甜型的現象。
本研究結果比較了不同來源、類型的黃酒的雜醇油的含量,初步分析了生產工藝對于雜醇油含量的影響,尤其是甜型和半甜型中以酒代水的工藝應當加以改善,但是深入具體的研究仍有待進行。同時本研究結果,初步揭示了黃酒中雜醇油含量對于其品質的影響,因此是否將雜醇油這一指標引入黃酒標準以適應日益提高的食品安全需求也是當前亟需考慮的問題。
[1] Calderbank J,Hammond J R M.Influence of higher alcohol availability on ester formation by yeast[J].J Am Soc Brew Chem,1994,52(2),84-90.
[2] Cisbani B,Muecio A and Travia L.Contents of higher aleohols in wine distillates and grape residue distillates[J].Rivista della Societa Italianadi Scienza,1977(3):187-189.
[3] Dickinson,J R,Harrison J,and Hewlins M J.An investigation of the metabolism of valine to isobutyl alcohol in Saccharomyces cerevisiae[J].J Biol Chem,1998,273:25751-25756.
[4] 毛青鐘,石彩琴.黃酒中主要上頭物質及控制技術的研究[J].釀造與發酵,2010,(3):27-32.
[5] Lucie A H,Jean-Marc D,Antonius J A van Maris,et al.The Ehrlich Pathway for Fusel Alcohol Production:a Century of Research on Saccharomyces cerevisiae Metabolism[J].Applied and Environmental Microbiology,2008,74(8):2 259-22 66.
[6] 毛青鐘.淺談機械化黃酒中高級醇含量的控制[J].釀酒,2000,1:51 -53.
[7] 殷德榮.毛細管氣相色譜法測定紹興黃酒中揮發性物質[J].中國衛生檢驗雜志,2006,16(8):930-931.
[8] 郭翔,胡普信,徐巖,等.黃酒揮發性風味物質的研究[J].釀酒科技,2004(5):79 -81.
[9] 夏小樂,夏梅芳,楊海麟,等.氣相色譜法測定清爽型黃酒中的乙醛和雜醇油含量[J].釀酒,2010,37(6):72-74.
[10] 陳佩仁,葉春勇,王友崇,等.無蒸煮麥曲黃酒產品的質量控制[J].釀酒科技,2007(12):65-67.
[11] 劉永樂,俞健,黃壽恩,等.甜型黃酒發酵過程中的生物和化學成分性質研究[J].中國食品學報,2004,4(1):60-64.
[12] Dan Y Y,Yukio K,Ronald E S.Higher alcohols,diacetyl,acetoin and 2,3 - butanediol biosynthesis in grapes undergoing carbonic maceration[J].Food Research International,2006,39:112 -116.
[13] 王曉茹,王頡.蘋果酒釀造工藝及高級醇的氣相色譜分析[J].中國食品學報,2006(6):351-356.
[14] 李春紅,云霞,楊紅.氣相色譜內外標法分析啤酒中高級醇含量的比較[J].中國釀造,2007(4):61-65.
[15] 傅金泉.日本清酒芳香成分研究概述[J].釀酒科技,2000(2):83-85.
[16] 王立釗,梁慧珍,馬樹奎,等.影響固態發酵白酒中雜醇油生成因素的研究[J].釀酒科技,2006(5):43-48.
[20] 張秋汀,魏桃英.改良型黃酒工藝初探[J].釀酒科技,2007(1):71-72.

