稀土固體超強酸Gd3+-SO24-/ZrO2催化合成乙酸正丁酯
胡春燕,李雙全
(1.江西農業大學理學院,江西南昌 330045;2.華東理工大學研究生院,上海 200237)
乙酸正丁酯是一種具有水果香味的無色透明且可燃的液態酯類,可作為食用香料及清漆、人造革、塑料等化工產品的溶劑[1-2]。目前,在工業生產中,通常以濃硫酸作為催化劑,由乙酸和正丁酯直接合成乙酸正丁酯。該方法主要缺陷是:反應時間長,腐蝕設備,副產品多,后處理繁瑣,產率低,污染環境等[3-4]。
國內外學者一直在研發新的催化劑來取代濃硫酸,但目前大多數僅限于試驗室研究。近年來,已發現雜多酸、無機鹽、氨基磺酸、固體超強酸等均可作為酯化反應的催化劑。
試驗研究了以固體超強酸SO24-/ZrO2負載稀土元素Gd制備系列稀土固體超強酸Gd3+-SO24-/ZrO2并催化合成乙酸正丁酯,確定了制備條件,并以篩選出的催化劑合成乙酸正丁酯,考察不同反應條件對酯化反應的影響。
1 試驗部分
1.1 試劑和儀器
試劑:冰乙酸,正丁醇,氫氧化鈉,氧氯化鋯,氨水,Gd2(SO4)3,濃硫酸,NaHCO3,NaCl,無水硫酸鎂,硝酸銀,酚酞,均為分析純。
儀器:分子篩,馬弗爐,干燥箱,油浴鍋,磁力攪拌器,堿式滴定管,阿貝折光儀。
1.2 試驗方法
1.2.1 稀土固體超強酸Gd3+-SO2-4/ZrO2催化劑的制備
稱取20g ZrOCl2·8H2O溶于150mL蒸餾水中,滴加1∶1(體積比)氨水至pH=10,在一定溫度下靜置陳化24h得到Zr(OH)4沉淀,抽濾,水洗至用AgNO3溶液檢測無Cl-為止。抽干濾餅,在110℃下烘20h后研磨過100目篩,將所得固體浸泡在飽和Gd2(SO4)3和1.1mol/L H2SO4混合液中,攪拌60min后再浸泡3h,抽濾。濾餅在110℃下烘10h后研磨至100目下,置于馬福爐中焙燒3h,得稀土固體超強酸催化劑Gd3+-SO2-4/ZrO2(GSZ)。
1.2.2 乙酸正丁酯的合成
在裝有分水器、溫度計和回流冷凝管的三頸燒瓶中,加入16mL正丁醇、5mL冰乙酸和稀土固體超強酸催化劑1.5g,攪拌均勻后,先取樣測定酸值,然后加熱回流分水(控溫105~110℃,至幾乎無水分出為止)。反應約2h,稍冷后取樣測定酸值。利用GB1668—1981方法測定反應前后酸值的變化,計算酯化率。反應之后,過濾除去催化劑(回收),倒出反應液于分液漏斗中,依次用少量蒸餾水,10%NaHCO3洗至中性,經飽和食鹽水洗滌及無水硫酸鎂干燥后,蒸餾,充分收集124~126℃之間的餾分,測定折光率并與文獻值(n=1.394 1)對比。
1.2.3 酯化率的測定
取反應前后混合液各1mL,用蒸餾水稀釋至20mL,用0.1mol/L NaOH溶液滴定,所消耗的NaOH溶液的體積分別記為V1、V2,利用GB1668—1981方法測定反應前后酸值的變化,計算酯化率:

式中:酸值=cV;c為NaOH標準溶液濃度,0.1 mol/L;V為滴定體積,mL。
2 結果與討論
2.1 催化劑制備條件對酯化反應的影響
2.1.1 浸漬硫酸濃度對催化活性的影響
催化劑制備過程中浸漬時間3h,焙燒溫度500℃(乙酸與正丁醇反應條件為反應溫度105~110℃,反應時間2h,催化劑用量1.5g),考察浸漬硫酸濃度對催化活性的影響,結果如圖1所示。
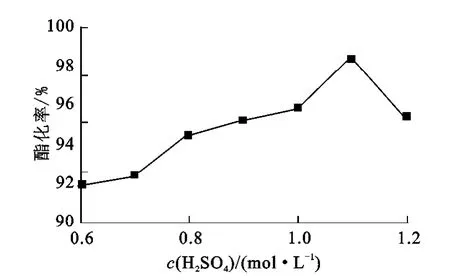
圖1 浸漬硫酸濃度對酯化率的影響
由圖1可見:硫酸濃度<1.1mol/L時,酯化率隨浸漬硫酸濃度的增大而增大;硫酸濃度>1.1 mol/L時,酯化率隨浸漬硫酸濃度的增大而減小。這可能是浸漬硫酸濃度過高,金屬氧化物微粒發生溶解,形成硫酸鹽所致。該試驗條件下,最適宜的浸漬硫酸濃度為1.1mol/L。
2.1.2 浸漬時間對催化劑活性的影響
催化劑制備過程中,浸漬所用硫酸濃度為1.1 mol/L,焙燒溫度為500℃(乙酸與正丁醇反應條件為反應溫度105~110℃,反應時間2h,催化劑用量1.5g),考察催化劑在硫酸中的浸泡時間對催化活性的影響,結果如圖2所示。

圖2 浸泡時間對酯化率的影響
由圖2可見:隨著浸泡時間的延長,酯化率逐漸提高,浸泡3h時酯化率達到最高,然后隨浸泡時間增長,酯化率逐漸降低。這是由于隨濃硫酸與氧化物接觸時間的延后,硫酸將會發生鹽化效應,因此,在試驗條件下,最佳浸泡時間為3h。
2.1.3 焙燒溫度對酯化率的影響
催化劑制備過程中浸漬時間3h,浸漬硫酸濃度為1.1mol/L,(乙酸與正丁醇反應條件為反應溫度105~110℃,反應時間2h,催化劑用量1.5g),焙燒溫度對酯化率的影響如圖3所示。

圖3 焙燒溫度對酯化率的影響
由圖3可見:隨焙燒溫度升高,SO2-4與ZrO2結合的更加緊密,酯化率逐漸升高;但溫度高于500℃后,催化活性隨溫度升高而降低,這可能是由于催化活性中心數減少[5]、溫度高SO2-4以氣態SO2形式流失所致。因此,在試驗條件下,最佳焙燒溫度為500℃為宜。
2.2 酯化反應條件對酯化反應的影響
2.2.1 反應時間對酯化率的影響
在酯化反應中,反應時間與酯的產率有密切關系。從圖4可以看出:反應開始時,酯化率隨反應時間的增加而增高,在反應2.5h時達到最高;反應時間再延長,產率逐漸下降。說明反應2.5 h時已達平衡,隨著反應時間的延長,酯化率不再增加,副產物開始增多,致使產率有所下降。綜合考慮,反應時間控制在2.5h較為合適。
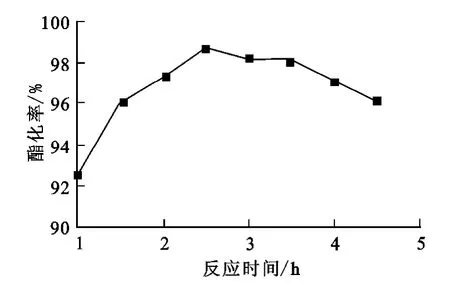
圖4 反應時間對酯化率的影響
2.2.2 催化劑用量對酯化率的影響
用16mL正丁醇、5mL冰乙酸,改變催化劑用量進行試驗,反應時間為2.0h,結果如圖5所示。
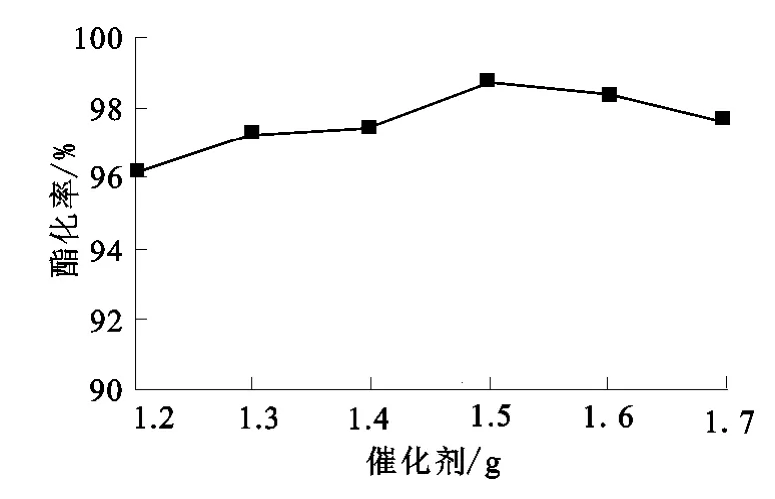
圖5 催化劑用量對酯化率的影響
由圖5可見:該催化劑對酯化反應有明顯的催化活性,隨催化劑用量增大,酯化率提高,催化劑用量為1.5g時,酯化率最高;再增大催化劑用量,酯化率反而下降。表明催化劑用量增大對正丁醇的酯化和脫水反應均有促進作用;當催化劑用量增大到一定(1.5g)時,生成的乙酸正丁酯的量達到最大值(98.86%)。因此,催化劑用量不宜過多,適宜的用量應控制在1.5g左右。
2.2.3 醇酸物質的量比對酯化率的影響
用5mL冰乙酸,1.5g催化劑,改變醇酸物質的量比進行試驗,反應時間為2.0h,結果如圖6所示。
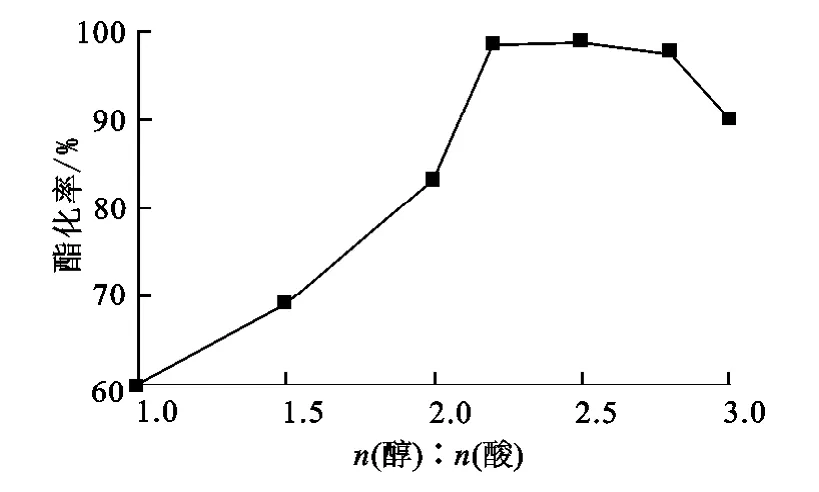
圖6 醇酸物質的量比對酯化率的影響
由圖6可見:增大正丁醇的用量,有利于酯化率的提高,這是因為,乙酸與正丁醇的酯化反應是可逆反應,增大正丁醇的用量,有利于反應向生成酯的方向移動而提高酯化率。正丁醇不僅是反應物還是溶劑,而且共沸脫水也要消耗少量正丁醇,因此,正丁醇的用量應大于理論用量。但正丁醇用量提高到一定程度后,酯化率反而有所下降,這可能是醇用量增大在一定程度上降低了酸和催化劑的相對濃度,使酯化率得不到提高。試驗條件下,最佳的醇酸的物質的量比以2.5∶1為最佳。
2.2.4 催化劑重復使用效果
在最佳試驗條件下考察催化劑的重復使用效果。控制條件為:催化劑浸漬時間3h,浸漬所用濃硫酸濃度1.1mol/L,焙燒溫度500℃;乙酸與正丁醇反應條件為:反應溫度105~110℃,反應時間2.5h,催化劑用量1.5g;反應結束后,體系稍冷卻,將反應液傾出,再加入同樣物質的量比的反應物,按上述方法繼續酯化[6],考察重復使用的效果結果如圖7所示。
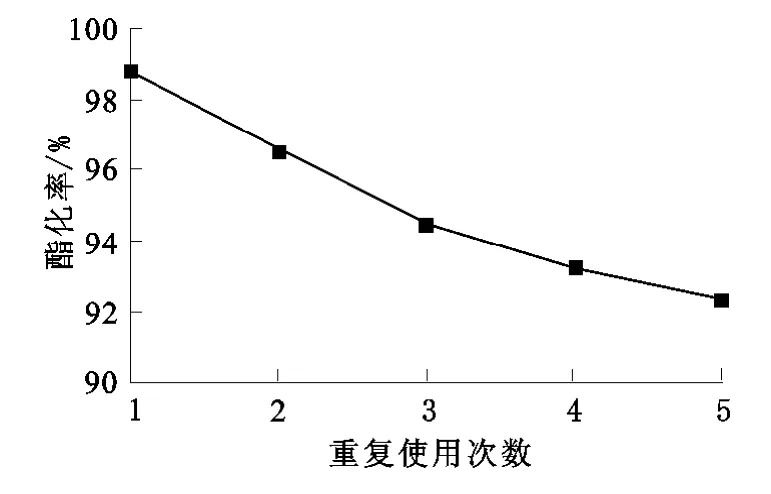
圖7 催化劑重復使用效果
由圖7可見,重復使用5次后,反應的酯化率雖有所下降,但仍然在92.5%以上,表明該催化劑的重復使用性能良好。
2.3 稀土固體超強酸Gd3+-SO24-/ZrO2和固體超強酸SO24-/ZrO2催化活性的比較
控制催化劑浸漬時間3h,硫酸濃度1.1 mol/L,焙燒溫度500℃;乙酸與正丁醇反應條件為:反應溫度105~110℃,反應時間2.5h,催化劑用量1.5g,對未加Gd3+和已加Gd3+的固體超強酸催化劑進行對比試驗,結果見表1。可以看出:Gd3+-SO24-/ZrO2固體超強酸催化劑的催化活性明顯高于SO24-/ZrO2的催化活性。

表1 固體超強酸催化劑添加Ga3+前后對酯化率的影響
3 結論
試驗結果表明:制備稀土固體超強酸Gd3+-SO2-4/ZrO2的最佳工藝條件為:20g ZrOCl2· 8H2O、飽和Gd2(SO4)3和1.1mol/L H2SO4混合液中,攪拌60min后浸泡3h,抽濾后固體產物再于500℃下焙燒3h。
以所制備的稀土固體超強酸Gd3+-SO24-/ZrO2催化合成乙酸正丁酯,最佳反應條件為:醇酸物質的量比為2.5∶1,催化劑用量1.5g,加熱(105~110℃)回流2.5h,酯化率可達98.86%。Gd3+的摻入有利于固體酸催化活性的提高。將摻有Gd3+的SO24-/ZrO2固體酸催化劑重復使用5次后,其反應活性僅下降6.5%,表明稀土固體超強酸Gd3+-SO24-/ZrO2具有較好的重復使用性能。
[1] 安家駒,錢伯英.實用精細化工詞典[M].北京:輕工業出版社,1989:14.
[2] 白秀麗,李曉莉.乙酸正丁酯的合成與應用[J].長春師范學校學報,2002(1):13-14.
[3] 段長強,孟慶芳,張泰,等.現代化學試劑手冊:第1分冊[M].北京:化學工業出版社,1988:839.
[4] 張連偉.乙酸正丁酯合成的研究進展[J].當代化工,2005,34(3):173-175.
[5] 程鐵欣,畢穎麗.正丁烷Ni(Fe)-SO24-/ZrO2超強酸催化劑上的異構化反應[J].精細化工,1999,16(1):14-16.
[6]Morterra C,Cerrato G,Signoretto M.On the Role of the Calcinations Step in the Preparations of Active(superacid)Sulfated Zirconina Catalysts[J].Catal Lett,1996,41(1/2):101-109.

