胃腸安丸抗輪狀病毒作用的體外試驗
張 婧,周洪經,李曉眠
(天津醫科大學微生物學教研室,天津 300070)
輪狀病毒(rotavirus,RV)屬呼腸孤病毒科,是嬰幼兒急性感染性腹瀉的主要病原體,占嬰幼兒腹瀉的50%[1]。目前無有效的西藥治療[2]。胃腸安丸為純中藥制劑,處方由木香、沉香、厚樸等11味藥組成。現代藥理學實驗證明其有明顯的抗腹瀉作用,對金黃色葡萄球菌、傷寒沙門菌、乙型溶血性鏈球菌、肺炎鏈球菌及痢疾志賀菌、宋內志賀菌、鮑氏志賀菌等8株菌種均有明顯的殺菌作用,還對致病病毒的基因有一定影響,可達到降解病毒核酸的目的,與西藥相比具有明顯的優勢[3]。本研究旨在探討胃腸安丸在體外對RV的治療作用,為篩選新型抗輪狀病毒的中成藥提供實驗和應用基礎。
1 材料與方法
1.1 材料
1.1.1 病毒株與細胞株 猴輪狀病毒SA11株,非洲恒源猴腎細胞(MA104細胞)(天津醫科大學微生物學教研室提供)。
1.1.2 藥物 胃腸安丸由天津中新藥業集團股份有限公司樂仁堂提供,國藥準字Z10880010。
1.1.3 實驗動物 SPF級雄性健康Wistar大鼠,體重均約250g,購自中國醫學科學院放射研究所醫學實驗動物中心,實驗動物許可證號:SCXK(津)實驗動物2005-001。
1.1.4 試劑和儀器 DMEM-HG培養基 (Gibco),胎牛血清(Gibco),胰蛋白酶(Hyclone),四甲基偶氮唑藍(MTT)(Sigma),96孔細胞培養板(BIOFIL公司), CO2培養箱(美國Thermo Forma,3111型),倒置顯微鏡(德國Zeiss,Axiorert 200),酶標儀(Multiskan Mk3,Thermo Labsystems公司),高速離心機(Beckman coulter)。
1.2 方法
1.2.1 細胞培養 MA104細胞在含10%胎牛血清的DMEM-HG培養基,于37℃,5%CO2孵箱中培養傳代。
積極的激勵性外部環境能促進提升一般創造力。組織營造積極的激勵性外部環境條件,如塑造組織整體的創新氛圍、明確闡明整體任務目標、給予經常性的關于如何改進工作的反饋、提供強有力的團隊支持、實施鼓勵性監督、創造信任的工作關系、較多的知識共享空間、給予足夠的資源,等等,都可以形成良好的外部環境,提升個體一般創造力。與此同時,減少消極的外部環境,如過多的工作量和緊急期限、競爭性績效、可預見的負面評價、教條的組織結構,以及開展工作的種種限制等,則可以大大減小消極性外部環境因素對一般創造力的影響。
1.2.2 病毒的傳代及毒力測定 SA11株解凍,乙酰胰酶37℃處理病毒懸液1h,用磷酸鹽緩沖液(PBS)將細胞瓶中MA104細胞單層洗3遍,加入胰酶處理過的SA11株1mL,37℃,5%CO2孵箱中吸附1.5h,加入10mL含5μg/mL胰酶的DMEM-HG培養基,37℃,5%CO2孵箱中培養,當細胞出現病變達“+++”后,凍融2次,4000r/min離心10min,取上清,-70℃保存。SA11株在MA104細胞上多次傳代提高病毒毒力,待毒力穩定后用于實驗。按病毒致細胞病變作用(CPE)終點稀釋法,在96孔細胞培養板上滴定半數組織培養感染量(TCID50)為10-6.3[4]。本實驗用100TCID50/0.1mL。
1.2.3 SA11株電鏡觀察
1.2.3.1 病毒的提純:取經凍溶3次的SA11株80mL,8000r/min,30min,取上清70mL,27000r/min,2h,棄上清,用1mL DMEM-HG培養基懸浮沉淀。
1.2.3.2 透射電鏡標本的制備和電鏡觀察:經高速離心的病毒懸浮液滴在具有Formvar支持膜的300目銅網上,1~2min后用濾紙靠近銅網邊緣,吸去銅網上的液體,用pH7.4的20g/L的磷鎢酸負染1min,用濾紙吸走多余染液,干燥后在透射電鏡(電鏡型號:Philips EM400ST)下進行觀察,每份標本觀察1~2個銅網,并照相[5]。
1.2.4 SA11株dsRNA的檢查 按Z.E.N.A病毒RNA試劑盒說明書操作。提取的SA11株dsRNA用10%聚丙烯酰胺凝膠電泳(PAGE)4h,凝膠用硝酸銀染色檢查dsRNA圖型。
1.2.5 藥物的配制 取胃腸安丸藥物1g乳缽中研碎,放刻度離心管中加水至10mL,水浴煮沸20min,離心2000r/min,10min,取上清,4℃冰箱保存備用。1.2.6藥物毒性測定 取對數生長期濃度每毫升為105的MA104細胞懸液100μL/孔接種于96孔細胞培養板,37℃,5%CO2孵箱培養24h,在單層細胞上分別加入不同濃度的藥物(10、5、2.5、1.25、0.625、0.313、0.16、0.08、0.04、0.02、0.01mg/mL),每孔100μL,每組設4個復孔,同時設正常細胞對照。37℃,5%CO2孵箱培養72h,每日觀察細胞變化,記錄CPE、MTT法檢測細胞存活率,計算藥物的最大無毒濃度(TC0)和半數毒性濃度(TC50)。
1.2.7 細胞水平上胃腸安丸對SA11株的作用
1.2.7.1 藥物對病毒感染的預防作用:用不同濃度藥物預先處理96孔細胞板中的單層MA104細胞1.5h,PBS洗滌后加入經胰酶處理過的100TCID50/ 0.1mL的SA11株100μL/孔。吸附1.5h后棄去,加100μL/孔的DMEM-HG培養基維持,每組設4個復孔,同時設正常細胞對照和病毒對照。37℃,5% CO2孵箱培養,每日觀察,72h后用MTT法檢測細胞存活率,計算抑制率[4]。
1.2.7.3 藥物對病毒感染的直接滅活作用:將不同濃度的藥物與經胰酶處理過的100TCID50/0.1mL的SA11株各100μL,混合作用1.5h后接種在用PBS洗滌過的96孔細胞培養板的細胞上,吸附1.5h后棄去,加100μL/孔的DMEM-HG培養基維持,同上法培養與檢測。
1.2.7.4 每組實驗重復3次。
1.2.8 血清水平上胃腸安丸對SA11株的作用
1.2.8.1 含藥血清的制備:取濃度為2.4mg/mL的胃腸安丸1mL(相當于成人臨床推薦劑量的6倍)給大鼠灌胃,給藥前禁食禁水12h,灌胃前第1次內眥采血。灌胃后25min第2次采血,以后每隔20min采血1次,每次取血約1.5mL,共6次。分離血清,56℃,30min滅活后用0.22μm的濾器除菌,將每個時間點血清樣本分別用DMEM-HG培養基稀釋1:2、1:4、1:8、1:16、1:32、1:64,-20℃保存。
1.2.8.2 最適血清濃度測定:不同濃度的大鼠含藥血清按100μL/孔接種在用PBS洗滌過的單層MA104細胞的96孔細胞培養板上,同時用100TCID50/0.1mL的SA11株感染細胞,另設等梯度濃度的正常血清組,病毒對照組,37℃,5%CO2孵箱培養72h,每日觀察細胞變化,記錄CPE。
1.2.8.3 含藥血清對SA11株的抑制作用:將不同時間點采集的大鼠含藥血清分別用DMEM-HG培養基稀釋至最適血清濃度,按100μL/孔接種在用PBS洗滌過的單層MA104細胞的96孔細胞培養板上,同時用100TCID50/0.1mL的SA11株感染細胞,另設正常血清組,病毒對照組,37℃,5%CO2孵箱培養72h,每日觀察細胞變化,MTT法檢測細胞存活率,計算抑制率。
1.2.9 分析方法 MA104細胞病變程度判定標準(CPE記錄方法):“+”為細胞病變25%以下;“++”為細胞病變25%~50%;“+++”為細胞病變50%~75%;“++++”為細胞病變75%以上。細胞存活率(%)=(實驗組A570值-空白對照組A570值)/(正常細胞對照組A570值-空白對照組A570值)×100%;病毒抑制率(%)=(藥物處理組A570值-病毒對照組A570值)/(細胞對照組A570值-病毒對照組A570值)×100%。根據Reed-Muench法計算藥物對細胞的TC50和藥物對
病毒的半數抑制濃度(IC50),治療指數(TI)=TC50/IC50。運用SPSS11.5統計軟件進行統計,所有數據均以±s表示。多組數據間的比較用one-wayANOVA進行比較;抑制率(或細胞存活率)與藥物濃度間的關系用Probit回歸分析。采用TI作為評價指標來衡量藥物對病毒抑制的效力。指數大于1為有效,指數越大,安全范圍越大[6]。
2 結果
2.1 SA11株電鏡觀察結果 電子顯微鏡下,絕大部分SA11株呈實心顆粒,形態完整,結構清晰,呈車輪狀 (具有輻條狀結構及一個非常清晰平滑的周邊)。少部分病毒出現空心顆粒(圖1)。
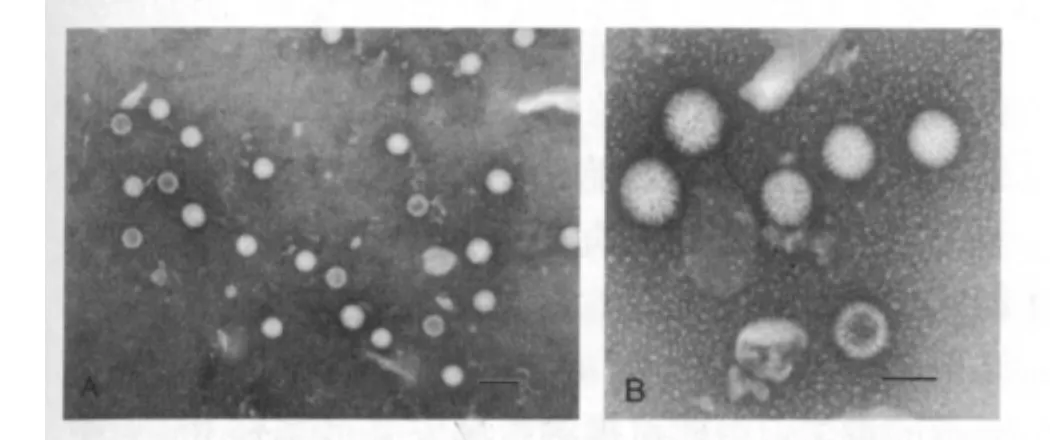
圖1 輪狀病毒SA11株經高速離心提純后電鏡觀察結果Fig 1 Results of electron microscopy of Rotavirus SA11strain purified by high speed centrifugation
2.2 輪狀病毒核酸(dsRNA) 用PAGE檢查dsRNA有清晰的典型的A群輪狀病毒SA11株病毒核酸電泳圖型(4:2:3:2)(圖2)。

圖2 SA11株病毒核酸PAGE電泳圖型Fig 2 Virus nucleic acid PAGE electrophoresis of SA11strain
2.3 藥物毒性 不同濃度胃腸安丸接種于細胞72h,0.625mg/mL及其以下濃度未見出現明顯細胞毒性改變,即胃腸安丸的TC0為0.625mg/mL。TC50為1.25mg/mL。測定的MTT值進一步驗證了該結果。
2.4 細胞水平上胃腸安丸對SA11株的作用 在預防、治療和直接滅活作用中胃腸安丸濃度為0.625mg/mL時能明顯抑制病毒增殖,濃度為0.313mg/mL、0.16mg/mL、0.08mg/mL時效果次之。統計結果顯示在預防、治療和直接滅活作用中胃腸安丸為上述濃度時與病毒對照組差別有統計學意義(P<0.05)。鏡下觀察的結果跟統計結果一致,說明胃腸安丸有抑制SA11感染細胞的作用,且胃腸安濃度為0.625mg/mL時效果最好。見表1。
表1 胃腸安丸抗輪狀病毒作用 (±s)Tab 1 The anti-rotavirus activity of Weichang’an pill(±s)
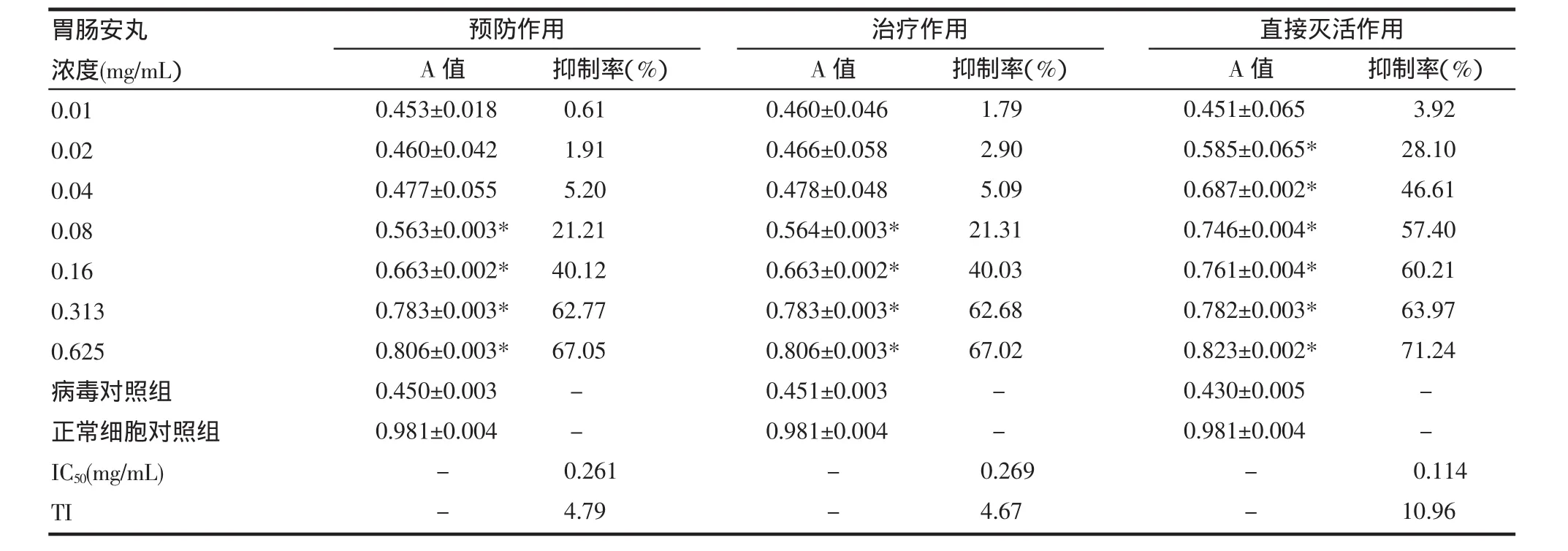
表1 胃腸安丸抗輪狀病毒作用 (±s)Tab 1 The anti-rotavirus activity of Weichang’an pill(±s)
與病毒對照組比較*P<0.05
胃腸安丸濃度(mg/mL)0.010.020.040.080.160.3130.625病毒對照組正常細胞對照組IC50(mg/mL) TI預防作用 治療作用 直接滅活作用A值A值A值0.453±0.0180.460±0.0420.477±0.0550.563±0.003* 0.663±0.002* 0.783±0.003* 0.806±0.003* 0.450±0.0030.981±0.004抑制率(%)0.611.915.2021.2140.1262.7767.05抑制率(%)1.792.905.0921.3140.0362.6867.02抑制率(%)3.9228.1046.6157.4060.2163.9771.24--0.460±0.0460.466±0.0580.478±0.0480.564±0.003* 0.663±0.002* 0.783±0.003* 0.806±0.003* 0.451±0.0030.981±0.004--0.451±0.0650.585±0.065* 0.687±0.002* 0.746±0.004* 0.761±0.004* 0.782±0.003* 0.823±0.002* 0.430±0.0050.981±0.004----0.2614.79--0.2694.67--0.11410.96
2.5 血清水平上胃腸安丸對SA11株的作用
2.5.1 最適血清濃度測定 鏡下結果表明同一時間不同濃度大鼠含藥血清的作用效果類似,正常血清在稀釋度為1∶8以上時對細胞的毒性作用減輕。含胃腸安丸的血清稀釋度在1∶2、1∶4時,表現同正常血清對細胞的毒性作用。1∶16含藥血清與病毒對照組細胞形態有明顯差別,表現出對細胞的保護作用,且此時血清的毒性作用小。
2.5.2 含藥血清對SA11株的抑制作用 含藥血清45min組和65min組時細胞狀態優于病毒對照組和含藥血清的其它各組,抑制SA11株增殖顯著,細胞存活良好。統計結果顯示含藥血清各組均與病毒對照組、正常血清組差別有統計學意義(P<0.05)。見 表2。
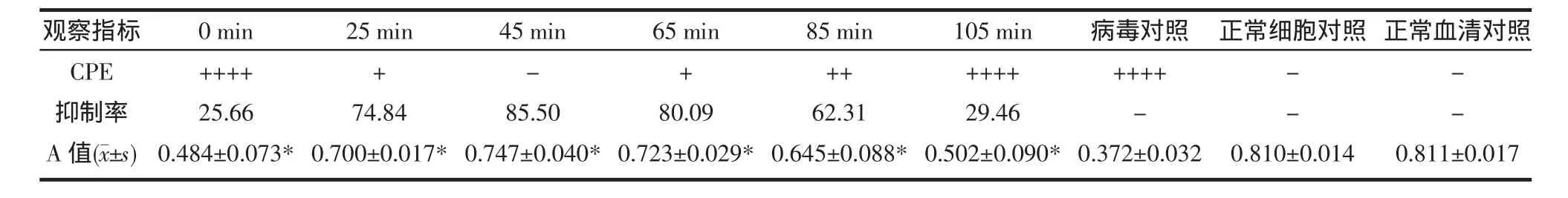
表2 不同時間含藥血清對病毒的抑制率(%)Tab 2 The viral inhibition of the concentration of drug in serum at different times(%)
用MTT法測得含胃腸安丸血清對輪狀病毒的抑制率,繪制時間—效應曲線(圖3),表明含藥血清對輪狀病毒的抑制作用與藥物在體內的代謝時間有關。在給藥后45~65min之間,藥物在血清中濃度最高。
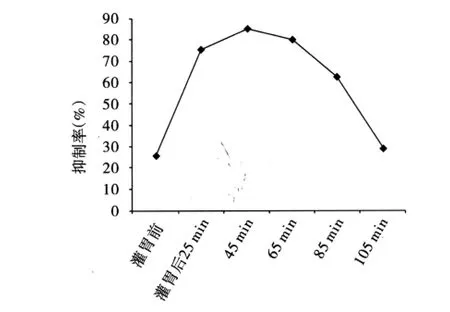
圖3 胃腸安丸含藥血清時間—效應曲線Fig 3 The time-effect curve of concentration of Weichang’an pill in serum
3 討論
RV是引起急性感染性腹瀉的主要病原體。據美國疾病控制中心報告,每年全世界感染輪狀病毒者有2億人,因RV感染而死亡的超過100萬人[7]。它是嬰幼兒急診和死亡的第二大疾病,嚴重威脅人類健康,是世界衛生組織和我國重點防治的疾病之一。由RV引起的腹瀉占我國腹瀉病的50%。目前,對RV治療藥物,主要是對癥治療。中藥對腹瀉的治療有一定的優勢。胃腸安丸具有芳香化濁,理氣止痛,健胃導滯的功能,用于消化不良引起的腹瀉、腸炎、菌痢、脘腹脹滿、腹痛、食積乳積。臨床用胃腸安丸治療RV感染性腹瀉,療效顯著[8-9]。本實驗研究了胃腸安丸及血清體外抗RV的作用,結果顯示:胃腸安丸血清可增強MA104細胞的抗RV感染的作用,對RV感染的MA104細胞有顯著的預防、治療和直接滅活作用,可降低RV的毒力,削弱其感染能力。
RV屬呼腸孤病毒科,根據內層殼衣中VP6蛋白上抗原的差異,被分為A、B、C、D、E、F、G 7組,RV有很強的宿主局限性[10]。感染人類的主要為A、B組,病毒與靶細胞的結合是病毒感染的關鍵,阻斷病毒對靶細胞的吸附可減弱病毒的毒力。我們的實驗證實胃腸安丸血清能提高細胞抗SA11株病毒感染的能力,降低病毒的毒力,可能是減弱病毒對靶細胞的吸附,降低細胞與病毒親和力的雙重作用。鑒于國內外對胃腸安丸研究甚少,所以對感染后的細胞抗RV的機制還知之甚少,尚待進一步研究。本結果表明,胃腸安丸可提高細胞對RV的耐受,降低病毒的毒力。由此可推測胃腸安丸可減輕RV對靶細胞的感染。為臨床胃腸安丸治療腹瀉提供了理論基礎和臨床應用依據。
[1] Orenstein EW,Fang ZY,Xu J,et al.The epidemiology and burden ofrotavirus in China:a reviewofthe literature from1983to2005[J]. Vaccine,2007,25(3):406
[2] BassES,PappanoDA,HumistonSG.Rotavirus[J].PediatrRev,2007, 28(5):183
[3] 桑鍵,郝忻.樂仁堂完全健康手冊[Z].天津:中新藥業天津樂仁堂制藥廠,2005:82-111
[4] 黃禎祥.醫學病毒學基礎及實驗研究[M].北京:科學出版社,1990:266-267,661-693
[5] 宋普球,徐磊.秋瀉靈合劑抗輪狀病毒活性的體外試驗[J].中國藥師雜志,2006,9(2):110
[6] 徐叔云.現代藥理方法學[M].北京:人民衛生出版社,2003:1724-1729
[7] NacNeil A,Holman RC,Yorita KL,et al.Evaluation of seasonal patterns of Kawasaki syndrome-and rotavirus-associated hospitalizations in California and New York,2000-2005[J].BMC Pediatr, 2009,16(4):65
[8] 劉振,高文遠,張靜澤.胃腸安丸對腸易激綜合征治療作用分析[J].藥物評價研究,2010,33(2):159
[9] 劉大功.治療腹瀉良藥胃腸安丸[J].開卷有益.求醫問藥,2002(7):11
[10]Liu B,Fujita Y,Arakawa C,et al.Detection of rotavirus RNA and antigens in serum and cerebrospinal fluid samples from diarrheic children with seizures[J].Jpn J Infect Dis,2009,62(4):279

