合成氣甲烷化制替代天然氣熱力學分析
左玉幫,劉永健,李江濤,李春啟,忻仕河
(大唐國際化工技術研究院有限公司,北京100070)
我國能源結構的基本特點是富煤、貧油、少氣,這一特點決定了當前我國能源消費以煤炭為主(72%),天然氣消費只占到很小的比例(2.5%),遠遠低于世界平均水平(25%),也低于亞洲平均水平(8.8%),大量燃煤使我國環境問題日益突出[1-4]。隨著經濟的快速發展,我國能源消費迅速增加,能源供給日益緊張。要保證能源要求,支撐經濟持續、快速和健康發展,一個重要的舉措是優化能源消費結構,減少煤炭作為一次能源的使用比率,增加天然氣等清潔能源的使用比率[5],而發展煤制天然氣則是這一舉措中的一個重要應對措施。煤經過氣化、變換、凈化、甲烷化、干燥,即得到替代天然氣(SNG)。
甲烷化就是 CO和 CO2加氫生成甲烷,CO和CO2甲烷化反應是強放熱的可逆反應,反應一旦開始即迅速達到平衡。本工作通過熱力學分析,對合成氣甲烷化制替代天然氣的化學反應過程進行了較系統的研究和分析,獲得一些必要的基礎數據,可用于甲烷化反應器與合成氣甲烷化工藝設計的計算和研究開發。
1 熱力學分析
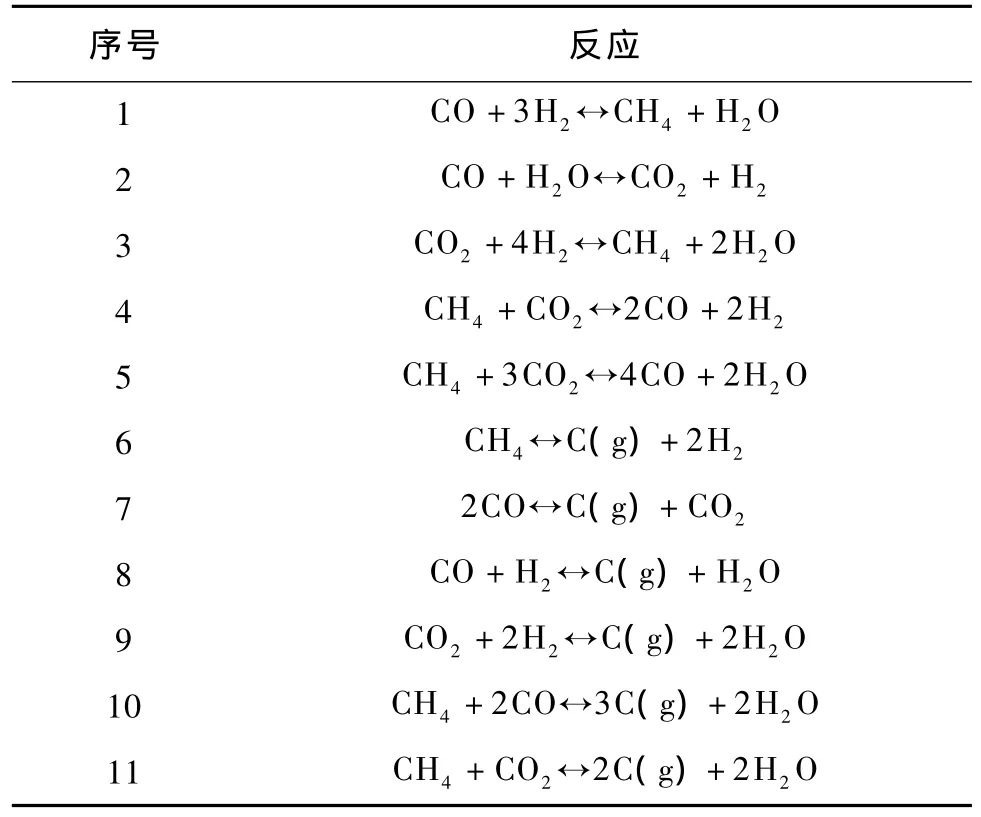
表1 甲烷化過程中可能發生的反應[6-7]Table 1 Probable reactions of methanation process[6-7]
合成氣甲烷化反應體系中包括 H2、CO、CO2、CH4、H2O和 C(g)等6種化合物,組成這些化合物的元素是C、H、O等3種元素。上述6種化合物的化學式系數矩陣列于表2中。
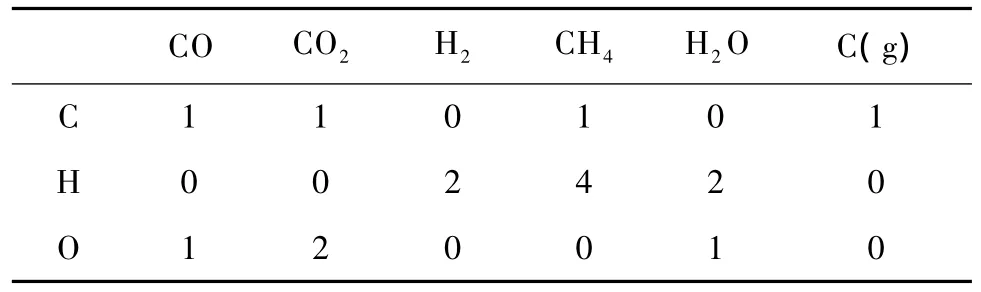
表2 化學式系數矩陣Table 2 Chemical formula coefficient matrix
煤經過氣化、變換、凈化得到的合成氣中一般含有 H2、CO、CO2、CH4、H2O 和惰性氣體,具體的氣體組成與煤的品種和所采用的氣化工藝有關。合成氣中的惰性氣體一般是N2和Ar,本研究中以 N2來表示惰性氣體。合成氣甲烷化制替代天然氣過程中可能發生的反應有11種,列于表1中。
在此系數矩陣中,可得到1個3階非零行列式,因此,此系數矩陣的秩為3,限制方程數為0,根據相律,獨立組分數為3,獨立反應數為3。選擇表1中的CO甲烷化反應(序號1)、水汽變換反應(序號2)和CO歧化反應(序號7)作為獨立反應,并將 CO、CH4和H2O在輸出氣體中的摩爾分數為待求獨立變量,對整個合成氣甲烷化體系的物質進行物料衡算,結果列于表3中。輸出氣體中 CO2和 H2的摩爾分數可以用CO、CH4和H2O的摩爾分數表示。
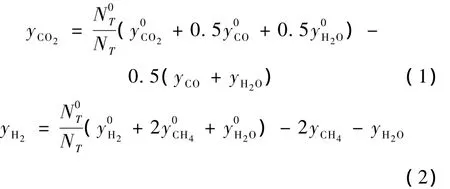
2 熱力學計算模型
物質的恒壓熱容可用式(3)來表示,H2、CO、CO2、CH4、H2O、C(g)和 N2的熱力學數據[8]列于表4中。
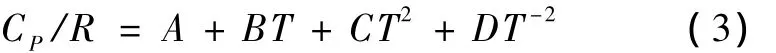
理想氣體狀態的反應熱可以通過恒壓熱容計算得到:
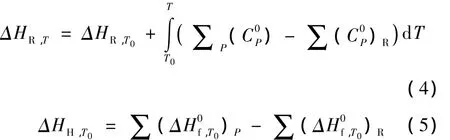
將式(3)和(5)代入式(4)得到反應熱與溫度的關系式(6),反應(1)到(11)的反應熱方程參數見表5。
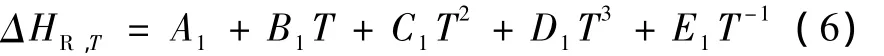
理想狀態下的反應平衡常數可由式(7)計算。
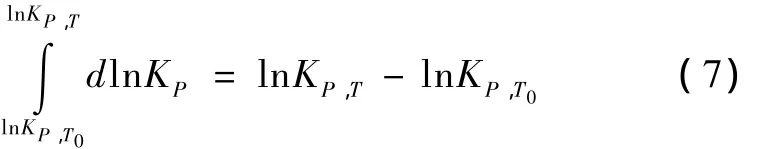
其中,
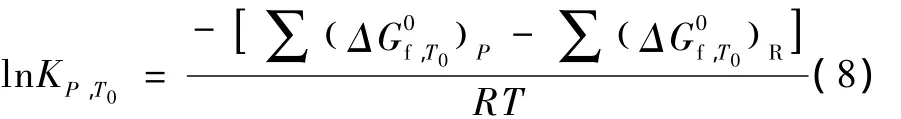
將式(7)積分得式(9):
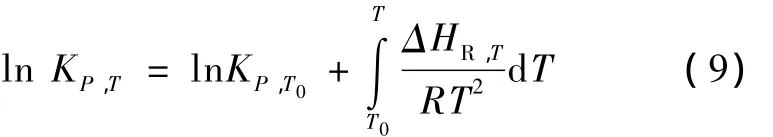

表3 物料衡算表Table 3 Material balance sheet
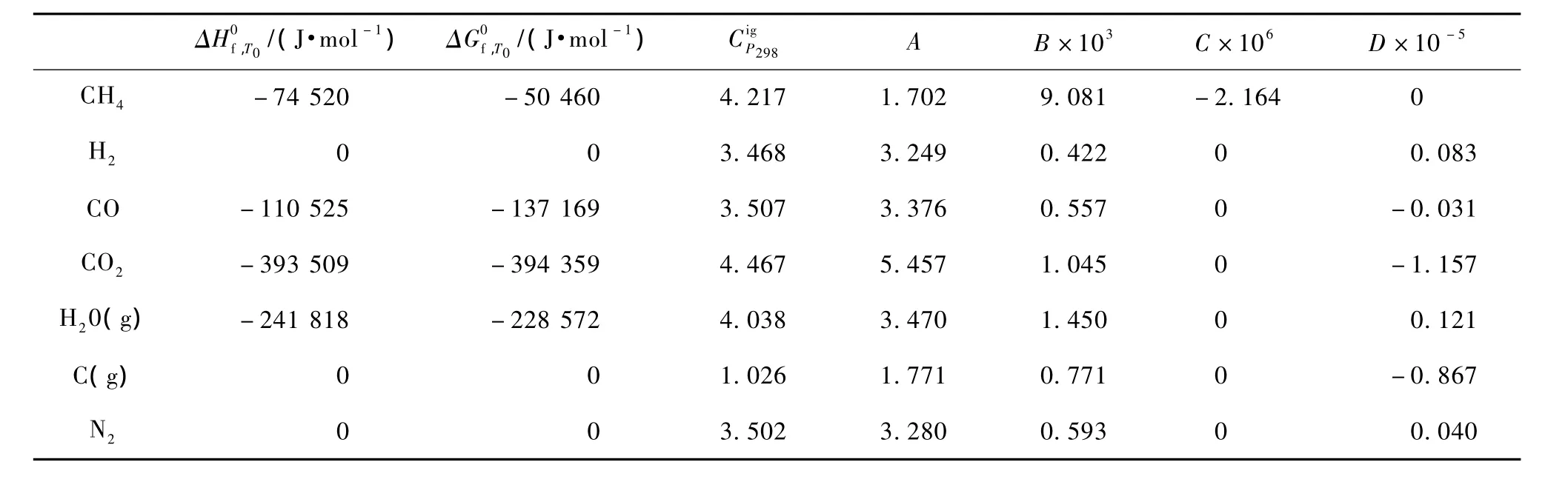
表4 各個物質的熱力學數據Table 4 Thermodynamic data of components
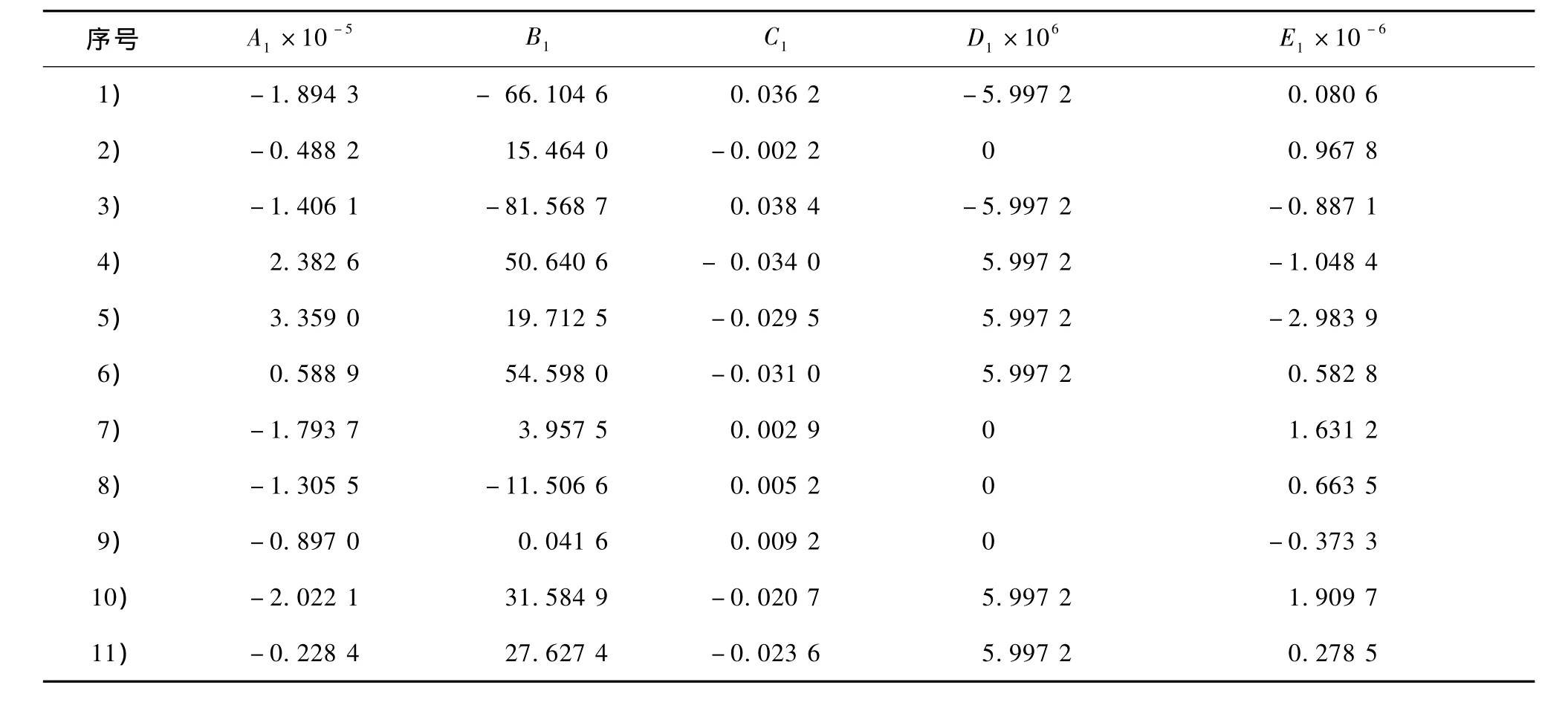
表5 反應熱方程參數表Table 5 Dependence of reaction heat on temperature
根據式(9),得到平衡常數方程:
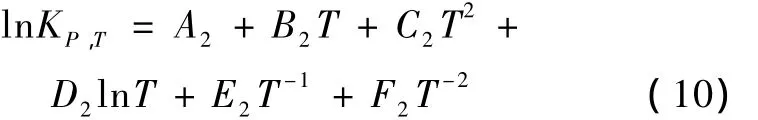
反應1到11的反應平衡常數與溫度的關系式參數見表6。
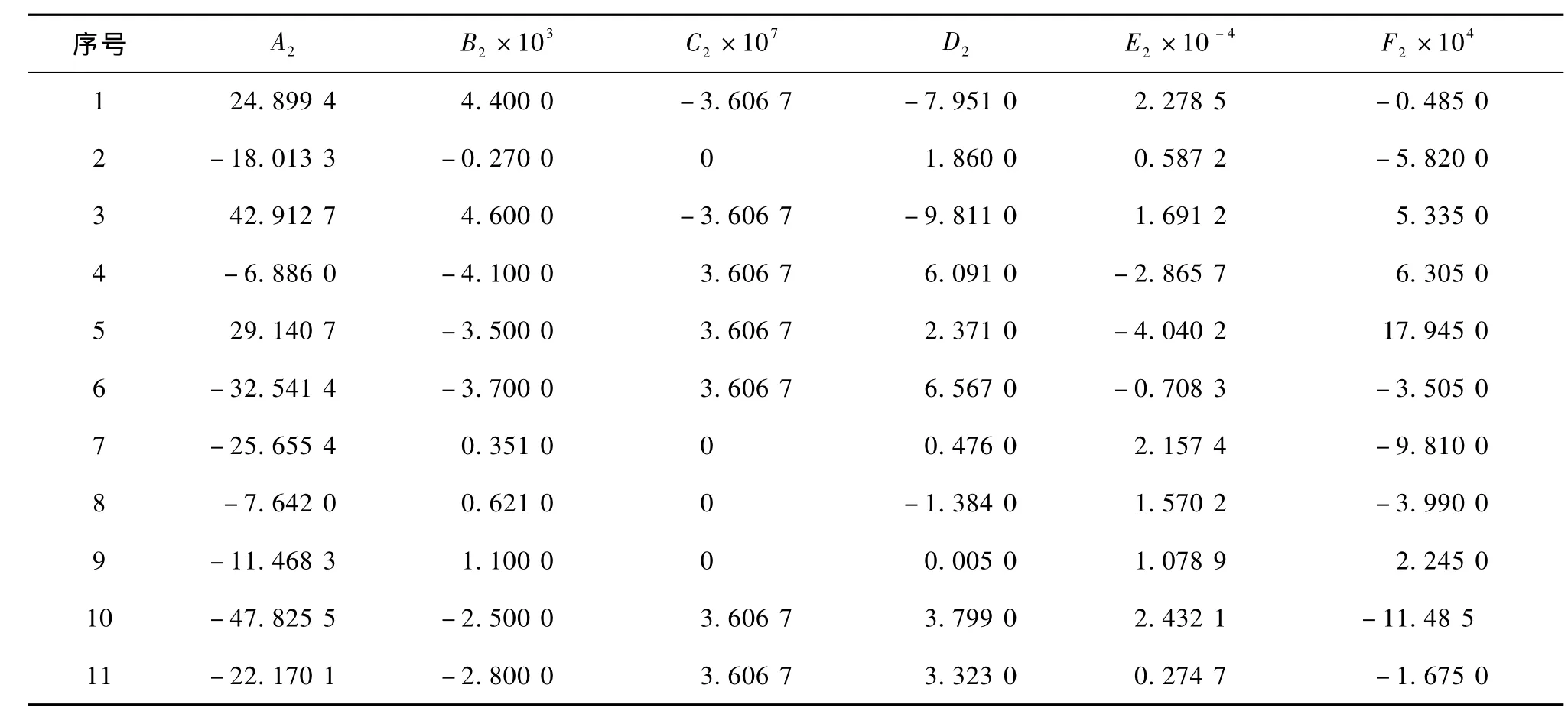
表6 平衡常數方程參數表Table 6 Dependence of equilibrium constant on temperature
CO、CO2加氫生成甲烷是一個強放熱、快速的可逆反應。在絕熱條件下,原料氣中CO每轉化1%產生72℃的溫升,CO2每轉化1%,產生40℃的溫升[9]。絕熱條件下合成氣甲烷化過程的焓變為零,且過程焓變與路徑無關,為便于計算,將合成氣甲烷化過程分為3個可逆的過程進行計算:輸入狀態到標準狀態的焓變ΔH1,標準狀態下反應焓,從標準狀態到輸出狀態的焓變ΔH2。
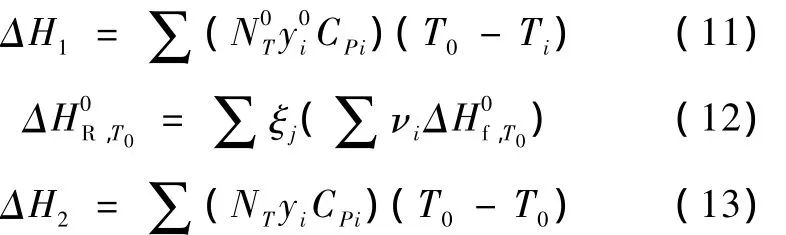
其中,ξj是各個獨立反應的反應進度,νi是各個獨立反應的化學計量系數,因此整個反應體系的溫升方程為:
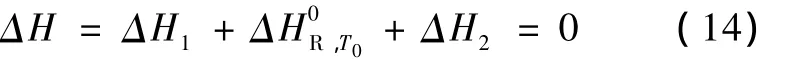
所選擇的獨立反應(1),(2)和(7)反應平衡常數為:
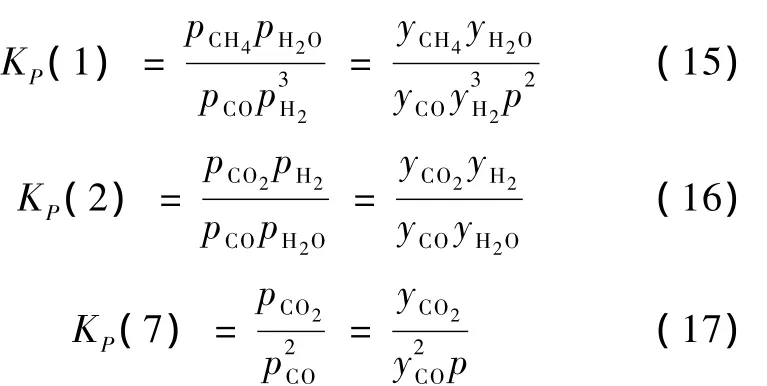
CO的轉化率β和CH4的選擇性S為:
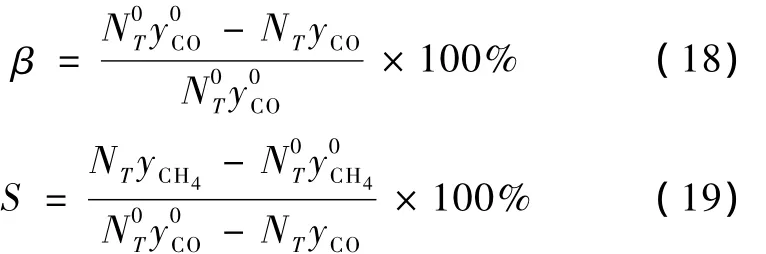
CO和CO2甲烷化反應可以通過控制反應溫度在等溫條件下進行。式(10)、(15)、(16)、(17)、(18)和(19)即是合成氣甲烷化等溫條件下的熱力學模型。通過給定反應溫度,采用線性規劃法求解此模型,可以得到輸出氣體組成、CO轉化率和CH4選擇性。
式(10)、(14)、(15)、(16)、(17)、(18)和(19)即是合成氣甲烷化絕熱條件下的熱力學模型。采用線性規劃法求解此模型,可以得到輸出氣體組成、輸出溫度、CO轉化率和CH4選擇性。
3 計算實例
用來生產替代天然氣的原料氣中含有 H2、CO、CO2、CH4、H2O 和 N2,與所選擇的煤氣化技術有關,本研究對文獻[10-12]中報道的數據進行了計算和對比。
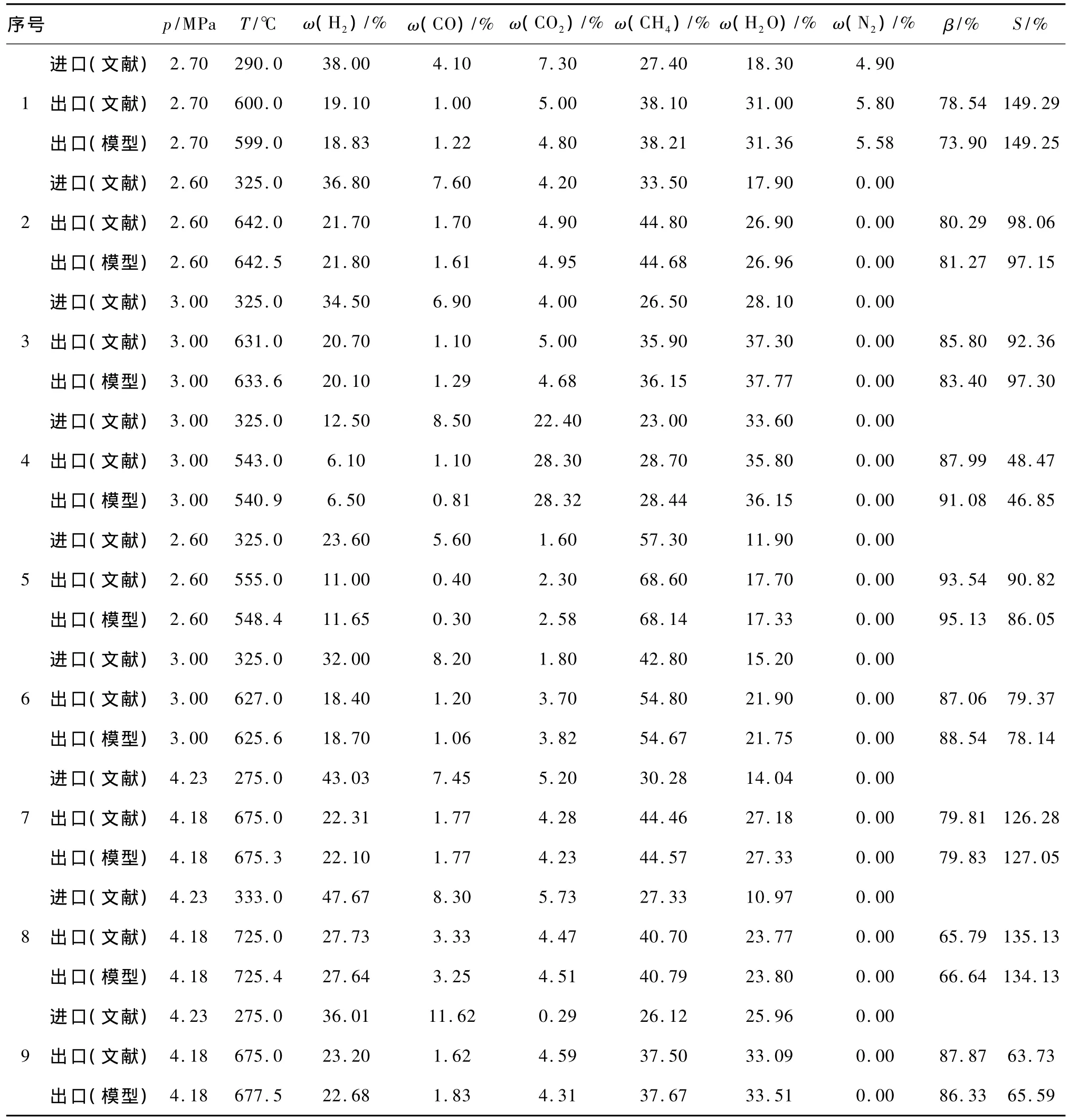
表7 模型計算結果與文獻報道數據的比較Table 7 Comparison between calculated results of the model and reported data
從表7可以看出,采用本研究推導的合成氣甲烷化熱力學模型的計算結果與文獻報道結果相比,誤差很小。其中CH4的選擇性大于100%時表示反應體系中CO2也參與了甲烷化反應,未用CO2的轉化率來表示,故CH4的選擇性會大于100%。本文建立的合成氣甲烷化熱力學模型能夠很好地對合成氣甲烷化過程進行計算和分析,可以用來指導合成氣甲烷化工藝設計。
在進口氣體組成一定的條件下,影響出口氣體組成和輸出溫度的因素有進口溫度和壓力。以表7中第9組數據為例,討論進口溫度和壓力對CO轉化率、CH4選擇性和出口溫度的影響,具體見圖1和圖2。
由圖1可以看出,出口溫度隨著進口溫度的升高而升高,但絕熱溫升隨著進口溫度升高而降低,CO轉化率和CH4選擇性均隨著進口溫度的升高而降低,說明更高的進口溫度不利于CO甲烷化反應,這與甲烷化反應是熱力學平衡控制反應的本質是一致的。在進行甲烷化工藝設計時,進口溫度一般要高于所選用甲烷化催化劑起活溫度50℃以上。
由圖2可以看出,出口溫度和絕熱溫升隨著壓力的增加而升高,CO轉化率和CH4選擇性均隨著反應壓力的升高而增加,說明升高壓力有利于甲烷化反應,與理論分析相一致。
絕熱條件下,原料氣組成、進口溫度和壓力影響甲烷化反應器的出口溫度和絕熱溫升。由于甲烷化反應是放熱反應,高的出口溫度不僅降低了CO和CO2的轉化率,而且增大了甲烷化反應器設計過程中的設備選材的難度。此外適合高溫條件的甲烷化催化劑選擇也是一個難題。
在合成氣甲烷化制替代天然氣的工藝設計中,建議采用多段甲烷化工藝,根據合成氣組成,通過部分產品氣循環和/或在原料氣中添加足量水蒸氣的方法控制甲烷化反應器的絕熱溫升,將甲烷化過程分成幾段,使甲烷化反應器的操作溫度與所使用的甲烷化催化劑相匹配,這樣既能降低甲烷化反應器的設計難度,又能提高反應熱回收效率。具體的合成氣甲烷化工藝需要根據所采用的甲烷化催化劑進行系統優化而得到最優設計。
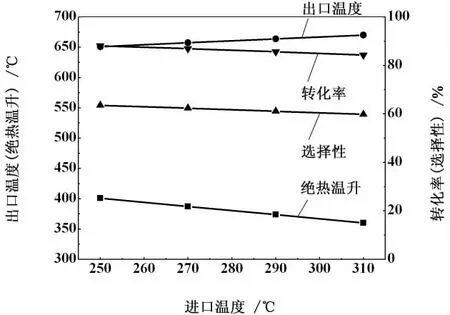
圖1 進口溫度對CO轉化率、CH4選擇性和出口溫度的影響Fig.1 Effect of input temperature on CO conversion,CH4selectivity and output temperature
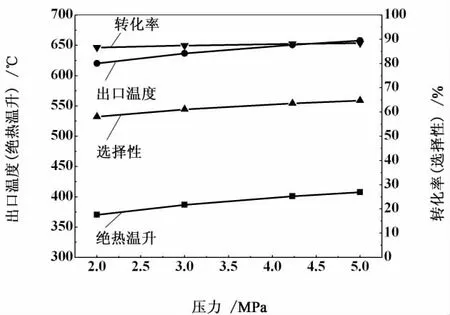
圖2 壓力對CO轉化率、CH4選擇性和出口溫度的影響Fig.2 Effect of pressure on CO conversion,CH4selectivity and output temperature
4 結論
通過熱力學分析,選擇了含有 H2、CO、CO2、CH4、H2O和N2的合成氣的甲烷化反應系列中的CO加氫甲烷化反應、水汽變換反應、CO歧化反應為獨立反應,選擇 CO、CH4和 H2O作為關鍵組分,建立了合成氣甲烷化的熱力學模型。采用非線性規劃方法求解此熱力學模型,可以得到等溫條件下的出口氣體組成、CO轉化率和CH4選擇性或絕熱條件下的出口氣體溫度、組成、CO轉化率與CH4選擇性。計算結果與文獻報道數據相比,誤差很小。在確定的進口氣體組成的條件下,出口溫度隨著進口溫度的升高而升高,CO轉化率和CH4選擇性隨著進口溫度的升高而降低;出口溫度、CO轉化率、CH4選擇性均隨著壓力的升高而增加。
建議合成氣甲烷化制替代天然氣工藝采用多段循環固定床甲烷化工藝,既能降低反應器與工藝設計難度,又能提高反應熱回收效率。
符號說明:


上標:

下標:

參考文獻:
[1]崔民選.中國能源發展報告[M].北京:社會科學文獻出版社,2006
[2]余良暉,孫 婧,陳光升.透視中國能源消費結構[J]. 中國國土資源經濟,2006,(7):7-10
[3]段海峰,王立杰.我國能源消費結構變化趨勢及對西部能源資源開發的影響[J].中國礦業,2007,16(1):14-16
[4]馮本超,楊維祥.以煤為主的能源消費結構面臨的環境問題及其對策[J].礦業安全與環保,2004,31(5):21-25
[5]賴向軍,戴 林.石油與天然氣——機遇與挑戰[M].北京:化學工業出版社,2005
[6]FROMENT G F,XU J.Methane steam reforming,methanation and water-gas shift:I.Intrinsic kinetics[J].AIChE Journal,1989,35(1):88 - 96
[7]KHORSAND K,MARVAST M A,POOLADIAN N,et al.Modeling and simulation of methanation catalytic reaction in ammonia unit[J].Petroleum & Coal,2007,49(1):46-53
[8]SMITH J M;VAN NESS H C,ABBOTT M M.化工熱力學導論[M].第7版.北京:化學工業出版社,2007
[9]瞿亞平.國產Ru/Al2O3甲烷化催化劑的工業應用與探討[J].化工進展,2003,22(4):417-419
[10]ROSS J R H.Metal catalysed methanation and steam reforming[J].Catalysis,1985,7:1 - 45
[11]JORN E.Process for preparing methane rich gases,US:4130575[P].1978-12-19
[12]SKOV A.Process and a plant for preparing a gas rich in methane,US:4298694[P].1981-11-03

