基于樹形分叉結構的微通道甲醇重整制氫
沈寅麒,張云芳,陳桂山
(華北電力大學能源動力與機械工程學院,北京 102206)
1 引言
近年來,隨著環境問題的日益突出和石油資源的匱乏,質子交換膜燃料電池(PEMFC)動力汽車成為各國及各大汽車制造商爭相研究的焦點。但質子交換膜燃料電池面臨著一個急需解決的問題,即氫氣的供給。微通道甲醇水蒸汽重整制氫技術因其產氫濃度高、工作溫度低與質子交換膜燃料電池容易匹配等優點為解決便攜式燃料電池的燃料處理和氫氣供給問題提供了具有廣闊前景的發展方向[1]。
研究發現[2-4]在微通道中(通常指當量直徑小于500μm),流體邊界層厚度大大減小,傳熱傳質的速率大大增加,而且由于流體在微通道中的單位體積接觸表面積要遠大于常規通道,其反應器內部的溫度分布更加均勻,產氫量更高。目前,相關研究對其反應機理及運行參數的選擇已達成一定共識,但微反應器中的流道的優化設計仍需進一步探索。另一方面,由于微加工技術的不斷成熟和發展,使設計、加工結構相對復雜的新型微流道網絡成為可能。同時也為探索自然界中眾多的分形結構對傳熱傳質的影響提供的一個可行的平臺。
樹形分叉結構是當今工程界研究的熱點,它通過重復一定的分叉結構及不斷減小的通道尺寸達到提高傳熱傳質的目的。Bejan和Lorente等人[5-7]研究了樹形分叉結構在電子器件冷卻中應用的可能性。Chen和Cheng[8]分別研究了平行通道與樹形分叉網絡通道中的對流換熱與壓降的情況,結果表明樹形分叉網絡可以提高對流換熱系數,同時減小流體的總壓降。董濤等[9]設計、加工了仿蜂巢分形微管道網絡,發現仿蜂巢分形微管道網絡所能帶走的熱量可達平行陣列微管道網絡的5倍以上,同時它所需的泵送功率是傳統平行陣列微管道網絡的1/10。不難發現以上對樹形分叉網絡的研究均不涉及化學反應。
本文將通過數值模擬方法,圍繞甲醇水蒸氣微通道重整分別對矩形平行微通道和樹形分叉結構網絡的輸運規律開展進一步的探討。
2 物理、數學及熱力學模型
對于矩形平行微通道反應器,通道四周涂有催化劑,取單個反應通道為研究對象(長30 mm,寬1 mm,高1 mm)。將樹形分叉網絡簡化為一個三級分叉的子網絡。(第n級分支的長度均為10 mm,寬為(1/2)n-1mm,高1 mm),圖1即為分支角度為90°的三級樹形分叉網絡。由于催化劑層為冷噴涂方法制取,認為催化反應只發生在催化劑的表面,即為表面反應。
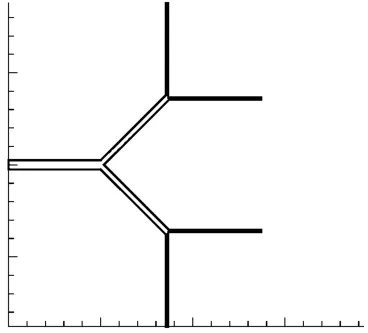
圖1 三級樹形分叉通道二維圖
采用不同的催化劑,甲醇水蒸汽重整制氫過程動力學形式不同,本文選取催化劑Zn_Cr/CeO2/ZrO2就不同的動力學行為進行分析[10]。
假設反應氣在槽道內維持層流流動,同時忽略輻射換熱和體積力;將反應混合氣看作不可壓縮理想氣體;考慮穩態情況。控制方程組如下。
連續性方程:
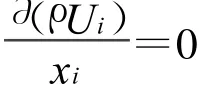
組分方程:
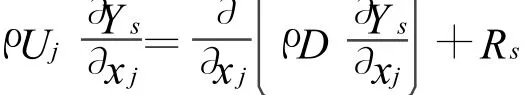
式中:Rs是組分s由于化學反應的凈產生或消耗速率。
組分方程中的源項Rs由下面的A rrhenius公式得出:
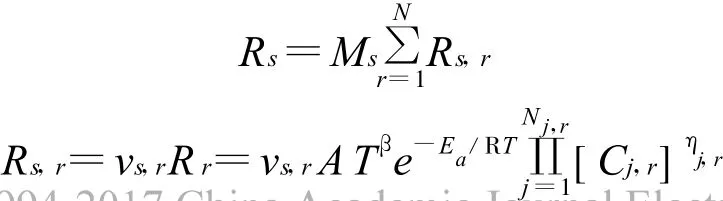
式中:Ms和vs,r分別代表組分s的摩爾分數和它在第r個反應中化學計量數;Nr和N j,r分別是反應機理包含的反應個數和第r個反應中的組分個數,Ns為總的組分個數;Cj,r,ηj,r分別為反應r中組分j對應的濃度和速度常數;Rr,s,r分別為第r個反應的生成速率和組分s在這個反應中的生成速率,它們之間通過化學計量數建立關系,雙速率模型Nr=2,兩個分反應Rr分別為R SR和R DE,公式中參數A,β,Ea和ηj,r分別由動力學方程(濃度形式)對應得出。
動量方程:
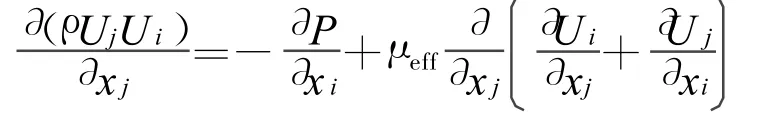
能量方程:
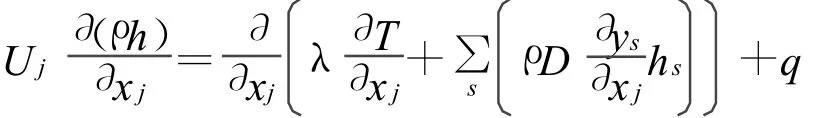
式中:h為混合氣的焓值。
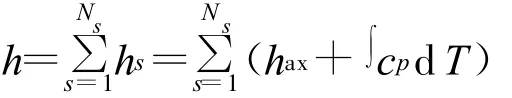
q是由化學反應熱產生的能量源項,由下式確定:
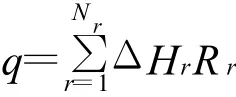
式中:ΔHr為第r個反應的反應熱。
理想氣體方程:
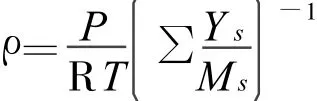
甲醇水蒸汽混合物進入反應器中,在四周反應壁面的催化劑作用下發生的表面催化反應。
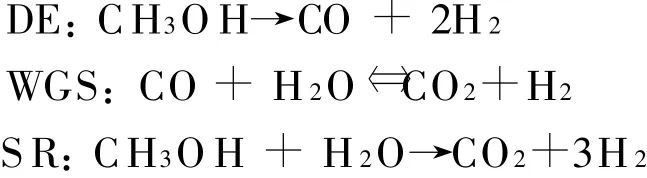
其中,第一個反應是甲醇分解反應(ΔHr的取值92 kJ/mol),第二個反應是水汽置換反應(或逆水汽置換反應)(ΔH r取值-41.1 k J/mol),第三個反應是前兩個反應的綜合反應(ΔHr取值49.4 k J/mol)。整個反應過程是是強吸熱過程,需要外界提供熱量。
根據甲醇水蒸汽重整反應系統中所包含的主要反應SR,DE,WGS或RWGS,可以得到單速率、雙速率和三速率動力學模型[11],其中三速率模型將三個反應全部包含,模型復雜,動力學方程求解困難,尚待進一步分析。單速率模型以總包反應SR作為反應機理,雙速率模型則采用常用的DE和SR并聯反應機理。
本文分別采用雙速率模型。為配合Fluent使用,對甲醇重整制氫本征動力學方程進行轉換,利用理想氣體方程將壓力轉化為摩爾濃度。
動力學方程(濃度形式):
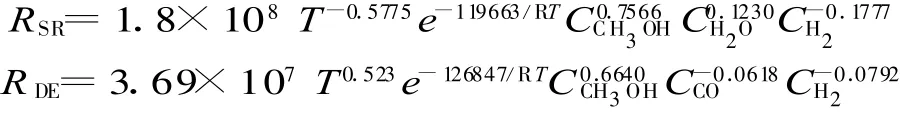
邊界條件:
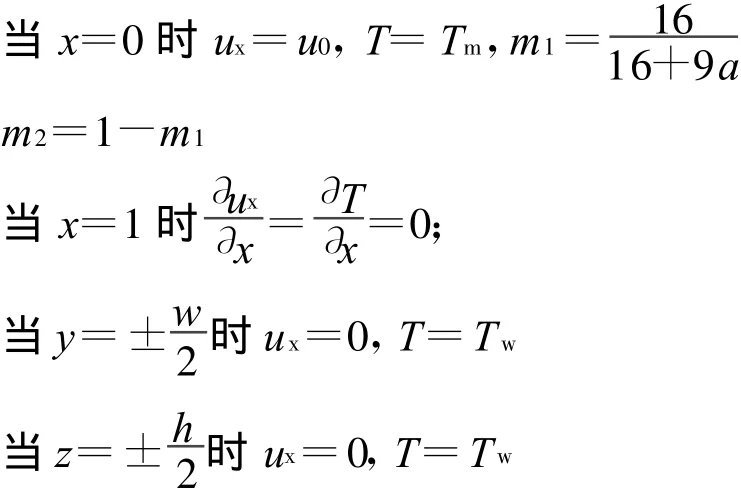
式中:l,w(wn)和h分別為矩形平行微通道、樹形分叉微通道的長寬高;a為水和甲醇摩爾比值,m1和m2分別為甲醇和水的入口質量分數。
3 結果和討論
本文利用Fluent計算軟件對模型進行數值求解,采用結構化網格,計算結果精度經網格數獨立性驗證。模型中參數:水醇比摩爾參數0.5~2.0,反應混合蒸汽進口溫度423~600 K,進口速度0.5~5m/s,反應壁面溫度Twall恒為600 K。采用微通道結構,反應器的面體比將大幅度提高,而以壁面反應為主的微通道甲醇重整反應將更容易發生、反應進行的更為徹底和迅速,同時大面體比可促進熱量的擴散。在這種情況下,雖然甲醇重整制氫是強吸熱過程,仍可在較大范圍內維持相對均勻的溫度。如圖2表示矩形平行流道和樹形分叉流道中混合流體溫度的分布。
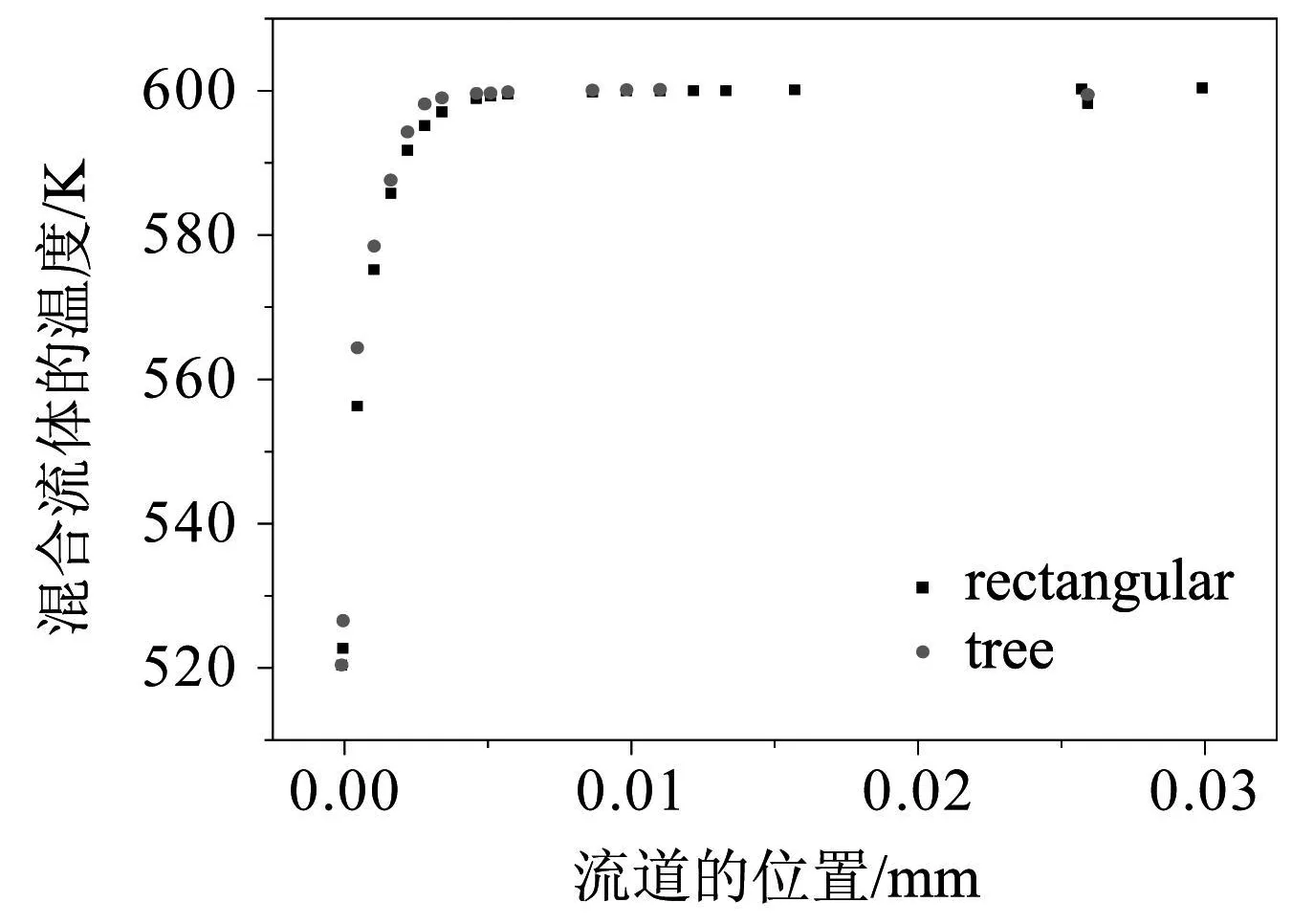
圖2 混合蒸汽沿程的溫度變化
兩種微通道內流體的溫度沿流動方向是升高的,最終接近壁面溫度并保持穩定。可以發現入口段溫度上升的很快,初始的5 mm后,流道中的混合蒸汽的溫度已接近壁面溫度,即恒溫段的長度占整個流道的83.3%。這從側面反映了在這兩種微通道中,反應壁面與通道內流體之間的換熱得到了有效的強化。進而使反應通道內的溫度更均勻,避免了冷點的產生。同時發現在樹形分叉流道中,流體溫度上升的更快,達到壁面溫度所用的時間更少。
樹形分叉微通道網絡中管道截面為矩形,設第一級樹形分叉流道的長是a1高是h1寬是w1,則第m級樹形分叉微通道的長和高不變,寬是:
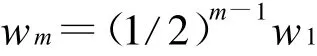
則擁有m級的樹形分叉微通道傳熱面積Am1:
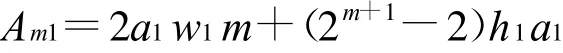
而有m組平行矩形通道(長a1,寬w1,高h1)的換熱面積Am2:
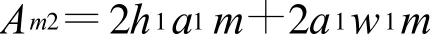
由此可知,樹形分叉微通道的換熱能力隨分形層數的增大而增大。同等條件下,樹形分叉微管道中流體與固體壁面之間的換熱面積要比平行陣列微管道換熱器大得多;并且換熱面積隨m的增加而增大,因而相對換熱能力也隨分形層數m的增加而增大。
圖3-5分別表示在不同入口溫度,水醇比,入口流速下甲醇轉化率χ以及氣體組分摩爾分數F m的變化規律。
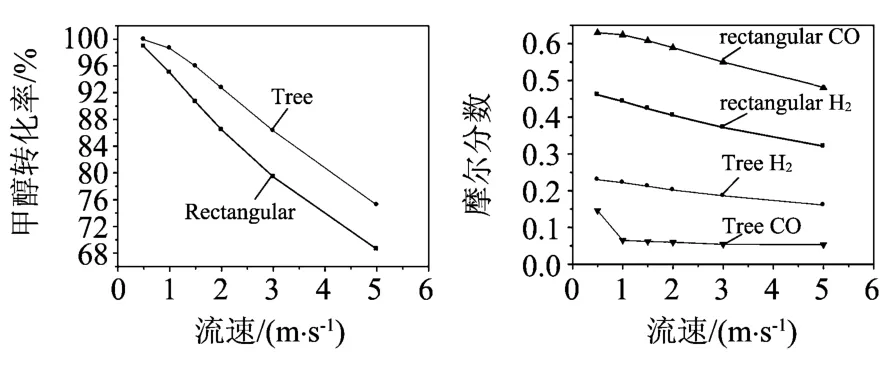
圖3 入口速度V in對重整反應的影響(u s/u c=1.3,T in=500K)
從圖3中可發現入口速度從0.5~5.0m/s變化時,甲醇轉化率經歷了明顯的下降。出口氣體產物摩爾分數也減小。這是因為混合氣體入口流速升高,反應物與催化劑的接觸時間降低,反應不完全,導致甲醇轉化率降低。溫度的變化同樣會對甲醇轉換率產生影響。圖4顯示當甲醇水蒸氣入口溫度升高,甲醇轉化率和出口的氫氣和一氧化碳氣體的摩爾分數增加;這正說明甲醇重整制氫過程是個強吸熱過程,提高溫度促進了反應的進行。但入口溫度也不是越高越好,必須考慮催化劑的燒結問題。
如圖5所示,對于矩形平行微通道和樹形分叉微通道,當水醇比升高時,甲醇轉化率升高而氫氣和一氧化碳氣體的摩爾分數降低,這是因為提高水醇比有助于甲醇的正向轉化,進而提高甲醇轉化率。然而提高水醇比勢必使入口水含量增加,由于剩余水份的增加,從而使得氫氣和一氧化碳氣體的摩爾值降低;甲醇水蒸汽的入口速度對甲醇轉化率有很大的影響。
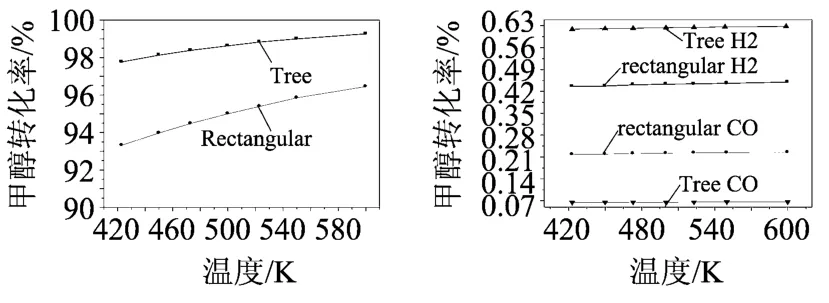
圖4 入口溫度T in對重整反應的影響(u s/u c=1.3,V in=1 m/s)
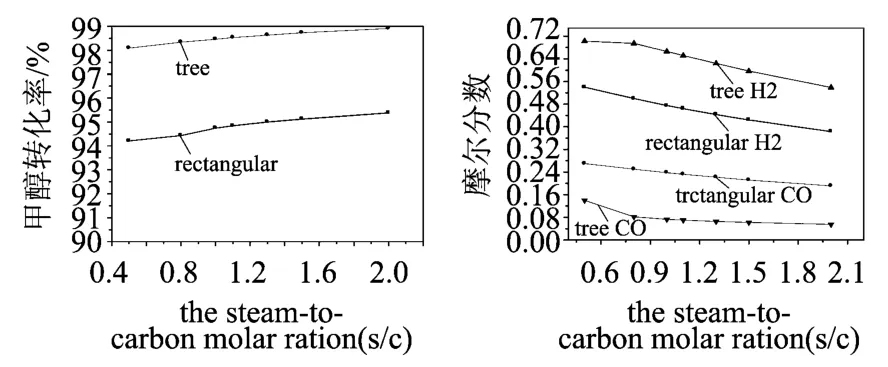
圖5 甲醇比u s/u c對重整反應的影響(T in=500 K,V in=1 m/s)
同時發現,在相同條件下,樹形分叉微通道表現出更高的甲醇轉換率、氫氣的摩爾分數和更低的一氧化碳氣體摩爾分數。這對于運用于質子交換膜燃料電池是有利的,因為CO可導致PEMFC的Pt電極中毒。圖3-5反映了,在不同的進口流速、溫度和甲醇比下,兩種通道中甲醇轉換率的最大差別分別可達6.88%,4.45%和3.83%。這種差別隨著入口流速的減小,入口溫度的提高而減小。而甲醇比的改變對該差別的影響并不明顯。其原因除了上面中提到的樹形分叉結構擁有加大的實際換熱面積外,樹形分叉網絡中連續的分流、合流效應,增加了流動過程的擾動,使流體與固體壁面之間對流換熱得以強化。而甲醇比的變化并不影響換熱,故它對兩種流道中甲醇轉換率的差別的影響并不大。
4 結論
(1)矩形平行微通道和樹形分叉微通道重整反應器都由于具有高面體比結構,可以顯著提高以壁面催化反應為主的甲醇轉化效率,并有助于反應器內溫度分布趨于均勻。
(2)在雙速率模型下,對不同入口溫度、流速、水醇比對重整反應的影響規律進行了分析。
(3)對平行矩形流道和樹形分叉流道進行了對比,在不同入口溫度、流速、水醇比下,樹形分叉流道都表現出更高的甲醇轉換率和更低的一氧化碳氣體出口濃度。這對PEM FC而言,以樹形分叉流道建立的甲醇制氫裝置將更有利,因為它可以減小Pt電極中毒的可能性。
(4)兩種流道甲醇轉化率的差別隨著入口流速的減小,入口溫度的提高而減小;但甲醇比的變化對該差別的影響并不大。
[1] 涂善東,周幗彥,于新海.化學機械系統的小化與節能[J].化工進展.2007,26(2):253-261.
[2] 王 鋒,辛明道.崔文智等.微型燃料重整制氫技術[J].太陽能學報.2007,28(7):783-792.
[3] TONKOV ICH A Y,PERRY S,WANG Y,QIU D, LAPLANTE T,et al.M icrochannel process technology for compactmethane steam reform ing[J].Chem icalEngineering Science.2004,59(22-23):4819-4824.
[4] WANG Y,CHIN Y H,ROZM IAREK R T,et al.Highly active and stable Rh/MgO-A l2O3catalysts for methane steam reforming[J].Catalysis Today.2004,98(4):575-581.
[5] BEJAN A,ERRERA M R.Determ inistic tree netw ork for fluid flow:geometry fo rm inimal flow resistan ce betw een a volume and one point[J].Fractals.1997,5(4):685-695.
[6] BEJAN A,LORENTE S.The constructal law and the therm odynam ics of flow systems with configu ration[J].International Journal of H eat and M ass T ransfer.2004,47(14 -16):3203-3214.
[7] EJAN A,LORENTES.The Constructal Law,L'Harmattan,Paris[J].In ternational Journal of Heat and M ass Transfer.2006,49(1-2):445.
[8] CHEN Y P,CHENG P.H eat transfer and pressu redrop in fractal tree-likem icrochannel nets[J].International Jou rnal of Heat and Mass Transfer.2002,45(13):2643-2648.
[9] 董濤,陳運生,楊朝初.仿蜂巢分形微管道網絡中的流動與換熱[J].化工學報.2005,56(9):1688-1695.
[10] 汪叢偉,潘立衛,張純希.蜂窩催化劑上甲醇自熱重整制氫的動力學研究[J].燃料化學學報.2005,33(6):717-723.
[11] 鄧聯鋒.微型反應器內甲醇水蒸氣重整制氫性能研究[D].重慶:重慶大學(動力工程學院),2007.

