布氏桿菌抗原蛋白pbp39基因重組穿梭質粒的構建與鑒定
鐘 蓓,楊玉瑩 (長江大學動物科學學院,湖北荊州434025)
張西臣 (吉林大學畜牧獸醫學院,吉林長春130062)
顧玉芳,陳振威,多 婷 (長江大學動物科學學院,湖北荊州434025)
布魯氏菌病是由布氏桿菌 (Brucella abortus)引起的導致感染動物流產、不孕不育、生殖器官病變的人畜共患傳染病,我國大部分地區都有此病的存在及流行。近年來,其疫情形勢更為嚴峻,僅2009年發病率同2008年相比即上升25.37%[1],此病成為人類發病數上升速度最快的傳染病之一[2]。布氏桿菌是革蘭氏陰性胞內寄生菌,人感染此病后需長期服用抗生素,易產生耐藥性及副作用。因此消除布魯氏菌病成為公共健康計劃中最重要的目標之一[3]。目前我國廣泛使用的疫苗有牛S19、羊Rev.1和牛RB51,這些疫苗的使用對當地的品種都有較好的效果,但現有的疫苗始終存在不安全、不穩定、且不能與野毒株相區分等缺點。因此,應用分子生物學技術研制新型分子標記苗和基因工程苗成為該病疫苗研究的必然趨勢。
布氏桿菌胞質結合蛋白 (Periplasmic binding protein,PBP39)作為良好的T細胞抗原,被認為是DNA疫苗的免疫抗原候選分子。本研究將布氏桿菌抗原基因pbp39和標記基因p276克隆入大腸桿菌-分枝桿菌穿梭表達載體pMV361中,構建重組pMV361-pbp39-p276質粒,為布氏桿菌分枝桿菌疫苗的研制提供了前提條件。
1 材料與方法
1.1 質粒和菌株
穿梭表達質粒pMV361(Stover博士構建)由吉林大學張西臣教授惠贈,E.coli DH5α、布氏桿菌、重組克隆質粒PMD 18-T-p276為長江大學動物科學學院動物病原與分子生物學實驗室保存,PMD 18-T simple vector為 Takara公司產品。
1.2 主要試劑
TaqDNA聚合酶為Fermentas公司產品;DNA mareker DL2000、DL250+、T4-DNA ligense、凝膠回收試劑盒為上海捷瑞生物公司產品;質粒少量提取試劑盒為Omega公司產品;限制性內切酶EcoR I,Hpa I,Nhe I為Fermentas公司產品。
1.3 引物的設計與合成
根據GenBank提供的序列,使用Primer 5.0分別設計pbp39和p276基因序列的上游引物和下游引物。在pbp39基因的上、下游引物中分別引入EcoR I、H pa I酶切位點。在p276基因的上、下游引物中分別引入Hpa I、Nhe I酶切位點,并分別在NCBI進行Blaster查看引物的特異性,引物序列為:P1:5'-TAGAATTCATGGGCGCCTGTTGCCAATGC-3';P2:5'-GCGTTAACTATTTTGCGGCTTCAACCGCC-3';G1:5'-TACATGTTAACGATTTAGCCGACCAAACAGCA-3';G2:5'-ATGCTAGCTTAATAGGGCCTTATAAGAAGGTC -3'。引物由上海生工生物技術有限公司合成。
1.4 布氏桿菌基因組DNA的提取及純化
布氏桿菌 B株接種胰蛋白胨斜面培養基,于 37℃培養 2~3d。消化液 (100mmol/L NaCl,10mmol/L T ris-HCl pH 8.0,25mmol/L EDTA pH 8.0,0.5%SDS)清洗細菌,沸水煮10min裂解細菌,加入蛋白酶K至終濃度為200μ g/mL,55℃溫育5~6h,其間需振蕩EP管。加入 500μ L苯酚∶氯仿∶異戊醇 (25∶24∶1)抽提2次,再加入500μ L氯仿∶異戊醇 (24∶1)抽提1次。水相用1/8上清體積的5mol/L NaCl和2倍體積預冷的無水乙醇沉淀。70%乙醇洗滌沉淀2次,干燥后溶于滅菌ddH2O中。
1.5 目的基因的擴增
分別以提取的布氏桿菌全基因組DNA和PMD 18-T-p276質粒作為模板,擴增全長為1206bp的pbp39基因和276bp的p276基因。反應條件:94℃預變性5min,94℃55s;65℃1min;72℃1min30s,30個循環;72℃延伸10min。
1.6 含pbp39-p276融合基因的重組穿梭載體的構建
用EcoR I,Hpa I對經PCR擴增獲得的pbp39基因片段進行雙酶切,克隆入經相同內切酶處理的質粒pMV361中,構建重組質粒pMV361-pbp39,雙酶切鑒定后送上海生工公司測序。用 Hpa I,Nhe I對經PCR擴增獲得的p276基因片段進行雙酶切,克隆入經測序鑒定正確的重組質粒pMV361-pbp39中pbp39片段的下游,構建重組質粒pMV361-pbp39-p276,PCR鑒定后送上海生工公司測序。
2 結果與分析
2.1 布氏桿菌pbp39基因和標記p276基因片段的獲得
布氏桿菌pbp39基因PCR擴增產物經1%瓊脂糖凝膠電泳后,在1200bp處可見明顯的擴增產物條帶,未見非特異擴增條帶,與理論擴增產物長度吻合。測序結果與GenBank報道的序列進行比對堿基序列同源性為99%(圖1)。
p276基因PCR擴增產物經2%瓊脂糖凝膠電泳后,在270bp處可見明顯的擴增產物條帶,未見非特異擴增條帶,與理論擴增產物長度吻合 (圖2)。
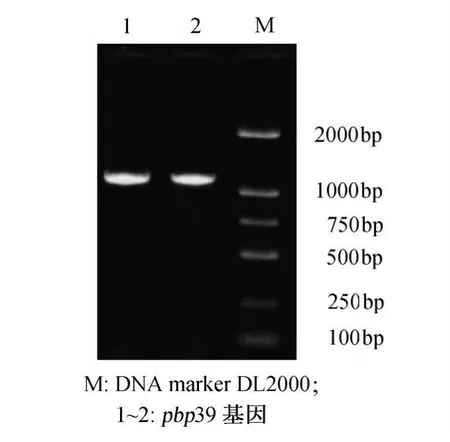
圖1 pbp39基因的PCR擴增
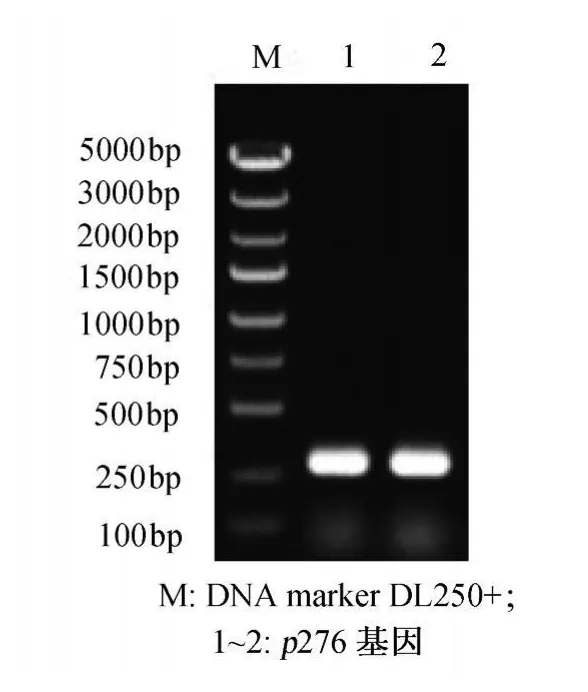
圖2 p276基因的PCR擴增
2.2 重組子pMV361-pbp39的鑒定
提取PCR鑒定陽性菌質粒,用EcoR I、Hpa I進行雙酶切,得到4415bp的pMV361和1206bp的pbp39 2個片段,基因片段與設計大小相符 (圖3)。
2.3 重組質粒pMV361-pbp39-p276的PCR鑒定
提取篩選的陽性菌pMV361-pbp39-p276質粒,分別用 pbp39、p276基因片段的上下游引物,及 pbp39上游引物和p276下游引物進行PCR,擴增得到大小約1200bp、270bp和1500bp的3條帶,大小與目的DNA及復合DNA片段長度相符。表明pbp39-p276復合基因已克隆入pMV361載體中 (圖 4)。

圖3 重組子的酶切鑒定

圖4 重組子pMV361-pbp39-p276的PCR擴增鑒定
3 討論
布氏桿菌為兼性胞內寄生菌,有光滑和粗糙2種表型,主要通過鼻、咽、口腔感染動物。如其他胞內寄生的致病菌,布魯氏菌不僅能逃避巨噬細胞的殺傷作用,且能在巨噬細胞內復制。宿主只有通過激發抗原遞呈細胞分泌IL-12,引起THD細胞分化為THI細胞,THI細胞再分泌IFN-γ來上調巨噬細胞的吞噬作用[4],才能激活巨噬細胞的殺菌功能。同時,CD4+,CD8+T細胞分泌的IL-2,IFN-γ還能直接殺滅被布氏桿菌感染的巨噬細胞,達到保護宿主的目的[5]。因此在抵抗布氏桿菌的免疫反應中,細胞免疫占主導地位。作為保護性抗原分子的PBP39胞質結合蛋白,是一種良好的T細胞抗原,幾乎存在于所有的布氏桿菌基因組中,具有較高的同源性,能保證良好的免疫原性,且PBP39在動物體內能誘發強烈的遲發性超敏反應,并產生大量的IFN-γ,因此被公認為DNA疫苗的候選分子。
pMV361大腸桿菌-分枝桿菌穿梭表達載體是在pMV261基礎上構建起來的,相對于pMV261,pMV361作為整合型表達載體將其oriM區域替換為attachment site(attP)和integrase(int)gene,使得pMV361能在宿主體內穩定存在[6]。而其表達宿主牛分枝桿菌弱毒苗 (BCG),在表達多種外源基因抗原的同時還是一種免疫佐劑,能非特異性的增加機體的免疫應答,增強免疫效果。且本身作為廣泛使用的結核病疫苗,能達到一苗多防的效果,不僅能同時防止布魯氏菌和結核病的感染,且能區分布魯氏菌病的疫苗株與野毒株,逐漸達到凈化布魯氏菌的目的。
綜上所述,本研究將標記p276基因和抗原pbp39基因聯合重組于pMV361大腸桿菌-分枝桿菌穿梭質粒,為下一步構建能分泌性表達pbp39-p276的重組卡介苗基因疫苗,研究其免疫原性和免疫保護性打下了基礎。
[1]王大力,李鐵鋒,王季秋,等.2009年全國布魯氏菌病監測結果分析 [J].中國地方病防治雜志,2010,25(6):419-421.
[2]滿騰飛,王大力,崔步云,等.2009年全國布魯氏菌病監測數據分析 [J].疾病監測,2010.25(12):944-946.
[3]丁家波,毛開榮,程君生,等.布氏桿菌病疫苗的應用和研究現狀[J].微生物學報,2006,46(5):856-859.
[4]Murphy A,Sathiyaseelan J,Parent M A,et al.Interferongamma is crucial for surviving a Brucella abortus infection in both resistant C57BL/6 and susceptible Balb/c mice[J].Immunology,2001,103:511-518.
[5]曾 政,王 英,趙光宇,等.布氏桿菌pCDNA3.1-L7/L12核酸疫苗的構建及免疫學評價[J].免疫學雜志,2004,20(3):208-212.
[6]Stover C K,de la Cruz V F,Fuerst T R,et al.New use of BCG for recombinant vaccines[J].Narure,1991,351:456-460.

