多因子誘導的殺傷細胞聯合白介素-2胸腔內注射治療癌性胸腔積液的臨床療效觀察
王 娟,陶貞霞,劉榮英,曹艷麗,國 虹,蔡秀萍,許衛星,王建華,吳秀然,李海玲
原發及轉移的肺部、胸膜腫瘤均可引起癌性胸腔積液。目前癌性胸腔積液多采用化療藥物胸腔內注射治療,部分應用免疫增強劑如香菇多糖、白介素-2等胸腔內注射治療[1-2],但采用以上方法治療多維持時間短,且對全身腫瘤無治療作用。我科采用多因子誘導的殺傷 (CIK)細胞培養后全身應用配合CIK細胞聯合白介素-2胸腔內注射治療癌性胸腔積液,取得了良好的治療效果,現報道如下。
1 資料與方法
1.1 一般資料 2008年6月—2010年12月我科收治的癌性胸腔積液患者15例,其中原發肺癌4例,乳腺癌肺轉移3例,彌漫性大B細胞淋巴瘤 (DLBCL)肺轉移3例,腎癌肺轉移3例,急性白血病2例,原發病均經手術切除后病理證實(急性白血病除外)。其中急性白血病、乳腺癌肺轉移、彌漫性大B細胞淋巴瘤及3例肺癌患者均應用常規化放療全身治療后效果不佳,1例原發肺癌患者拒絕再次應用化療,腎癌患者為手術后1.5~2.0年,未接受其他治療。
1.2 細胞培養過程 應用血細胞分離機(COBE,美國)分離患者外周血單個核細胞約3×109個,在百級無菌層流病房超凈工作臺上經去漿、Ficoll淋巴細胞分離液 (密度1.077 g/ml購于天津灝洋生物有限公司)分離單個核細胞,并應用RPMI-1640細胞培養液 (購于美國Gibco公司)洗滌2次 (1 500 r/min離心,15 min/次)后,加入細胞培養瓶中 (購于美國 Costar公司),放入37℃、5%CO2孵育箱中 (MCO-15AC日本三洋公司),2 h后將懸浮細胞移入另外培養瓶中,調整細胞濃度為2×106/ml,加入CD3單抗 (武漢生物制品研究所),γ-干擾素2 000 U/Ml(購于上海克隆生物高技術有限公司),計為D0天,D1天加入白介素-2 1 000 U/ml(購于北京雙鷺藥業有限公司)誘導CIK細胞,每隔2~3 d換液1次,加入同量γ-干擾素、白介素-2,同時抽取離心后的上清液行細菌、真菌培養,放至37℃、5%CO2孵育箱中繼續培養。
1.3 培養產品的回輸及鑒定
1.3.1 培養產品的回輸 在CIK細胞培養的 D11、D13、D15天,如細菌、霉菌培養陰性,活細胞>95%,分次給患者回輸。將培養瓶內的細胞懸液分裝入50 ml離心管中,1 500 r/min離心15min,去上清,加入含20 g/L人血清蛋白 (上海萊氏血液制品公司)的0.9%氯化鈉溶液洗滌2次,將最后得到的細胞懸液留取(0.5~1.0) ×109聯合白介素-2胸腔內注射外,將剩余細胞懸浮于250 ml含20 g/L人血清蛋白及白介素-2 2×105U的0.9%氯化鈉溶液中,回輸細胞數為 (1~3) ×109/次,通過輸血器經靜脈輸注,輸注前予10%葡萄糖酸鈣、苯海拉明防治過敏反應,記錄每次輸注CIK細胞后有無寒戰、發熱、過敏及心肺功能變化。細胞培養過程中及細胞輸注后患者應用白介素-2 200萬U肌注,隔日1次,α-2b干擾素300萬U肌注,隔日1次,總療程為40 d。
1.3.2 培養產品的檢定 細胞培養D0、D11、D13、D15天,經流式細胞儀 (FACS C
alibur美國BD公司)進行免疫表型測定,抽取培養物1 ml加入EDTA抗凝管,充分混勻,取50μl入流式細胞儀試管1~3,分別加入20μl鼠抗 IgG1-FITC/IgG2-PE/CD45-PerCP、CD3-FITC/-PE/CD45-PerCP、CD4-FITC/CD8-PE/CD45-PerCP(試劑購自美國BD公司),渦旋器充分混勻,避光孵育20~40 min,離心,磷酸鹽緩沖液 (PBS)洗滌,過濾后,加入PBS 300μl上流式細胞儀檢測。所用流式細胞儀FACSCalibur,數據獲取采用Cell Quest3.2,所用蒸餾水、PBS、紅細胞裂解液均經過0.2μm過濾網過濾,應用鼠抗人IgG1-FITC/IgG2-PE/CD45-PerCP為對照設置樣本非特異熒光,即陰性對照,應用淋巴細胞群的anti-CD4-FITC/CD8-PE/CD45-PerCP調節各熒光的補償值,然后進行細胞的測定及分析。
1.3.3 胸腔內注射 胸腔積液經B超定位后,盡量將胸腔積液抽凈后,注入CIK細胞 (0.5~1.5) ×109加入白介素 -2 100萬U,隔日1次,每療程3次。
1.3.4 T細胞亞群檢測 細胞免疫治療前后抽取患者靜脈血1 ml加入EDTA抗凝管,充分混勻,取50μl入流式細胞儀試管1~5,分別加入20μl鼠抗 IgG1-FITC/IgG2a-PE、CD3-FITC/-PE、CD3-FITC/CD4-PE、CD3-FITC/CD8-PE、CD3-FITC/CD16-PE+(試劑購自美國BD公司),渦旋器充分混勻,避光孵育20~40 min,離心,PBS洗滌,過濾后,加入PBS 300μl上流式細胞儀檢測。采用T細胞亞群自動分析軟件。
2 結果
2.1 不良反應 除11例患者有輕微發熱(體溫最高37.6℃,未用特殊處理自行降至正常)外,其他4例患者靜脈輸注過程順利無反應,15例患者第1次胸腔注射后均有局部疼痛、胸腔內燒灼感,第2次注射后癥狀減輕,所有患者均能很好地耐受該項治療。
2.2 CIK細胞培養過程中表型的變化經流式細胞儀分析表明,CIK細胞屬于異質細胞群,隨著培養時間的延長,CIK細胞中、雙陽性細胞的百分含量大幅度上升 (見表1)。
2.3 患者T細胞亞群的變化 治療后患者外周血T細胞亞群顯示、、、均有升高,NK細胞 (雙陽性細胞)較治療前明顯上升(見表2)。
表1 CIK細胞培養過程中表型的變化(±s,% ,n=15)Table1 The alteration of immunophenotype during the cultivation of CIK cells
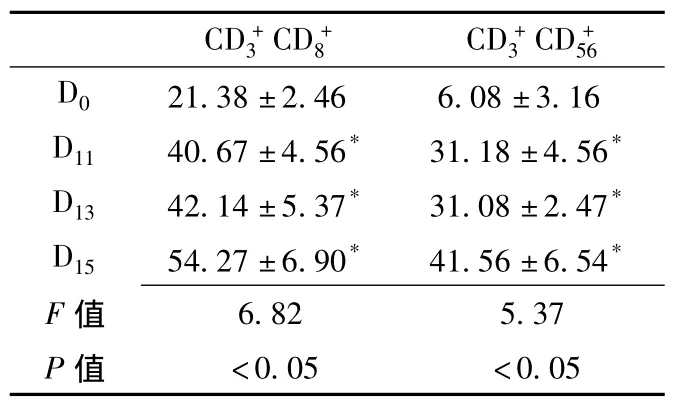
表1 CIK細胞培養過程中表型的變化(±s,% ,n=15)Table1 The alteration of immunophenotype during the cultivation of CIK cells
注:與D0比較,*P<0.01
CD+3 CD+8 CD+3 CD+56 D0 21.38±2.46 6.08±3.16 D11 40.67±4.56* 31.18±4.56*D13 42.14±5.37* 31.08±2.47*D15 54.27±6.90* 41.56±6.54*F 6.82 5.37 P值值<0.05 <0.05
2.4 療效 15例患者共經45個療程(每個療程間隔2~3個月),經1個療程治療后憋氣癥狀均明顯減輕,療程間隔期不需繼續抽取胸腔積液,14例患者2~3個療程后復查胸部CT,胸腔積液較前明顯減少,其中1例乳腺癌肺轉移患者治療2個療程后因加入其他藥物臨床協作組退出治療,1例急性白血病患者治療1個療程后因原發病復發,放棄治療自動出院,1例肺癌患者治療2個療程后出現肺內轉移轉腫瘤內科繼續治療,其余患者治療后2個月內不再接受化療及放療,現已隨訪6~28個月,病情呈穩定狀態。
3 討論
生物治療是目前治療腫瘤的重要措施,其中細胞免疫治療是研究的熱點之一。細胞免疫治療的研究始于20世紀80年代,人們陸續研究了淋巴因子激活的殺傷 (LAK)細胞、腫瘤浸潤淋巴 (TIL)細胞、CD3單克隆抗體 (單抗)激活的殺傷 (CD3AK)細胞等,體外研究均具有一定的殺瘤活性,但是由于細胞的擴增倍數低,細胞毒力不強,故其臨床應用受到很大的限制。1991年,Schmidt-wolf等[3]首先報道了 CIK細胞。它是將人外周血或骨髓單個核細胞在體外用多種細胞因子與CD3單抗共同培養一段時間后獲得的一組異質細胞,也稱自然殺傷 (NK)細胞樣T淋巴細胞,CIK細胞在外周血淋巴細胞中的比例為1%~5%。其主要效應細胞表面既有T細胞表面標志 (CD3),也有NK細胞表面標志 (CD+56),因而兼有T淋巴細胞抗瘤活性和NK細胞非人類主要組織相容性復合體 (major histocompatibility complex,MHC)限制性殺瘤的特點。應用CIK細胞治療因其可大量擴增,細胞毒活性強,可殺傷自體和異體多種腫瘤細胞,而且克服了過去過繼免疫療法的不足,如體外增殖數量少、需輸注白介素-2、低效及副作用大等,現已經成為腫瘤生物治療的一種新方法。CIK細胞具有很強的細胞毒活性,源于其較高的存活率和強大的增殖能力。CIK細胞對靶細胞的識別結合是非T細胞受體 (TCR)和非MHC限制的。目前關于CIK細胞殺傷靶細胞的原理尚未完全闡明,可能是通過黏附因子LFA/ICAM-1途徑與腫瘤細胞結合后,分泌含大量BLT酯酶的顆粒,這些顆粒能穿透靶細胞膜,導致腫瘤細胞的裂解[3];而且 CIK細胞還能分泌白介素-2,白介素-6,腫瘤壞死因子-α及粒細胞-巨噬細胞集落刺激因子 (GMCSF)等一些細胞因子,增強細胞毒作用;CIK細胞同時可以上調CD2、CD18等黏附分子的表達,增加效應細胞的免疫作用。此外,CIK細胞還可通過直接靶向腫瘤細胞進行殺傷或誘導其凋亡。
表2 免疫治療前后患者T細胞亞群的變化(±s,%,n=15)Table 2 The alteration of T cell subset in patients of pre-immunotherapy and after-immunotherapy
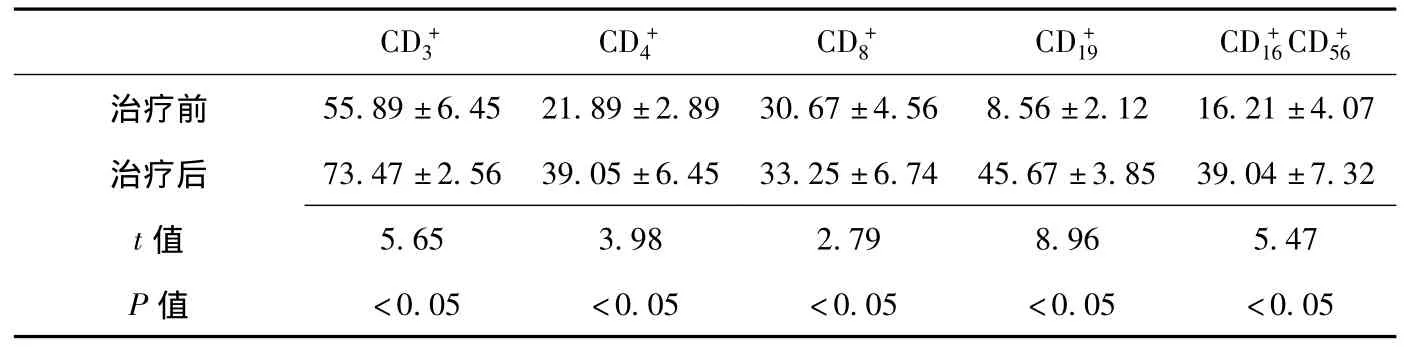
表2 免疫治療前后患者T細胞亞群的變化(±s,%,n=15)Table 2 The alteration of T cell subset in patients of pre-immunotherapy and after-immunotherapy
CD+3 CD+4 CD+8 CD+19 CD+16 CD+56治療前 55.89±6.45 21.89±2.89 30.67±4.56 8.56±2.12 16.21±4.07治療后 73.47±2.56 39.05±6.45 33.25±6.74 45.67±3.85 39.04±7.32 t 5.65 3.98 2.79 8.96 5.47 P值值<0.05 <0.05 <0.05 <0.05 <0.05
Schmidt- Wolf[3]和黃文榮等[4]研究均發現CIK細胞不是單一種類的細胞群,而是幾種細胞的混合群體。其主要細胞成分是細胞和細胞。CIK細胞來源于的T淋巴細胞在特定的細胞因子及環境下刺激形成,而不是體內原來就存在的細胞或的NK細胞。有實驗進一步證明CIK細胞主要來源于T淋巴細胞。T淋巴細胞又稱為細胞毒性T淋巴細胞 (CTL),主要作用是特異性直接殺傷靶細胞[5]。在本研究中,發現在細胞培養過程中,隨著培養時間的延長,除雙陽性細胞的百分含量大幅度上升外,雙陽性細胞的百分含量亦有明顯的上升。這種自身CIK細胞對自身及異基因腫瘤細胞均有殺傷作用,并且在體外大量擴增后回輸體內,不需同時用白介素-2,故副作用小,因此有潛在的臨床研究與應用價值[6]。在我們的前期研究中,應用血細胞分離機采集患者外周血單個核細胞,其中貼壁細胞培養樹突狀細胞 (DC),懸浮細胞培養CIK細胞,DC采用淋巴引流部位皮下注射,CIK細胞經靜脈全身輸注,該種治療與傳統的DC-CIK細胞混合培養后靜脈全身應用相比,避免了不成熟DC靜脈應用可能導致的免疫耐受,提高了治療效果[7]。由于DC、CIK細胞混合應用治療費用較高,對于經濟較困難患者,我們采用單純CIK細胞培養,并在以往惡性腫瘤類型研究的基礎上,進一步擴大了惡性腫瘤的類型 (如急性白血病等)及患者的治療例數,除將CIK細胞靜脈全身應用外,我們首次采用CIK細胞聯合白介素-2胸腔內注射直接到達患處殺傷腫瘤細胞,不僅患者治療前后外周血T細胞亞群顯示NK細胞雙陽性細胞)較治療前明顯上升,主動抗腫瘤的免疫功能提高,患者的臨床癥狀、影像學均提示病變較前好轉,提示該種治療方法對癌性胸腔積液是安全有效的,有良好的應用價值。

