N- {2-[(5-對氯苯基)-1,3,4-噻二唑基]}芳氧煙酰胺的合成研究
張 池,曹 肖,陳 卓樂慧慶,劉永鵬,龔銀香 (長江大學化學與環境工程學院,湖北荊州434023)
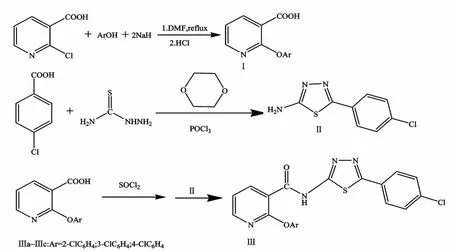
酰胺類除草劑是一類具有多作用靶點性質的農用化學品,在現代農田化學除草劑中占重要地位[1-3]。含氮雜環結構如吡啶、噻唑、三唑等由于具有廣泛的生物活性,在新農藥創制中發揮出越來越重要的作用,成為新農藥研究的熱點[4-6]。為了尋找具有新穎結構的農藥先導化合物,筆者采用活性基團拼接的方法[7],用2-氯煙酸合成出相應的芳氧基煙酸,再與1,3,4-噻二唑類化合物作用,得到3個未見文獻報道的含取代噻二唑的芳氧煙酰胺類化合物。其合成路線如下:
1 試驗部分
1.1 儀器與試劑
美國NICOLET6700FTIR鍺鏡面紅外光譜儀;美國Brucker AV 300型核磁共振儀,TMS為內標,CDCl3為溶劑;WRS-1A數字熔點儀。2-氯煙酸 (工業品,購自襄陽市金譯成精細化工有限公司,未純化);其他所用藥品均為分析純或化學純。
1.2 芳氧煙酸的合成
芳氧煙酸的合成步驟如下:在氮氣保護的條件下,將2.64g(0.11mol)的NaH加入到30ml DMF中,再加入5.27ml(0.06mol)的苯酚,混合均勻后,再加入7.88g(0.05mol)的2-氯煙酸,加熱回流20h,冷卻后,加入300ml水,用乙醚萃取除去未反應完全的酚,水層用鹽酸酸化,調節pH至2~3,攪拌18h,抽濾,水洗,得粗產品。用乙醇重結晶得純品。
1.3 2-氨基-5-對氯苯基-1,3,4-噻二唑的合成
在裝有溫度計、回流冷凝管和機械攪拌裝置的250ml四口燒瓶中,加入18.4g(0.20mol)干燥的氨基硫脲、100ml 1,4-二氧六環和31.3g(0.20mol)對氯苯甲酸。攪拌下滴加18.4ml(0.20mol)三氯氧磷,0.5h加完。緩慢升溫至80℃,攪拌反應0.5h后,繼續升溫至回流,再反應4h。反應畢,將1,4-二氧六環倒出,加入150ml水,冷卻至室溫,用50%氫氧化鈉溶液中和,調節pH值至9。待冷卻后過濾,濾餅經水洗,烘干得34.3g淡黃色固體。收率82.6%;mp:224~225℃。
1.4 目標化合物的合成
將0.01mol芳氧煙酸置于圓底燒瓶中,加入6ml二氯亞砜,電磁攪拌回流3~4h,減壓蒸去過量的二氯亞砜,在冰水冷卻下,加入10ml二氯甲烷溶解。將0.01mol的氨基噻二唑溶解于四氫呋喃中,滴入0.5ml三乙胺作縛酸劑。冰浴下將酰氯與氨基噻二唑混合,加熱攪拌回流3~4h,至無HCl揮發出為止。脫溶,抽濾,水洗得粗產品,用乙醇重結晶,得芳氧煙酰胺純品。目標化合物可溶于乙醇、DMF等有機溶劑,亦可溶于強酸強堿中。
2 目標化合物的理化性質和波譜數據分析
目標化合物的理化性質見表1。目標化合物的IR和1HNMR數據分別見表2和表3。在紅外譜圖中,所有特征基團均有明顯吸收。3350~3300cm-1之間有較強的N—H伸縮振動吸收單峰,為酰胺的特征吸收。1675~1680cm-1之間的強吸收峰是CO 的伸縮振動吸收峰,表明結構中有羰基存在。與一般酰胺結構中羰基峰比較,目標化合物的羰基吸收峰向低波數方向移動,主要原因是目標化合物中羰基與吡啶環連接,有較強的共軛效應。1,3,4-噻二唑環中CN 鍵的伸縮振動吸收頻率在1527~1573cm-1之間。芳氧基中醚鍵的伸縮振動吸收頻率在1246~1308cm-1之間。
在1HNMR譜圖中,由于羰基和1,3,4-噻二唑的強吸電子作用,CO—NH—Het結構中的NH的共振吸收位于低場,其化學位移大于15。由于吡啶環上氮原子和羧基的強吸電子作用,α位和γ位氫原子位于低場。

表1 目標化合物的理化常數

表2 目標化合物的IR測試數據

表3 目標化合物的1HNMR數據
3 關于合成條件的幾點討論
3.1 反應溶劑的選擇
由于2-氯煙酸β位有較大位阻,而芳氧基負離子作為親核試劑進攻能力不強,且自身體積較大,該反應需較高活化能,故需較高溫度。反應宜在高沸點溶劑中進行,常見溶劑為DMF和DMSO,由于DMSO在90℃易發生歧化反應,生成二甲硫醚和二甲基砜。二甲硫醚對環境有較大污染,故選取DMF為反應溶劑。
3.2 堿化試劑的選擇
芳氧基煙酸的合成方法采用Williamsom合成法,反應需要在堿性條件下進行。常用堿化試劑有K2CO3,NaOH,KOH,NaH等。K2CO3堿性較弱,弱酸性的苯酚與其作用不完全。NaOH和KOH堿性強且廉價易得,但與2-氯煙酸和苯酚反應時會生成水。水是一種親核試劑,且其體積小,反應時空間位阻小,有利于進攻吡啶環的2號位,產物將以2-羥基煙酸為主,不能得到芳氧基煙酸。NaH為強堿,但NaH中和酸和酚時不會生成水,避免了水的競爭反應,有利于酚氧基負離子對吡啶環的進攻。故筆者采用NaH為堿化試劑。
3.3 酸化條件
制備芳氧基煙酸時未反應完全的酚需要通過分離而除去。為此,在后處理中,酸化需分2步進行。首先,將體系酸化至pH=6左右。此時酚析出,而中間體芳氧基煙酸仍然以鹽的形式存在,此時用乙醚萃取以除去未能反應的酚。除去酚后,再將水相pH用鹽酸調節至2~3,此時芳氧基煙酸鹽轉化成芳氧基煙酸而從溶液中析出,經過濾、重結晶得純品。由于吡啶環氮原子顯堿性,若酸度較高時,酸易與吡啶環氮原子結合形成鹽,致使分離困難。故酸化時pH不能小于2。
3.4 關于目標化合物的合成
芳氧基煙酸的酰氯化試劑采用氯化亞砜。酰氯不需分離,可直接用于下一步反應。但酰氯若與氨基噻二唑直接作用,反應劇烈,有較多副產物,不易分離。故反應前先將酰氯和氨基噻二唑分別溶解在非質子溶劑二氯甲烷和THF中,冰浴下通過向酰氯溶液中滴加氨基噻二唑溶液完成反應。
[1]Frank J V,T homas A M,Elizabeth A W,et al.Benzopy ranopyridine derivatives.1.aminoalkyl derinatives of the azaxanthenes as bronchodilating agents[J].Journal of Medicinal Chemistry,1975,18(1):1-8.
[2]Goro A,Gerald B,Edward L M.Nitroheterocyclic antimicrobial agents.Ⅱ.5-Nitro-1,3,4-thiadiazole-2-carboxaldehyde derivatives[J].Journal of Medicinal Chemistry,1970,13(5):1015-1017.
[3]肖玲.兩類含多芳基氨的酰胺化合物的合成及生物活性研究 [D].武漢:華中師范大學,2008.
[4]慕長煒,覃兆海.吡啶類農藥研究進展[J].現代農藥,2003,2(2):1-6;2003,2(3):4-10.
[5]Yoshiaki N,Keiichiro N,Keiichi I.QSAR of larvicidal N-5-(substituted phenyl)-1,3,4-thiadiazol-2-yl]-benza-mides in the inhibition of N-acetylgluco-samine incorporation into a cultured integument system[J].Pestic Sci,1996,21:195-201.
[6]龔銀香,王子云,張正文,等.N-(2-羧基-1,3,4-噻二唑-5-基)-N′-芳酰基硫脲與芳氧乙酰基硫脲的合成與生物活性 [J].有機化學,2006,26(3):360-363.
[7]李志芬,張敏,崔利英,等.含吡啶環的 [1,3,4]噁二唑類化合物的合成及表征 [J].有機化學,2008,28(3):479-483.

