吸附共沉淀法分離鉬酸銨中的鎢
冷明鋒
(洛陽欒川鉬業股份有限公司,洛陽欒川 471500)
0 前言
眾所周知,鎢鉬同屬于第六副族元素,都是稀有高熔點金屬,由于鑭系收縮的影響,導致鎢鉬的離子半徑非常接近,原子結構及化學性質相似。在原生礦中,鎢鉬常為伴生元素,特別是以類質同象形式存在的鎢鉬,通過機械破磨等選礦方法根本無法分離,因此,鎢鉬的深度分離是當前鉬冶金中無法回避的現實。
在目前開展的鉬酸銨溶液分離少量鎢的研究方法中,萃取和離子交換都存在工序繁多,原則流程長的缺點,無論洗滌或是再生都會導致鉬的損失,而且廢水處理也存在一定的難度。堿石灰選擇性沉淀分離法操作簡單,但深度除鎢效果不是太理想,原因在于很難避免局部過飽和現象。吸附共沉淀法不但操作簡單,而且可以完全避免局部過飽和現象的發生,如果直接加入 Fe(NO3)3·9H2O不能達到預期目的,那么可以用 Fe(NO3)3·9H2O配制新生態Fe(OH)3,然后再加入。
本文主要研究了在鉬酸銨溶液中加入新生態Fe(OH)3和直接加入 Fe(NO3)3·9H2O在不同 pH條件下的吸附效果,用量及陳化時間對鎢鉬分離的影響。對于溫度而言,由于新生態 Fe(OH)3對W的吸附屬于典型的表面吸附,要求載體沉淀劑顆粒細小,表面積大,升高溫度 Fe(OH)3迅速團聚,明顯不利于吸附,同時沉淀迅速生成時,表面吸附的鉬來不及和構成吸附沉淀的鎢進行交換而被迅速生成的沉淀包圍起來,導致鉬的損失和對鎢的吸附能力降低。因此,實驗選擇在室溫條件下進行。
1 實驗部分
1.1 實驗原料
鎢酸銨溶液:用光譜純三氧化鎢配制而成鉬酸銨溶液:用鉬焙砂通過一次氨浸獲取
實驗原料:用上述 2種料液混合而成,鉬含量206.32 g/L,鎢含量 10 g/L。
1.2 設備
pH-3酸度計;772S型可見光分光光度計;電磁攪拌器;802W二米平面光柵攝譜儀;電子天平等。
1.3 分析方法
無干擾物質時,鎢鉬的分析均采用硫氰酸鹽 -分光光度法,鉬酸銨及產品中鎢的分析方法采用四苯砷氯鹽酸鹽 -硫氰酸鹽分光光度法,鉬酸銨產品中其他元素的分析采用 802 W二米平面光柵攝譜儀。
2 實驗結果與討論
2.1 不同 pH值條件下的吸附效果
分別取 200 mL實驗料液于燒杯中,用 HNO3調整溶液的 pH值,然后加入相當于 5 g Fe3+的新生態Fe(OH)3或緩慢加入相當于 5 g Fe3+的Fe(NO3)3·9H2O,攪拌、靜置各 1 h后過濾,濾渣經洗滌和低溫烘干后測定每克 Fe3+吸附W、Mo的毫克數(單位簡寫為 g/mg),其中新生態 Fe(OH)3對鎢的吸附編為 A組,新生態 Fe(OH)3對鉬的吸附編為B組,直接加入 Fe(NO3)3·9H2O對鎢的吸附編為 C組,直接加入 Fe(NO3)3·9H2O對鉬的吸附編為D組,測定結果見表 1。

表1 不同pH值條件下Fe(OH)3對鎢鉬的吸附量 g/mg
由表 1可以看出,無論是用新生態 Fe(OH)3或直接加入 Fe(NO3)3·9H2O對鎢鉬分離的效果都非常明顯,在 pH值 3.5~4.5之間,載體 Fe(OH)3只能吸附共沉淀鉬而不吸附鎢,同時對鉬的吸附達到最大值。隨著堿性的增強,對鉬的吸附量迅速降低,對鎢的吸附量逐慚增大,在 pH值 7.5~8.5之間達到最大值,此刻對鉬的吸附幾乎為零,可忽略不計,當 pH值進一步增大時,對鎢的吸附也迅速降低,證明鎢鉬分離的最佳 pH值范圍應在 7.5~8.5之間。根據新生態 Fe(OH)3和直接加入Fe(NO3)3·9H2O的實驗結果進行對比,證明直接加入 Fe(NO3)3· 9H2O的吸附效果明顯優于新生態 Fe(OH)3,因此后續實驗將控制 pH在 8左右直接加入 Fe(NO3)3·9H2O進行。
2.2 Fe3+用量及陳化時間的影響
根據表 1的實驗結果,最大吸附時的 Fe3+/W為 5.29,考慮到陳化時間對吸附共沉淀 Fe3+用量的影響,分別取 200 ml實驗料液于燒杯中,按 Fe3+與W質量分數比 4.5、5、5.5和 6這 4種比例進行陳化實驗,陳化時間分別取 5 h、8 h、12 h和 24 h,經過濾后取濾液化驗其中的鎢,換算鎢的去除率,測定結果見表2。
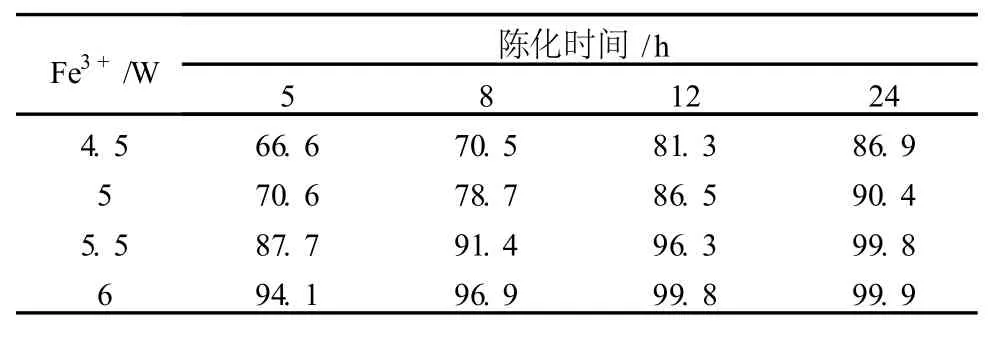
表 2 Fe3+的用量及陳化時間對鎢去除率的影響%
由表 2可以看出,無論是增大 Fe3+的用量或是增加陳化時間都能有效提高鎢的去除率,但與表 1中最大吸附時的 Fe3+/W相比,表 2的實驗結果明顯偏低,說明 Fe3+對鉬酸銨溶液中鎢的吸附不是成定量關系,而是隨著鉬酸銨溶液中W含量的降低Fe3+的吸附能力隨之降低,因此,在工業生產中應根據鉬酸銨溶液實際鎢含量來確定 Fe3+的用量。
為了進一步確定陳化效果,分別取 Fe3+/W= 5.5,陳化時間 12 h和 24 h,Fe3+/W=6,陳化時間8 h、12 h和 24 h各 100 mL濾液,依次編為 1、2、3、4、5號樣,通過蒸發結晶得到七鉬酸銨,送樣分析,分析結果見表3。

表3 陳化效果 mg/kg
從表 3可以看出,陳化時間應控制在 12 h以上,否則會導致產品中 Fe元素超標,這說明Fe(OH)3沉淀之初是以無定形膠體形態存在,需要12 h以上的陳化時間使其轉換為晶形沉淀。結合表2的實驗結果,晶型轉換的過程同時也是其表面吸附的鉬和構成吸附沉淀的鎢進行鎢鉬交換的過程, 2、4、5號樣都符合新國標零級品的標準。
3 結論
(1)吸附共沉淀法分離鉬酸銨中的鎢與萃取法、離子交換法和堿石灰分離法相比,具有明顯的優勢,不但操作簡單,產品符合新國標零級品的標準,而且成本極低,不會引入新的雜質。
(2)吸附共沉淀法分離鉬酸銨中的鎢應控制pH=8左右,只要控制好加入速度,可直接加入含Fe3+的鐵鹽。
(3)Fe3+對鉬酸銨溶液中鎢的吸附不是成定量關系,而是隨著鉬酸銨溶液中W含量的降低 Fe3+的吸附能力隨之降低,因此,在工業生產中應根據鉬酸銨溶液實際鎢含量來確定 Fe3+的用量。
(4)陳化時間對吸附效果的影響極大,使Fe(OH)3由沉淀之初的無定形膠體形態轉換為晶形沉淀的關鍵因素,晶型轉換的過程同時也是其表面吸附的鉬和構成吸附沉淀的鎢進行鎢鉬交換的過程。
[1] 劉能生,朱薇,肖連生.從鉬酸鹽溶液中分離微量鎢的研究進展[J].中國鉬業,2008,32(2):20-24.
[2] 向鐵根.鉬冶金[M].長沙:中南大學出版社,2009.
[3] 濕法冶金手冊編委會.濕法冶金手冊[M].北京:冶金工業出版社,2005.
[4] 有色金屬提取冶金手冊編委會.稀有高熔點金屬[M].北京:冶金工業出版社,1999.

