復方桂術膠囊對小鼠Lewis肺癌的抑制及TNF-α和IFN-γ的影響
張樹涌, 張 歌, 曹 勇, 張 娜, 宋 璟, 李可馨
(暨南大學醫學院中醫系,廣東廣州 510632)
復方桂術膠囊是由黃芪、肉桂、補骨脂、莪術、仙鶴草、半枝蓮、瓜蔞皮組成的中藥復方制劑,具有補腎益肺、化瘀解毒作用,臨床觀察表明,復方桂術膠囊方藥對中晚期肺癌和肺癌化療期及化療后康復期,具有改善臨床癥狀,減輕化療毒副作用,提高生活質量,降低復發轉移,延長肺癌患者生存期作用。復方桂術膠囊的前期研究表明其方藥對多種腫瘤均具有抑制作用[1-2],為了進一步證實其對肺癌的抑瘤作用,探討復方桂術膠囊抗腫瘤作用機理,以小鼠Lewis肺癌為模型,研究復方桂術膠囊對荷瘤小鼠的抑瘤作用,并觀察對其血清腫瘤壞死因子-α(TNF-α)和干擾素-γ(IFN-γ)的影響,從而為臨床運用復方桂術膠囊治療肺癌提供實驗依據。
1 材料
1.1 藥物 復方桂術膠囊:由暨南大學藥學院中藥制劑室提供,由黃芪、肉桂、補骨脂、莪術、仙鶴草、半枝蓮、瓜蔞皮組成,每粒裝 0.5 g,相當于生藥 2 g,批號,091014。
1.2 動物 SPF級C57BL/6J小鼠:6~8周齡,體質量18~22 g,雌雄各半,中山大學實驗動物中心提供,合格證號:SCXK(粵)2009-0011。
1.3 瘤株 小鼠Lewis肺癌:購于中國科學院上海細胞庫。
1.4 試劑 TNF-α及IFN-γ ELISA試劑盒:購于武漢博士德生物公司。
1.5 主要儀器 超凈工作臺:蘇州安泰空氣技術有限公司;倒置顯微鏡:日本Nikon;酶標儀:奧地利TZCAN公司。
2 方法
2.1 肺癌動物模型 在無菌條件下,取傳代10 d的Lewis肺癌瘤源小鼠,脫頸椎處死,無菌操作從腋部皮下剝取腫瘤組織,研磨后按1∶3比例加生理鹽水稀釋成瘤細胞懸液,并調整細胞濃度為1×107/mL,取C57BL/6J小鼠,每鼠0.2 mL右前肢腋部皮下注射。
2.2 動物分組及給藥 動物造模24 h后,稱質量隨機分為模型對照組,正常動物組,中藥高劑量組,中藥中劑量組和中藥低劑量組。每組10只,雌雄各半。分組后,模型對照組及正常動物組,灌胃等容積蒸餾水。復方桂術膠囊用蒸餾水稀釋,高劑量組按20 g/kg(為臨床成人日用量的10倍)灌胃給藥,中劑量組按10 g/kg(為臨床成人日用量的5倍)灌胃給藥,低劑量組按5 g/kg(為臨床成人日用量的2.5倍)灌胃給藥,每日1次,連續10 d。
2.3 肺癌抑制率的測定 第11天稱體質量并處死動物,解剖瘤體稱質量。按下式計算腫瘤抑制率:腫瘤抑制率=(對照組平均瘤質量-給藥組平均瘤質量)/對照組平均瘤質量×100%。
2.4 血清TNF-α和IFN-γ質量測定 第11天動物稱質量后,無菌條件下摘眼球取血,靜置4 h,離心分離血清,置-20℃冰箱備用。根據試劑盒操作說明,采用ELISA雙抗體夾心法,用全自動酶標儀檢測。
血清TNF-α檢測操作:① 分別將標本及不同濃度標準品加入96 孔板中(100 μL/孔),37 ℃ 孵育 90 min,洗板;②加入生物素抗體工作液(100 μL/孔),37℃孵育60 min,洗板;③ 加入酶結合物工作液(100 μL/孔),避光孵育30 min,洗板;④ 加入顯色底物100 μL/孔,37℃避光孵育10~15 min;⑤ 加入終止液100 μL/孔,混勻后即刻測量 OD450值。每個標準品和標本的OD值減去零孔的OD值,手工繪制標準曲線,以標準品濃度作橫坐標,OD值作縱坐標,以平滑線連接各標準品的坐標點。通過標本的OD值可在標準曲線上查其濃度。
血清IFN-γ檢測操作:① 按標準品稀釋方法加好標準品(100 μL/孔),在每個樣品孔中加入50 μL試劑稀釋液和50 μL樣本;② 在樣本和標準孔中加入50 μL生物素化抗體工作液,室溫(20~25℃)孵育120 min,洗板;③ 加入酶結合物工作液(100 μL/孔),室溫(20 ~25 ℃)孵育 60 min,洗板;④ 加入顯色底物100 μL/孔,室溫(20~25℃),避光孵育10 min;⑤ 加入終止液100 μL/孔,混勻后即刻測量OD450值。標準曲線繪制及同血清TNF-α。
2.5 觀察抑瘤作用 第11天處死動物后解剖瘤體稱質量,按下列公式計算瘤質量抑制率:腫瘤抑制率(%)=荷瘤模型空白對照組平均瘤質量-給藥組平均瘤質量)/荷瘤模型空白對照組平均瘤質量×100%。
3 結果
3.1 復方桂術膠囊對小鼠Lewis肺癌的抑制作用 結果見表1。
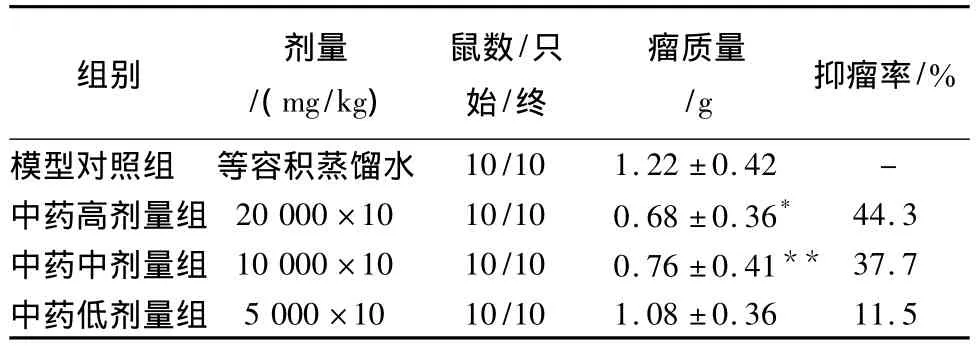
表1 復方桂術膠囊對小鼠Lewis肺癌的抑制作用
從表1可以看出,對小鼠Lewis肺癌,復方桂術膠囊高、中劑量組均有顯著的抑瘤作用(P<0.05),而低劑量組抑瘤作用則不顯著(P>0.05)。
3.2 復方桂術膠囊對小鼠Lewis肺癌血清TNF-α的影響結果見表2。
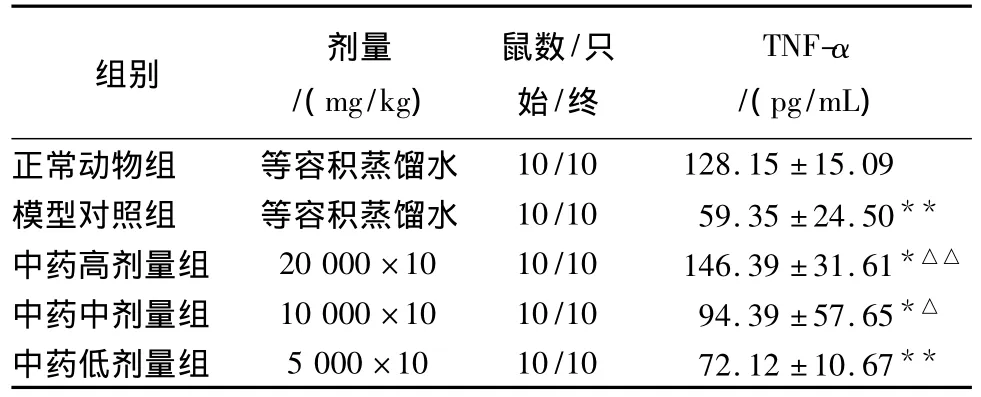
表2 復方桂術膠囊對小鼠Lewis肺癌血清TNF-α的影響
從表2可以看出,對Lewis肺癌小鼠血清TNF-α量,與正常動物組相比,模型組顯著降低(P﹤0.001),中藥高劑量組顯著升高(P﹤0.05),而中藥中劑量組與中藥低劑量組仍未升高至正常水平,二者有顯著性差異(P﹤0.05),尤以中藥低劑量組最為顯著(P﹤0.001)。與模型對照組比較,中藥高、中劑量組小鼠血清TNF-α水平均顯著升高,尤以中藥高中劑量組最為顯著(P﹤0.001),中藥低劑量組雖有所升高,但不明顯(P>0.05)。
3.3 復方桂術膠囊對小鼠Lewis肺癌血清INF-γ的影響結果見表3。
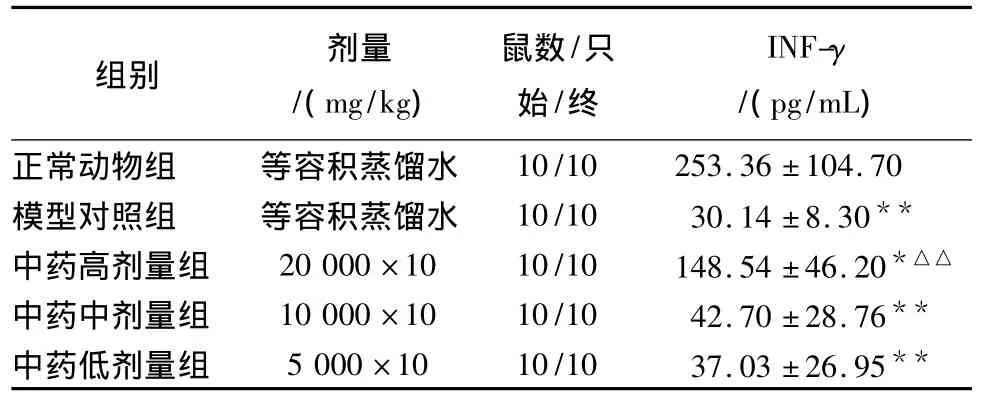
表3 復方桂術膠囊對小鼠Lewis肺癌血清INF-γ的影響
從表3可以看出,對Lewis肺癌小鼠血清INF-γ量,與正常動物組相比,模型組顯著降低(P<0.001),中藥高中低劑量組均顯著降低,尤以中藥中劑量組與中藥低劑量組降低最為顯著(P<0.001)。與模型對照組比較,中藥高劑量組小鼠血清INF-γ水平顯著升高(P<0.001),而中藥中劑量和低劑量組升高不顯著(P>0.05)。
4 討論
在腫瘤發生、發展過程中,細胞因子TNF-α與IFN-γ發揮著不可忽視的作用。目前,TNF-α、IFN-γ可作為腫瘤治療反應、治療機制和治療效果判斷的生物學指標[3]。
本實驗結果顯示復方桂術膠囊能促進TNF-α的產生,而且隨著中藥劑量的增大,血清中TNF-α水平顯著提高。TNF-α在腫瘤機體免疫功能中是非常重要的細胞因子,近年來被用于腫瘤細胞的凋亡及聯合化療藥物治療,被認為是與腫瘤惡化有關的細胞因子,與腫瘤惡病質有關,同時又是一種免疫調節因子,具有調節機體免疫功能作用[4-5]。TNF-α具有直接殺傷腫瘤細胞的作用,體現在某些磷脂酶、蛋白酶和核酸酶等,這些酶都是殺傷腫瘤細胞不可缺少的水解酶。而且,它還可以通過間接作用殺傷腫瘤細胞,例如阻斷腫瘤細胞血液供應,增加腫瘤血管內皮細胞的凝血活性,使血管內皮細胞受損,以及抑制血管內皮細胞遷移等[6]。本實驗結果還顯示,復方桂術膠囊高中低劑量組均能能促進IFN-γ的產生,但以中藥高劑量組最為顯著。IFN-γ與腫瘤發生、發展及轉移密切相關,有抗腫瘤細胞增殖作用,還有免疫調節作用,可介導T細胞對巨噬細胞的激活,并能直接增強巨噬細胞的殺傷能力;可誘導某些腫瘤細胞表達 MHC-Ⅱ和MHC-Ⅰ類抗原,促進靜止的CD4+T細胞變化為Th1細胞,并抑制Th2細胞的增殖,促進CD8+CTL的成熟,增強CD8+CTL和NK細胞的殺傷活性[7-8]。通過抑制腫瘤細胞的增生,改變腫瘤細胞表面的性能及誘發新的抗原而被免疫監視細胞識別并加以排斥,實現抗腫瘤效應和增強機體抗腫瘤能力。另外,IFN-γ還可通過血管內皮生長因子(vascular endothelial growth factor,VEGF)和堿性成纖維細胞生長因子(basic fibroblast growth factor,bFGF)基因轉錄發揮其抑制腫瘤血管生長的作用[9]。并且本實驗研究結果還顯示,復方桂術膠囊對小鼠肺癌具有顯著的抑制作用,表明復方桂術膠囊對動物肺癌的抑制與增強荷瘤小鼠細胞因子TNF-α、IFN-γ的免疫作用密切相關。
綜上所述,復方桂術膠囊不但能顯著抑制小鼠肺癌,而且能影響荷瘤小鼠外周血清TNF-α及IFN-γ細胞因子水平,從結果可以看出:隨著其劑量的增加,可使血清中TNF–α的水平明顯提高,而其還能顯著提高血清中IFN-γ的水平。這為臨床使用復方桂術膠囊抗癌機理從細胞因子水平上提供了一定的實驗依據。復方桂術膠囊的抑瘤作用,是否是其復方中的某些成分對腫瘤細胞具有直接的細胞毒作用,或是通過對細胞信號轉導通路發揮作用,具體的作用環節和作用機制有待進一步研究。
[1]曹 勇,孟 華,鐘安樸,等.化瘀破癥膠囊對裸鼠移植性人肺腺癌(LAX-83)的抑瘤增效作用[J].中國臨床康復,2005,9(26):165-166.
[2]曹 勇,張 丹,鄭廣娟,等.補腎化瘀解毒方對小鼠肝癌H22的抑瘤增效作用[J].中藥材,2004,27(1):38-40.
[3]余傳霖,葉天星,路德源,等.現代醫學免疫學[M].上海:上海科技大學出版社,1998:139-142.
[4]寧 軍,田麗軍.腫瘤壞死因子-α增強化療機制的研究進展[J].中國腫瘤,2006,15(9):608-610.
[5]胡赤丁,吳友勝,徐秀琴,等.癌癥惡病質與腫瘤壞死因子關系的臨床研究[J].腫瘤防治,2000,27(3):201-202.
[6]周振英,吳曉柳,朱月清,等.惡性腫瘤患者外周血細胞TNF-α和IFN-γ檢測的臨床意義[J].河南腫瘤學雜志,2003,16(3):158-161.
[7]孫衛民,王惠琴.細胞因子研究方法[M].北京:人民衛生出版社,1999:569-574.
[8]龐淑珍,王 旭.山仙顆粒對Lewis肺癌C57BL/6小鼠IFN-γ、TXB2和6-酮 -PGF1α影響的實驗研究[J].腫瘤基礎與臨床,2008,21(5):396-398.
[9]Tran P L,Vigneron J P,Pericat D,et al.Gene therapy for hepatocellular carcinoma using non-viral rectors composed of bis gnanidinium-tren-cholesterol and plasmids encoding the tissue inhibitors of metalloproteinases TIMP-2 and TIMP-3[J].Cancer Gene Threrapy,2003,10(6):435-444.

