補陽還五湯提高血管性癡呆大鼠海馬CREB、C/EBP的DNA結合活性
張泓波,高維娟,錢 濤,唐敬龍,李 君
(1.承德醫學院病理生理學教研室,河北 承德 067000;2.河北化工醫藥職業技術學院,河北 石家莊 050026;3.河北省人民醫院,河北石家莊 050051)
血管性癡呆(vascular dementia,VD)是由于各種腦血管病引起的獲得性認知功能障礙,以學習、記憶功能缺損為主要癥狀。目前,VD的發病呈迅速增長趨勢,其發病機制尚未明確。從中醫角度來看,VD的病機為氣虛血瘀。補陽還五湯是益氣活血中藥的經典方劑,目前在臨床上主要治療氣虛血淤所致的中風[1]。學習和記憶是腦的高級功能之一,其中樞位于海馬。核轉錄因子環磷酸腺苷反應元件結合蛋白(cAMP response element-binding protein,CREB)是學習和記憶形成的關鍵調節因子[2],磷酸化后的CREB可增強多種靶基因如即早基因(immediate-early genes,IEGs)的表達,從而使獲得的信息得以長期儲存。CCAAT/增強子結合蛋白(CCAAT/enhancer binding proteins,C/EBP)是一類與DNA增強子區域結合的轉錄調控因子,是IEGs的產物,在新記憶的永久化過程中具有促進作用[3]。本研究通過觀察補陽還五湯對VD大鼠海馬組織CREB、C/EBP DNA結合活性的影響,探討血管性癡呆的發病機制,為臨床防治VD提供理論依據。
1 材料與方法
1.1材料
1.1.1動物健康成年SPF級SD♂大鼠96只,鼠齡5~6個月,體質量(200±20)g,購自北京維通利華實驗動物技術有限公司,許可證號:SCXK(京)2007-0001。購買后,飼養于自然光線下,保持溫度20~25℃,自由進食進水,適應性飼養1周。
1.1.2藥物補陽還五湯購自承德北京同仁堂藥店分店:補陽還五湯原方(黃芪120 g,當歸尾6 g,赤芍 4.5 g,川芎3 g,桃仁3 g,紅花3 g,地龍3 g)水煎2次,煎液合并濃縮后使藥液濃度為含生藥6 250 g·L-1。尼莫地平為天津華津制藥廠生產(批號:080317),溶于雙蒸水制成2.5 g·L-1的混懸液。高壓滅菌,置4℃冰箱保存備用,用前混勻。
1.1.3主要試劑和儀器CREB及C/EBP寡聚核苷酸探針由上海英俊生物工程有限公司合成;核蛋白抽提試劑盒由美國Pierce公司提供;EMSA試劑盒購自德國Roche公司;帶正電荷的尼龍膜為美國Pall公司產品;戊巴比妥鈉購自德國。
Morris水迷宮(LW-Ⅱ型)由中國醫學科學院藥物所提供;DYY-6B型穩壓穩流電泳儀和24A型垂直板電泳裝置均由北京六一儀器廠生產;Quantity one凝膠分析系統由美國BIO-RAD公司提供。
1.2方法
1.2.1動物分組與造模用水迷宮將大鼠進行定位航行實驗和空間探索實驗,篩選出空間學習和記憶水平相當的大鼠,按體質量差異隨機數字表法分為假手術組(Sham operation)、模型組(VD model)、補陽還五湯組(BYHWT treatment)和尼莫地平組(Nimodipine treatment),每組24只。
VD模型組、補陽還五湯組、尼莫地平組采用改良的Pulsinelli's四血管阻斷(four-vessel occlusion,4-VO)方法[4]制備VD大鼠模型:用戊巴比妥鈉(50 mg·kg-1)行腹腔麻醉。將大鼠行背側頸正中切口,逐層鈍性分離暴露雙側第一頸椎橫突翼小孔,用直徑0.5 mm的電凝針燒灼雙側翼小孔內的椎動脈,造成永久性閉塞。24 h后再將大鼠麻醉,行腹側頸正中切口,鈍性分離雙側頸總動脈,用微動脈夾夾閉雙側頸總動脈5 min,共3次,每次間隔1 h。假手術組:只做皮膚切口和組織分離處理,不進行椎動脈燒灼和頸總動脈夾閉。
1.2.2給藥方法各組大鼠術后當天清醒開始灌胃給藥。補陽還五湯組:給予補陽還五湯50 g·kg-1·d-1;尼莫地平組:給予尼莫地平 20 mg·kg-1·d-1;模型組和假手術組均給予生理鹽水8 ml·kg-1·d-1。各組連續給藥 30 d。
1.2.3水迷宮檢測學習記憶能力各組給藥d 25~30,對大鼠進行水迷宮試驗。去除手術死亡及給藥不耐受者,每組大鼠各22只為最終統計對象。以給藥d 29大鼠逃避潛伏期(將大鼠從入水點面向池壁置入水槽中,記錄90 s內大鼠從入水到爬上平臺所需的時間)的平均成績作為學習成績;給藥d 30大鼠空間探索次數(撤去平臺,將大鼠從第二象限入水點放入水槽,記錄60 s內其經過平臺象限的次數)的平均成績作為記憶成績。逃避潛伏期越短、跨越臺次數越多,學習記憶能力越強。
1.2.4電泳遷移率改變分析法(electrophoretic mobility shift assay,EMSA)測定CREB、C/EBP的DNA結合活性水迷宮試驗后將各組大鼠迅速斷頭處死,在低溫修塊臺上分離出雙側海馬組織。稱重剪碎,勻漿棄上清。按核蛋白提取試劑盒提供的操作規程提取核蛋白。用BCA法進行蛋白定量后-80℃保存。設計 CREB DNA結合序列 :5'-AGAGATTGCCTGACGTCAGAGAGAGCTAG-3';C/EBP DNA結合序列5'-GATCAAGCTGCAGATTGCGCAAT-3'。探針標記參照DIG Gel Shift Kit操作手冊進行。標記反應結束后調整探針濃度為15.5 pmol·L-1。取各樣本核蛋白4 μg與標記的寡核苷酸探針2 μl 25℃孵育15min。采用6%非變性聚丙烯酰凝膠4℃ 80V電泳分離DNA-核蛋白結合體。電泳完畢將DNA-核蛋白結合體轉移到帶正電荷的尼龍膜,化學發光法檢測特異性條帶。經曝光、顯影和定影后將圖像掃描至電腦,用Quantity one 4.4凝膠分析軟件對特異結合條帶凈灰度值進行采集。凈灰度值代表轉錄因子與特定DNA的結合強度和活性。
1.3統計學處理實驗數據以±s表示,采用SPSS11.5統計軟件進行單因素方差分析。組間比較采用多樣本均數的One-way ANOVA檢驗。兩組均數比較采用q檢驗。
2 結果
2.1補陽還五湯對VD大鼠學習記憶能力的影響與假手術組術比較,模型組逃逸潛伏期明顯延長(P<0.05),跨越平臺次數明顯減少(P<0.05);與模型組相比,補陽還五湯組和尼莫地平組逃避潛伏期均明顯縮短(P<0.05);跨越平臺次數均明顯增多(P<0.05)。補陽還五湯組和尼莫地平組之間差異無顯著性(P>0.05),見Tab 1。
Tab 1 Comparision of rats'learning and memorizing ability in morris water maze test among four groups(±s,n=22)
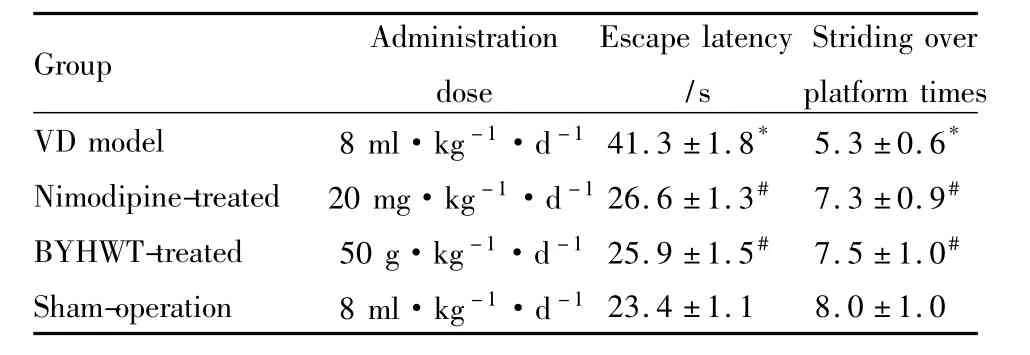
Tab 1 Comparision of rats'learning and memorizing ability in morris water maze test among four groups(±s,n=22)
*P<0.05 vs sham-operation group;#P<0.05 vs VD model group.
*Nimodipine-treated 20 mg·kg-1·d-126.6 ±1.3# 7.3 ±0.9#BYHWT-treated 50 g·kg-1·d-125.9 ±1.5# 7.5 ±1.0#Sham-operation 8 ml·kg-1·d -123.4 ±1.1 8.0 ±1.0
2.2補陽還五湯對VD大鼠海馬組織CREB DNA結合活性的影響經EMSA檢測和對特異性寡核苷酸與核蛋白的結合條帶的密度掃描和分析發現,各組大鼠海馬組織核提取物均有與預先設計的CREB DNA序列的結合:與假手術組比較,模型組大鼠海馬組織CREB的DNA結合活性明顯降低(P<0.01);與模型組比較,尼莫地平組與補陽還五湯組大鼠海馬組織CREB結合活性明顯升高(P<0.01);尼莫地平組、補陽還五湯組大鼠海馬組織CREB的結合活性之間差異無顯著性(P>0.05),見Fig 1。
2.3補陽還五湯對VD大鼠海馬組織C/EBP DNA結合活性的影響經EMSA檢測和對特異性寡核苷酸與核蛋白的結合條帶的密度掃描和分析發現,各組大鼠海馬組織核提取物均有與預先設計的C/EBP DNA序列的結合:與假手術組比較,模型組大鼠海馬組織C/EBP的DNA結合活性明顯降低(P<0.01);與模型組比較,尼莫地平組與補陽還五湯組大鼠海馬組織C/EBP結合活性明顯升高(P<0.01);尼莫地平組、補陽還五湯組大鼠海馬組織CREB的結合活性之間差異無顯著性(P>0.05),見Fig 2。
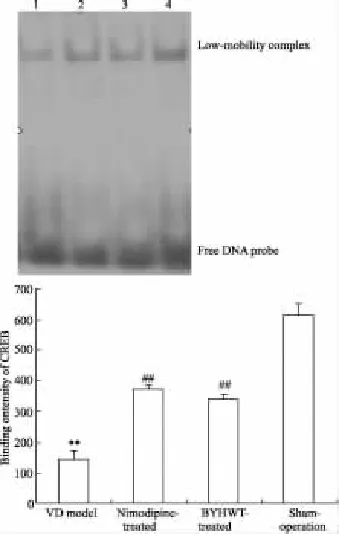
Fig 1 Comparision of CREB DNA-binding activity in rat's hippocampus among four groups(±s,n=8)
3 討論
VD為一慢性進行性疾病,反復缺血/再灌注和長期慢性低灌流是發病機制之一。本實驗制備模型所采用的改良的Pulsinelli's四血管阻斷法(4-VO),能較好得模擬人類因動脈粥樣硬化等血管疾病所致的VD而無明顯的肢體活動障礙,是國際公認的制備血管性癡呆模型的方法之一[5]。補陽還五湯方重用生黃芪,大補脾胃之元氣,令氣旺血行,瘀去絡通;當歸尾長于活血,有化瘀而不傷好血之妙;川芎、赤芍、桃仁、紅花助當歸尾活血祛瘀,地龍可通經活絡。有研究發現補陽還五湯具有降低興奮性氨基酸毒性、抑制細胞凋亡、促進神經細胞損傷的恢復、抑制自由基的產生及抗脂質過氧化、抑制細胞內鈣超載等對抗腦缺血/再灌注損傷作用[6]。本研究應用補陽還五湯治療后VD大鼠學習和記憶能力明顯提高,其作用機制有待深入研究。

Fig 2 Comparision of C/EBP DNA-binding activity in rat's hippocampus among four groups(±s,n=8)
長期記憶形成不但需要新蛋白質的合成,而且需要新基因的轉錄。Han等[7]確定影響記憶存儲的關鍵蛋白為CREB,可調節長時程增強(long term potentiation,LTP)和突觸可塑性相關的基因轉錄。本研究發現,海馬CREB的DNA結合活性與VD大鼠認知功能下降的程度呈正相關,表明CREB可能在VD大鼠學習記憶損害中發揮了作用。VD大鼠經補陽還五湯治療后CREB的DNA結合活性及學習和記憶能力明顯增強,其機制可能為補陽還五湯通過提高CREB的活性,在缺血性損傷后提供神經保護信號[8]。CREB對神經元的存活、分化、再生和修復起重要作用,如CREB磷酸化后不僅可調節即早基因如c-fos、c-jun等的表達,而且還調節抗凋亡和保護性蛋白分子(Bcl-2、降鈣素基因相關肽等)及神經營養因子(神經生長因子、腦源性神經營養因子等)的表達[9-10],從而實現對缺血性癡呆可塑性和學習記憶的保護。
C/EBP是CREB靶基因的產物,可進一步的激活晚期效應基因的表達,編碼長期調節突觸功能所必須的蛋白質,是記憶形成后的鞏固過程的重要因素[3]。在長時程記憶過程中,Ca2+和環磷酸腺苷(cAMP)依賴的信號轉導誘發了海馬神經元C/EBP的表達和DNA結合活性[11]。本研究發現VD大鼠海馬CREB及C/EBP結合活性的下降呈一致性,提示CREB介導的基因轉錄的抑制參與了血管性癡呆的形成。補陽還五湯改善VD大鼠學習和記憶功能的障礙可能是通過增強CREB介導的基因轉錄實現的。
在短暫大腦缺血/再灌注的早期,C/EBPβ促進了大腦的免疫損傷反應和神經元凋亡[12],其機制與誘導早期生長反應基因-1(Egr-1)及其下游基因纖溶酶原激活物抑制劑(PAI-1)血管內皮生長因子(VEGF)、細胞間黏附分子-1(ICAM-1)、白介素-1(IL-1)等有關[12-13]。最近研究發現 C/EBP 同源蛋白(CHOP)還參與了缺血后海馬神經元的內質網應激依賴性的細胞凋亡[14]。但是對于慢性腦缺血過程中C/EBP的作用研究比較少。本研究發現在缺血/再灌注損傷30 d后,模型組大鼠的C/EBP活性相對于假手術組下降,補陽還五湯治療后C/EBP活性較模型組升高,機制可能為CREB活性的增強促進了C/EBP的表達,從而加強了后者的活性。對于腦缺血/再灌注后期C/EBP介導的基因轉錄其效應分子為何以及它們在血管性癡呆中發揮怎樣的作用還需進一步探討。有人認為,腦卒中后早期的基因調節參與了神經細胞的存活和死亡,后期調節的基因可能與組織修復和功能恢復有關[12]。
[1]陳磐華,吳永杰,秦俊法.加味補陽還五湯治療血管性癡呆臨床研究[J].中國中醫藥信息雜志,2007,14(7):25 -6.
[1]Chen P H,Wu Y J,Qin J F.Clinical study of modified Buyanghuanwu Decoction in the treatment of vascular dementia[J].Chin J Inform Tradit Chin Med,2007,14(7):25 -6.
[2]Leutgeb J K,Frey J U,Behnisch T.Single cell analysis of activity-dependent cyclic AMP-responsive element-binding protein phosphorylation during long-lasting long-term potentiation in area CA1 of mature rat hippocampal-organotypic cultures[J].Neuroscience,2005,131(3):601 -10.
[3]Osada S,Yamamoto H,Nishihara T,Imagawa M.DNA binding specicity of the CCAAT/enhancer-binding protein transcription factor family[J].Biol Chem,1996,271(12):3891 -6.
[4]Schmidt-Kastner R,Paschen W,Ophoff B G,Hossmann K A.A modified four-vessel occlusion model for inducing in complete forebrain ischemia in rats[J].Stroke,1989,20(7):938 -46.
[5]趙 勇,崔淑芳,湯 球.血管性癡呆動物模型研究進展[J].上海實驗動物科學,2005,25(1):54 -8.
[5]Zhao Y,Cui S F,Tang Q.Recent research progress in animal models of vascular dementia[J].Shanghai Lab Animal Sci,2005,25(1):54-8.
[6]徐 晶,辛隨成,張青川.補陽還五湯治療缺血性腦血管病的研究進展[J].山西中醫學院學報,2009,10(4):73 -6.
[6]Xu J,Xin S C,Zhang Q C.The research progression of buyanghuanwutang on ischemic cerebrovascular disease[J].J Shanxi Coll Tradit Chin Med,2009,10(4):73 -6.
[7]Han J H,Kushner S A,Yiu A P,et al.Neuronal competition and selection during memory formation[J].Science,2007,316(5823):457-60.
[8]光紅梅,杜冠華.cAMP反應元件結合蛋白與神經退行性疾病[J].中國藥理學通報,2006,22(3):262-6.
[8]Guang H M,Du G H.Involvement of cAMP response element binding protein in neurodegenerative disorders[J].Chin Pharmacol Bull,2006,22(3):262 -6.
[9]李文聯,王 玲,張紅愛.Ca2+對新生大鼠腦缺氧缺血后CREB磷酸化及神經元凋亡的影響[J].第四軍醫大學學報,2004,25(3):217 -9.
[9]Li W L,Wang L,Zhang H A.Influence of Ca2+on the phosphorylation of CREB,and the relationship between pCREB and apoptotic neurons in neonatal rats after hypoxic-ischemia[J].J Fourth Mil Med Univ,2004,25(3):217 -9.
[10]任廣立,孫海宏,汪 洋,等.新生鼠缺氧缺血/再灌注后海馬p-CREB的表達[J].第四軍醫大學學報,2003,24(17):1578-80.
[10]Ren G L,Sun H H,Wang Y,et al.Expression of p-CREB in the hippocampal of neonatal rats after hypoxic-ischemia brain damage and reperusion[J].J Fourth Mil Med Univ,2003,24(17):1578-80.
[11]Yukawa K,Tanaka T,Tsuji S,Akira S.Expressions of CCAAT/enhancer-binding proteins beta and delta and their activities are intensified by cAMP signaling as well as Ca2+/calmodulin kinases activation in hippocampal neurons[J].Biol Chem,1998,273(47):31345-51.
[12]Kapadia R,Tureyen K,Bowen K K.Decreased brain damage and curtailed inflammation in transcription factor CCAAT/enhancer binding protein beta knockout mice following transient focal cerebral ischemia[J].Neurochem,2006,98(6):1718 -31.
[13]Lu A,Tang Y,Ran R,et al.Genomics of the periinfarction cortex after focal cerebral ischemia[J].Cereb Blood Flow Metab,2003,23(7):786-810.
[14]Osada N,Kosuge Y,Ishige K,et al.Characterization of neuronal and astroglial responses to ER stress in the hippocampal CA1 area in mice following transient forebrain ischemia[J].Neurochem Int,2010,57(1):1 -7.

