FHIT,Caspase-3及Survivin蛋白在結腸癌組織中的表達及其意義
常方芝,田字彬
(青島大學醫學院附屬醫院 消化科,山東 青島 266000)
結腸癌是消化系統最常見的腫瘤之一,其發生發展涉及多種癌基因的激活和多種抑癌基因的失活;與細胞凋亡的抑制,細胞的惡性轉化及轉化細胞的各種因子的平衡調控異常密切相關[1]。目前研究顯示,結腸癌是在抑癌及促癌等多種基因作用下的一種遺傳性疾病,常表現為結腸癌組織中的促癌基因表達上調或抑癌基因表達的缺失[2],其中FHIT(fragile histidine triad,FHIT)基因,Caspase-3及Survivin基因是參與細胞增殖及凋亡的相關基因或蛋白,與結腸癌發生、發展密切相關,但在結腸癌發生過程中相互調控的關系尚未明確,本文對FHIT,Caspase-3及Survivin蛋白在結腸癌組織表達情況及其相關性進行探討。
1 材料和方法
1.1 標本來源
收集青島市海慈醫療集團病理科2006年~2007年經手術治療的患者結腸癌組織及癌旁組織60例。患者男性26例,女34例,年齡37~79歲,平均(56±18.4)歲,標本均經病理診斷明確,具備完整病歷資料,所有患者術前無放化療治療史,無免疫抑制藥物治療史,未合并其它器官或系統的惡性腫瘤。
1.2 主要試劑及儀器
兔抗人多克隆FHIT、Survivin、Caspase-3抗體、非免疫山羊血清購于武漢博士德生物試劑有限公司;S-P通用試劑盒、DAB超敏顯色試劑盒購于北京賽遲生物有限公司;其它試劑由青島市海慈醫療集團中心實驗室提供。
1.3 染色方法
結腸癌組織及癌旁組織標本采用SP免疫組化染色三步法,石蠟包埋的病理組織切片冰盒冰凍3 min后,采用切片機2 μm厚度連續切片,常規展片、烘干,采用pH7.0的PBS緩沖液浸泡沖洗,微波修復暴露抗原,過氧化酶阻斷溶液,以阻斷內源性過氧化物酶的活性,采用無抗原性的非免疫山羊血清去除雜質干擾,滴加生物素標記的二抗,室溫下孵育,PBS沖洗,滴加鏈霉菌抗生物素-過氧化酶溶液終止反應,終止反應后采用DAB顯色,采用蘇木素復染,自來水沖洗返藍,常規脫水干燥、透明、中性樹膠封片。
1.4 結果判斷
切片觀察采用400倍光鏡放大,陽性細胞分析采用網格計數法,每張切片選擇5個不重復的視野,依據觀察到的細胞數目及染色細胞數目計算陽性結果,淡藍色背景下細胞不著色判定為陰性結果,淡藍色背景下細胞內棕黃色染色判定為陽性細胞,視野內陽性細胞占計數細胞總數比例<1/3為弱陽性,1/3~1/2為中等陽性,>1/2判定為強陽性。
1.5 統計學方法
采用SPSS17.0統計學軟件進行數據分析,計數資料比較采用卡方檢驗,相關性檢驗采用同斯皮爾曼相關性分析,檢驗水準α=0.05。
2 結 果
2.1 FHIT,Caspase-3及Survivin蛋白在結腸癌組織及癌旁正常組織的表達
FHIT蛋白主要表達在癌旁結腸黏膜和結腸癌組織細胞膜及細胞質中,陽性表達者可見淡藍色背景下顆粒樣棕黃色顆粒,表達強度以中等陽性及弱陽性為主,癌旁組織表達陽性率高于結腸癌組織(圖1、表1);Caspase-3蛋白主要表達在癌旁結腸黏膜和結腸癌組織細胞質及細胞核胞漿中,表達陽性者可見淺藍色背景下棕黃色顆粒樣染色,表達強度以中等陽性為主,癌旁組織表達陽性率高于結腸癌組織(圖2、表1);Survivin蛋白主要表達在癌旁結腸黏膜和結腸癌組織細胞質及細胞核胞漿中,陽性表達者淺藍色背景下可見棕黃色顆粒樣或團塊樣染色,癌旁組織表達陽性率低于結腸癌組織(圖3、表1)。
2.2 FHIT與Caspase-3蛋白在結腸癌組織表達的相關性
結腸癌組織60例中,FHIT與Caspase-3蛋白同時陽性表達者14例(23.3%),同時陰性表達者39例(65.0%),相關性檢驗結果顯示,結腸癌組織中FHIT與Caspase-3蛋白表達呈正相關關系(r=0.410,P=0.006)。
2.3 FHIT與Survivin蛋白在結腸癌組織表達的相關性
結腸癌組織60例中,FHIT與Survivin蛋白同時陽性表達者12例(20.0%),同時陰性表達者4例(6.7%),相關性檢驗結果顯示,結腸癌組織FHIT與Survivin蛋白表達呈負相關關系(r=-0.454,P=0.004)。
3 討 論
近年來,結腸癌的發病率呈現上升趨勢[3],結腸癌的發生同機體的抑癌因素及促癌因素失衡密切相關。研究顯示,在結腸癌組織,具有抑癌作用的細胞因子或蛋白質常表達缺失,而具有促癌作用的相關細胞因子出現高表達現象,其共同調控結腸組織的異常增生、癌變[4]。
FHIT基因是三聯體組氨酸家族成員,FHIT蛋白是FHIT基因基因編碼的生物活性蛋白,FHIT蛋白具有多種生物活性,并且參與體內細胞信號傳導,對細胞增殖具有抑制作用,能夠促進細胞的凋亡。在FHIT蛋白表達水平降低時,其能通過上調ATP類似物ApaA的表達減少水解發揮促進細胞增殖作用,抑制細胞的凋亡。同時FHIT蛋白水平下降能夠影響細胞內mRNA的穩定性,使mRNA容易發生突變及分解,其可能是導致結腸組織癌變的機制之一[5,6]。本研究中發現,與癌旁正常的大腸黏膜上皮相比,FHIT蛋白在大腸癌組織中不表達或僅少量表達,與文獻報告相似,說明它在大腸癌的進展過程中發揮重要作用,也有研究報道FHIT蛋白的表達缺失或減少與大腸癌的轉移和預后呈正相關[7],說明對結腸癌組織的FHIT蛋白的檢測對預后具有預測價值。近年來的研究顯示,FHIT基因位點能夠作為結腸癌基因治療的靶點[8],對結腸癌組織FHIT蛋白的檢測能夠為個體的結腸癌基因治療的可能性提供參考依據。
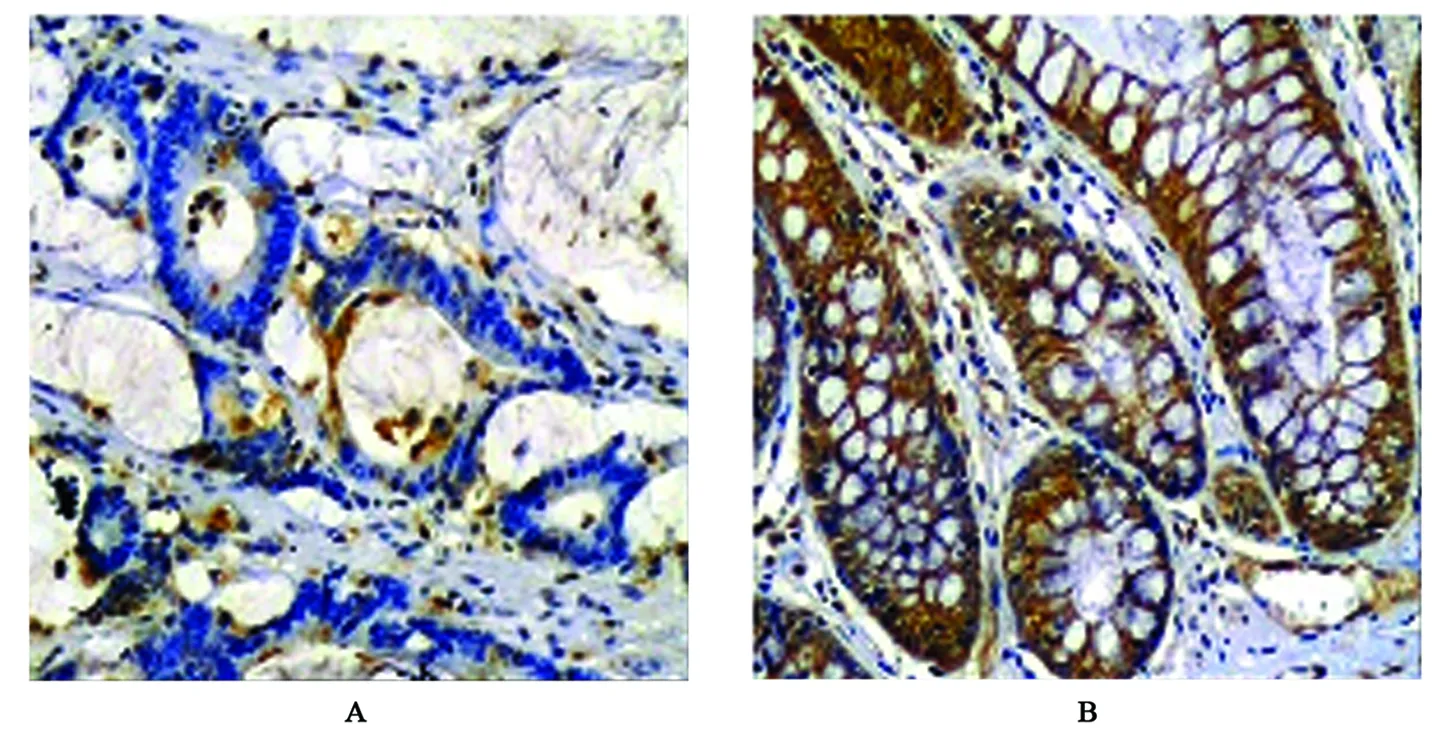
圖1 FHIT蛋白在結腸癌及癌旁組織中的表達(×400)
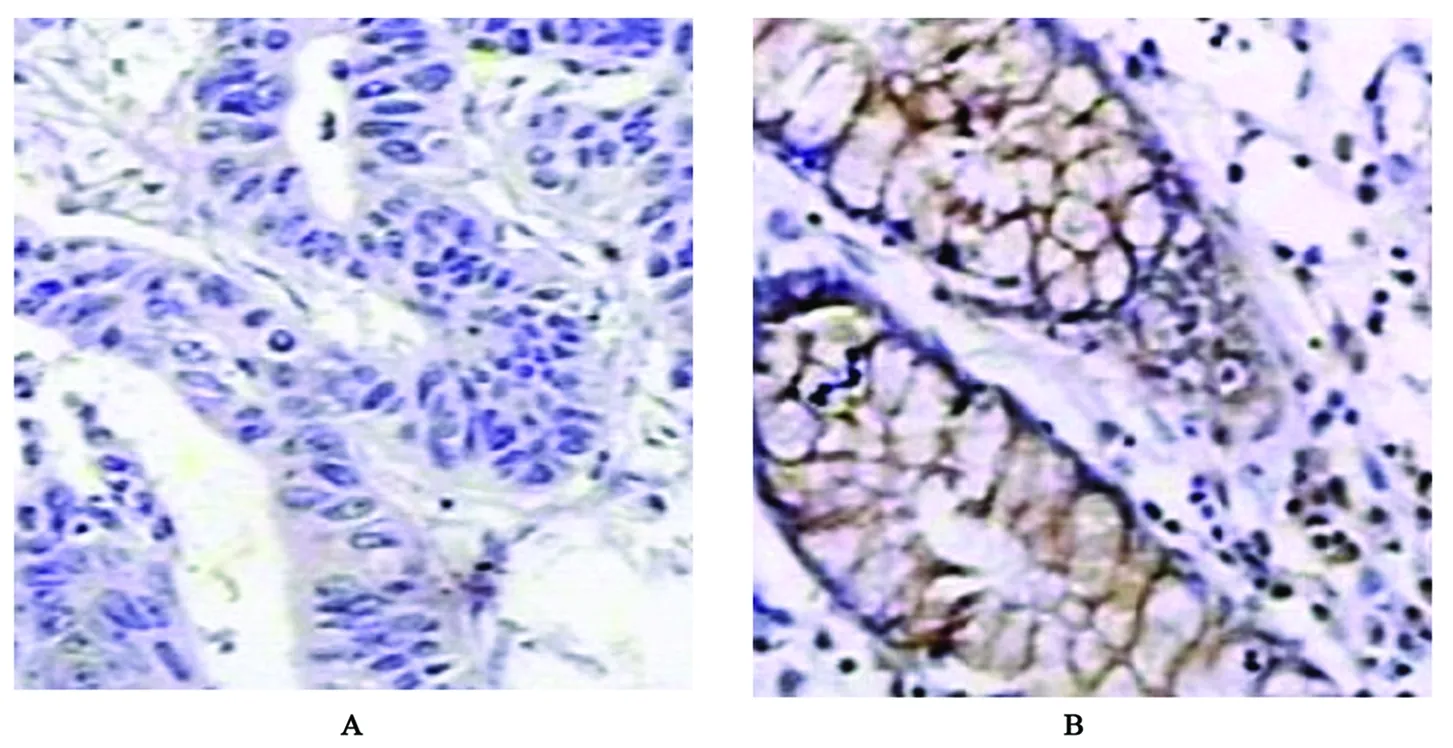
圖2 Caspase-3在結腸癌及癌旁組織中的表達(×400)
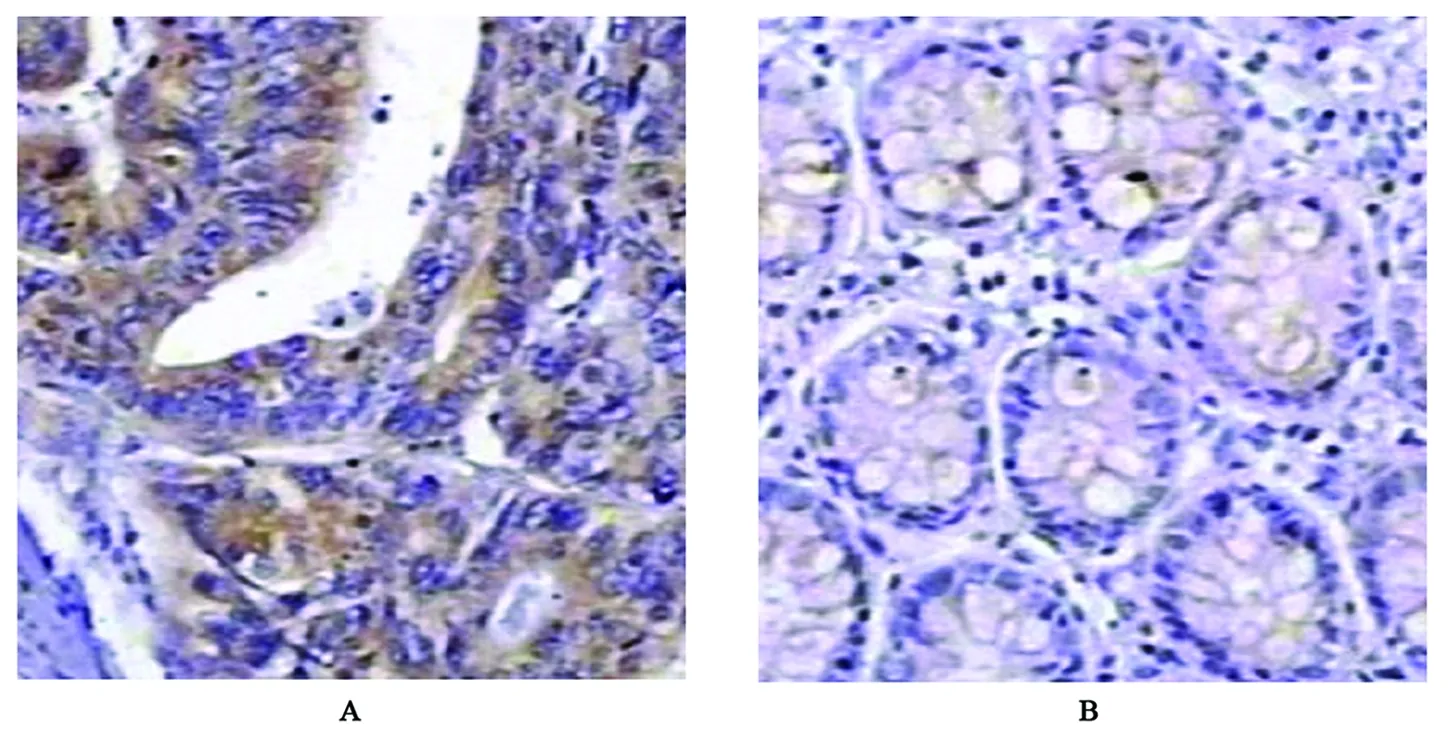
圖3 Survivin蛋白在結腸癌及癌旁組織中的表達(×400)
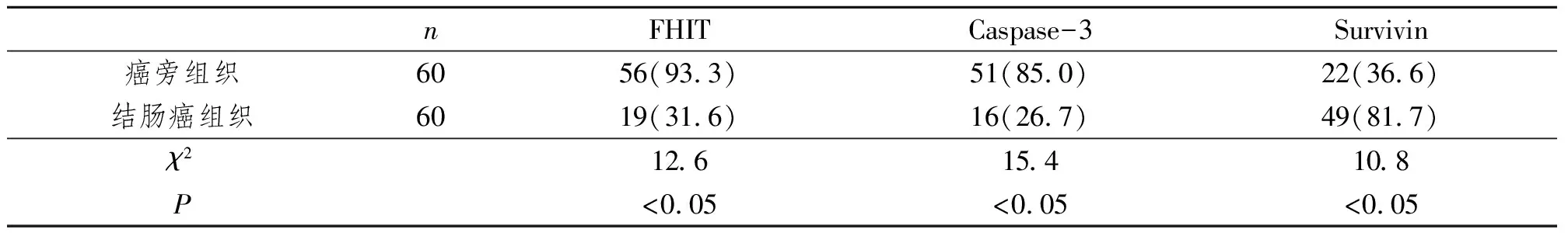
表1 FHIT,Caspase-3及Survivin蛋白在結腸癌及癌旁組織中的表達
Caspase-3蛋白是半胱氨酸蛋白酶家族成員,又稱細胞凋亡因子,在細胞凋亡的過程中起著關鍵性作用。其能夠通過對細胞凋亡的特異蛋白質剪切誘導細胞凋亡,同時能夠通過細胞外途徑接受細胞外環境中TNF、Fas等細胞凋亡信號的激活,引起細胞凋亡級聯反應[9],同時又能通過細胞內途徑接受線粒體細胞色素C的誘導激活細胞凋亡信號[10],誘導正常細胞及腫瘤細胞的凋亡,是機體控制細胞異常增殖,誘導細胞凋亡的主要機制之一。研究顯示,Caspase-3蛋白的低表達,細胞凋亡機制失控是結腸癌的發病機制之一。在對結腸癌組織Caspase-3蛋白表達與生物學特性的研究中發現[11],Caspase-3蛋白的表達缺失同結腸癌的分化程度有關,提示Caspase-3表達缺失同結腸癌的惡性生物學行為密切相關。體外細胞培養的研究發現,化療藥物奧沙利鉑能夠通過激活Caspase-3蛋白的表達發揮對腫瘤細胞生長的抑制[12],提示對Caspase-3蛋白編碼基因位點的干預可能成為腫瘤基因治療的新途徑。
Survivin蛋白又稱為細胞增殖因子,是凋亡蛋白抑制因子家族的成員之一,能通過與前凋亡蛋白Smac/DIABLO結合,拮抗其促凋亡活性[13],其能通過與細胞周期中的多個酶系作用,作用于細胞周期,抑制細胞凋亡,促進細胞的增殖,是迄今發現最強的凋亡抑制因子,可以調節細胞周期,還與血管生成有關,它幾乎在人類腫瘤中都有不同水平的表達。Survivin的過度表達是組織細胞異常增生的機制之一,Survivin蛋白在正常及惡變的組織表達存在較大的差異,在結腸癌組織,Survivin蛋白表達特異性地升高,而在癌旁正常的黏膜組織表達率極低或不表達[14],提示Survivin蛋白與大腸癌的發生、增殖密切相關。有研究顯示,結腸癌組織中Survivin蛋白的表達水平同結腸癌的生物學行為有關,在Survivin蛋白高表達的結腸癌組織,往往預示著其高度的惡性生物學行為[15]。Yamamoto T等[16]研究發現,應用天然的反義Survivin(EPR1)作用于人類結腸癌細胞株,不僅可下調Survivin蛋白的表達,減少細胞的增殖,而且增強凋亡作用,增加對抗癌藥物的敏感性。Rodel F等[17]通過研究Survivin基因在三種不同放射敏感性的直腸癌細胞株(SW480、HCT-15、SW48)以及54例直腸癌患者的表達,發現Survivin基因的表達與放射誘導的凋亡之間存在負相關,證明Survivin在直腸癌中是一個重要的凋亡抑制基因,這種差異表達使它有可能成為腫瘤診斷和預后的新標記及治療的新靶點。
研究發現在抑制細胞凋亡的過程中,Survivin基因通過阻斷線粒體細胞色素C釋放,直接抑制下游凋亡效應因子Caspase-3和Caspase-7起作用[18],經過與紡錘體纖維的結合,間接抑制caspase對紡錘體的水解作用,有利于保護有絲分裂細胞的完整性,抑制細胞凋亡。本實驗中對具有抑癌作用的FHIT及Caspase-3蛋白檢測發現,在結腸癌組織,FHIT及Caspase-3蛋白表達陽性率降低,在大部分結腸癌組織FHIT和Caspase-3蛋白的表達缺失,而對細胞增殖具有促進作用的Survivin在結腸癌組織存在過度表達現象,提示FHIT,Caspase-3及Survivin蛋白的表達缺失或上調參與結腸組織的癌變。同時相關性檢驗結果顯示,FHIT同Caspase-3和Survivin表達之間存在相關關系,說明在結腸癌的發病過程中,FHIT、Caspase-3蛋白低表達或表達缺失引起的細胞凋亡抑制及Survivin蛋白上調引起的細胞增殖活性升高共同發生影響,而非單一因素引起的細胞異常增殖或細胞永生化。有研究顯示Survivin能夠通過抑制Caspase-3表達發揮抗凋亡作用,在既往的研究結果中也證實,在惡性腫瘤組織中其與Caspase-3表達存在負相關關系[19]。FHIT基因能夠通過激活Caspases-8及Caspases-9引起Caspases酶介導的凋亡級聯反應[20]。說明FHIT,Caspase-3及Survivin蛋白之間在結腸癌發生的過程中可能存在相互調控的關系,共同介導結腸癌的發生過程,而對于結腸癌的基因靶向或生物學治療,也需要在多個基因位點或多個水平層次上進行。在結腸癌的臨床治療過程中,FHIT,Caspase-3及Survivin蛋白的聯合檢測,可能為其干預措施提供依據。
參考文獻:
[1] 張弦,孫興旺.抗凋亡因子Survivin與結腸癌關系的研究進展[J].實用癌癥雜志,2006,21(6):651-653.
[2] 葛永利,閻曉紅.Survivin基因與大腸癌的關系[J].內蒙古醫學雜志,2008,40(1):66-67.
[3] 沈默,曲宸緒,游偉程,等.北京市城區結腸癌發病率分布滯后預測模型研究[J].首都醫科大學學報,2008,29(4):501-504.
[4] 李日恒.FHIT和Caspase-3在結直腸癌組織中的表達及意義[J].臨床合理用藥,2009,2(17):1-2.
[5] Hao XP,Willis JE,Pretlow TG,et al.Loss of fragile histidine triad expression in colorectal carcinomas and premalignant lesions[J].Cancer Res,2000,60(1):18-21.
[6] 謝友利,柯尊富,朱潤慶,等.FHIT基因在大腸癌中的表達及其意義[J].數理醫藥學雜志,2004,17(2):116-117.
[7] Mady HH,Melhem MF.FHIT protein expression and its relation to apoptosis,tumor histologic grade and prognosis in colorectal adenocarcinoma:an immunohistochemical and image analysis study[J].Clin Exp Metastasis,2002,19(4):351-358.
[8] 余桂戎,張瑞,孟艷玲,等.抑癌基因Fhit重組腺病毒的構建表達及其在結腸癌細胞中的生物學功能[J].中國生物工程雜志,2010,30(1):7-11.
[9] Henning RS,Juliane M,Hwain S,et al.Pro-Caspase-3 is a major hysiologic target of Caspase-8[J].J Biol Chem,1998,273(42):27084-27090.
[10] Anichini A,Mortarini R,Sensi M,et al.APAF-1 signaling in human melanoma[J].Cancer Lett,2006,238(2):168-179.
[11] Larmonier CB,Amould L,Larmonier N,et al.Kinetics of tumor cell apoptosis and immune cell activation during the regression of tumors induced by lipid A in a rat model of colon cancer[J].Int J Mol Med,2004,13(3):355-361.
[12] 楊平,曹杰,王輝.奧沙利鉑誘導結腸癌細胞株SW480凋亡過程中caspase-8的活化[J].廣東醫學,2007,28(3):345-348.
[13] Song Z,Liu S,He H,et al.A single amino acid change (Asp 53->Ala53) converts Survivin from anti-apoptotic to proapoptotic[J].Mol Biol Cell,2004,15(3):1287-1289.
[14] Liang Q L,Wang BR,Li GH.DcR3 and survivin are highly expressed in colorectal carcinoma and closely correlated to its clinicopathologic parameters[J].J Zhejiang Univ Sci B,2009,10(9):675-682.
[15] Qi XL,Wang FL,Bo AH,et al.Expressions of MGMT and Survivin in colorectal carcinoma [J].Chin J Cancer Res,2008,20(2):139-143.
[16] Yamamot T,Manome Y,Nakamura M,et al.Downregulation of Survivin expression by induction of the effector cell protease receptor 1 reduces tumor growth potential and results in an increased sensitivity to anticancer agents human colon cancer[J].Eur J Cancer,2002,38(17):2316-2324.
[17] Rodel F,Hoffman J,Haas J,et al.Expression of Survivin in rectal cancer inversely correlated to apoptosis in vivo and may predict tumor response to neoadjuvant radiochemotherapy[J].Radiat Oncol,2002,54(2):99-100.
[18] Shin S,Sung BJ,Cho YS,et al.Anantiapoptotic protein human Survivin is a direct inhibitor of caspase-3 and caspase-7[J].Biochemistry,2001,40(4):1117-1123.
[19] 王佩飛,陳建武,鄭佩贊,等.Survivin、fhit在結直腸良惡性病變中的表達及意義[J].武漢科技大學學報(自然科學版),2007,30(4):423-425.
[20] Rhat UG,Raychaudhuri P,Beck WT.Functional interaction between human topoisomerase and retinoblastoma protein[J].Proe Natl Acad Sci USA,1999,96(14):7859-7864.

