水稻農桿菌轉化體系中共培養方法的優化
馬永光,于翠梅,楊 巍,徐振峰
(1.沈陽市農業科學院,遼寧沈陽 110034;2.沈陽農業大學,遼寧沈陽 110161;3.中國種子集團,遼寧沈陽 110034)
共培養從廣義上講是將2種生物在一起培養并使其發生相互作用。該文中的共培養是指用攜帶目的基因片段的微生物和植物的愈傷組織在一起進行培養,從而使微生物中的目的基因轉移到植物愈傷組織中,達到轉基因的目的。
農桿菌與外植體共培養常采用固體培養基,也可采用液體培養基,但應用較少。采用固體培養基時,可將外植體直接放在上面培養,也可在培養基上鋪1~2層濾紙,然后再放外植體進行共培養。放濾紙可控制外植體上農桿菌的過度增殖。該試驗通過對影響農桿菌轉化體系共培養的方法進行試驗比較,對以往的共培養方法進行了部分優化,并進行了比較。
1 材料與方法
1.1 植物材料
供試材料為水稻品種日本晴。
1.2 供試菌種
農桿菌(A.tumefaciens)采用攜帶有潮霉素抗性載體pCambial300,根癌農桿菌LBA4404。
1.3 外植體的獲得
取飽滿、色澤好的水稻種子,去殼,用無菌水簡單沖洗2遍后,用70%乙醇殺菌1.5 min,再用含有2.5%的次氯酸鈉殺菌15 min,其中每50 mL次氯酸鈉含有1滴吐溫20,最后再用無菌水清洗5遍。在N6D(加入2,4-D的N6培養基)誘導培養基上進行誘導培養(圖1)。將誘導培養10 d左右的愈傷組織有選擇地轉接到繼代培養基上(圖2)。采用26℃暗培養,時間控制在7~10 d,可出現大量狀態良好的愈傷組織。以后每10 d繼代1次,挑選色澤淡黃、質地細膩、柔軟的愈傷組織進行共培養。也可在誘導培養基上培養14 d左右,直接選取質量優良的愈傷組織進行共培養。
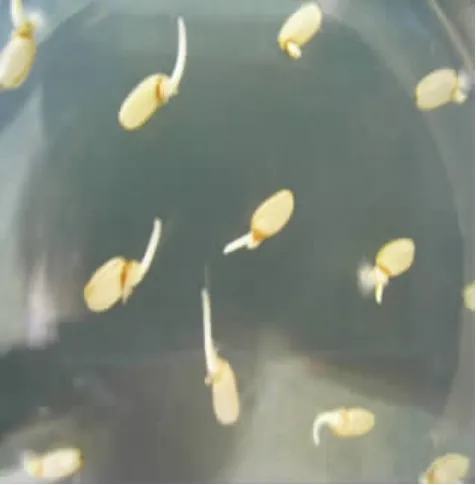
圖1 日本晴2.5%次氯酸鈉處理后培養4 d
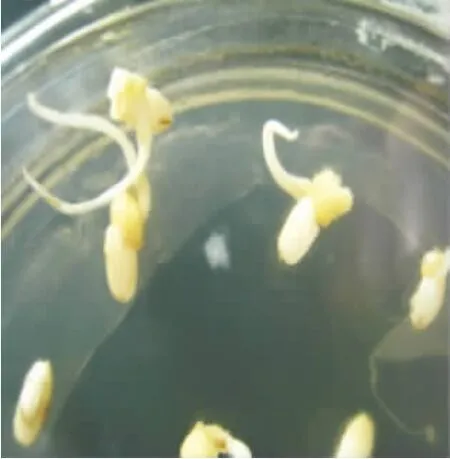
圖2 日本晴誘導培養10 d
1.4 農桿菌的培養
將含有目的基因載體的農桿菌在含有50 mg/L Kanamycin的YM平板上劃線,在28℃下暗培養3 d,用一金屬匙收集農桿菌菌體(一小撮即可),使之懸浮于AAM培養基中,調整菌體濃度至OD600近似等于0.1,加入AS,使其最終濃度為100 mol/L,即為共培養轉化水稻用的農桿菌懸浮液。
1.5 外植體與農桿菌的共培養
通常情況下,共培養時都用共培養基培養。該試驗在共培養時未采用共培養基,而是利用簡單的被0.5 mL AAM培養基浸濕的無菌濾紙,將侵染過后的愈傷組織轉移其上進行共培養。共培養時間要精確控制在2~3 d,時間短(共培養2 d以下),農桿菌侵染效果不明顯,則有部分愈傷組織未被侵染;共培養時間過長(3 d以上),愈傷組織易大量染菌,轉至篩選培養基上培養后,愈傷組織周圍會長出大量農桿菌,不利于篩選。
從繼代培養上挑選狀態較好的愈傷組織,一般是繼代培養5~7 d,顆粒分明,色澤淡黃,質地細膩柔軟的愈傷組織,放入100 mL無菌三角瓶中,加入適量農桿菌懸浮液(懸浮液的量要保證有足夠的菌液與材料相接觸),在室溫下放置20 min,并不時搖晃或放到搖床上慢搖。再倒掉菌液,將愈傷組織放在無菌濾紙上吸去多余的菌液。然后采取2種不同的共培養方法:①轉移到鋪有1層無菌濾紙的固體共培養基上(圖3a),28℃暗培養,時間嚴格控制在2~3 d之間,時間過短浸染效果不明顯,時間過長,愈傷組織染菌。②無菌濾紙用0.5 mL AAM培養液浸濕(圖3b),鋪在培養皿中,然后直接將侵染過后的愈傷組織在其上進行共培養。
2 d后轉至篩選培養基培養。篩選培養基采用含有50 mg/L的潮霉素和400 mg/L的羧芐青霉素的N6D培養基,對愈傷組織進行2次篩選,觀察2個篩選時間段上的效果和產生抗性愈傷組織的比率。
2 結果與分析
從圖3a與圖3b比較來看,在共培養階段,2種共培養方法中愈傷組織并無明顯差別。
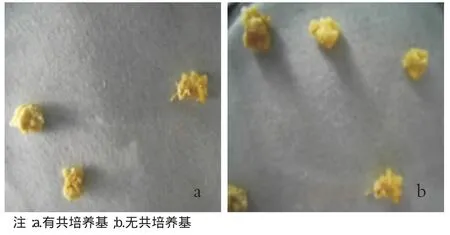
圖3 2種共培養方法的培養效果
篩選階段是通過藥品選擇抗性愈傷組織,愈傷組織成功轉化在這個階段就可以體現出來。這時,愈傷組織的生長狀態會發生明顯變化,非抗性愈傷會死亡,抗性愈傷會重新生長。2次篩選的愈傷組織的狀態如圖4所示。
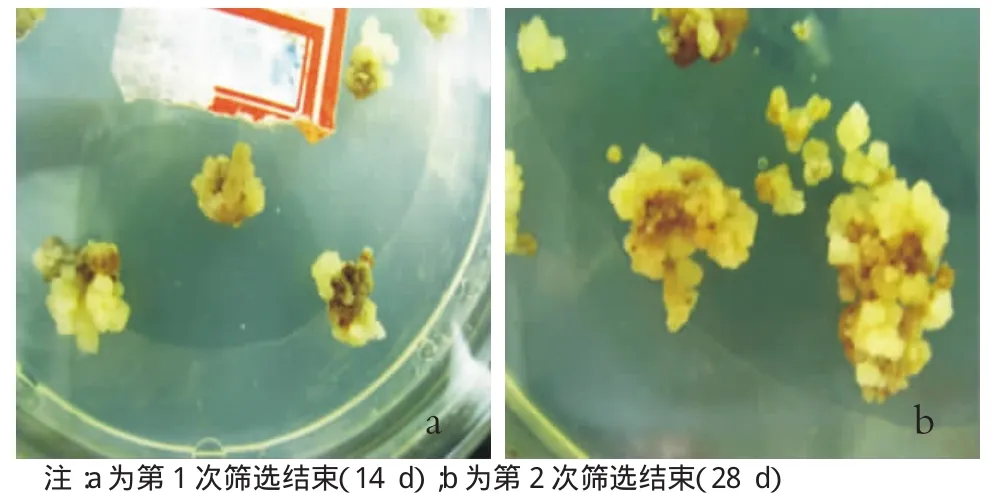
圖4 2次篩選的愈傷組織
將共培養后的愈傷組織放在含有50 mg/L潮霉素和400 mg/L的羧芐青霉素的篩選培養基上,28℃暗培養14 d,再轉到新配制的篩選培養基上繼續進行第2次篩選。大部分愈傷組織在篩選10 d左右褐化,然后在褐化組織的邊緣重新生長出乳白色的抗性愈傷組織。
通過培養效果比較及篩選培養過程中抗性愈傷組織的比例(表1)可以看出,采用2種方法共培養轉化愈傷組織,在篩選培養過程中都獲得了較高頻率的抗性愈傷組織。但是直接用濾紙的這種方法簡單易行,便于操作,利于控制愈傷組織染菌,客觀上利于增加產生抗性愈傷組織的比例。

表1 2種共培養方法下日本晴產生抗性愈傷組織的比率
3 討論
共培養階段是農桿菌介導遺傳轉化的關鍵時期,農桿菌對愈傷組織的侵染過程,也是農桿菌攜帶的基因片斷向愈傷組織細胞轉化的過程。共培養時間一般是2~3 d。通常在這個階段都將愈傷組織在農桿菌懸浮液中慢搖培養20 min后,吸干菌液,然后放到鋪有一層無菌濾紙的共培養基上培養。共培養基的作用是給愈傷組織提供足夠的營養。該試驗中,直接將懸浮培養后的愈傷組織放在浸有0.5 mL AAM液體培養基的無菌濾紙上培養,取得了更好的效果。
在愈傷組織與農桿菌共培養后,含有目的基因的T-DNA片段已轉移至受體細胞,并整合到受體細胞的基因組中,實現了外源基因。此時,農桿菌細胞和受體植物細胞同時增殖生長,而農桿菌的生長繁殖會嚴重影響受體植物細胞的生長。而直接用吸過農桿菌懸浮液的濾紙進行共培養,其過程時間短,濾紙中AAM液體培養基的營養就可維持愈傷組織的短期生長,同時客觀上有效控制了農桿菌繁殖數量,保護了植物細胞,不易出現愈傷組織過度染菌的現象,避免在篩選時加大抗生素用量所帶來的不良后果。
這種方法省去了配制固體培養基的大量繁瑣的工作,方法簡單易于操作,減少了污染機會,能夠保障試驗順利有效地進行,同時節省配制培養基的藥品,節約試驗成本。
利用農桿菌介導法進行水稻轉基因時,在共培養階段用浸有0.5 mL AAM培養液的無菌濾紙直接鋪在培養皿中,將侵染過后的愈傷組織在其上進行共培養,既能保證農桿菌侵染植物愈傷組織的質量,又能減少試驗污染,節約成本,簡便實用。
[1]裴中有,孫守鈞,李玲,等.農桿菌介導粳稻高效轉化體系的研究[J].華北農學報,2005,20(3):10-13.
[2]張毅,汪秀峰,李莉,等.農桿菌介導水稻幼胚轉化體系的建立[J].安徽農業科學,2004,32(4):637-639.
[3]段承俐,Carl Rathus.農桿菌介導轉化為目的的水稻組培體系的建立[J].西南農業大學學報,2001,23(6):527-531.
[4]王蘭,田華.根癌農桿菌介導的水稻遺傳轉化研究進展[J].安徽農業科學,2009,37(30):14594-14596.
[5]傅亞萍,斯華敏.農桿菌轉化花粉愈傷組織獲取純合的轉基因水稻植株[J].浙江大學學報,2001,27(4):407-410.
[6]尹中朝,楊凡.利用根癌農桿菌獲得轉基因水稻植株及其后代[J].遺傳學報,1998,25(6):517-524.
[7]駱開明.農桿菌介導的雙SBE基因RNAi載體對水稻的遺傳轉化[J].安徽農業科學,2008,36(7):2740-2742.
[8]王世權.農桿菌介導的水稻基因轉化[J].西南農業學報,1999(12)86-90.
[9]周玲艷,姜大剛,吳豪,等.農桿菌介導水稻轉化條件的優化[J].華南農業大學學報,2003,24(3):43-45.
[10]劉巧泉,張景六.根癌農桿菌介導的水稻高效轉化系統的研究[J].植物生理學報,1998,24(3):259-271.
[11]曹孟良.農桿菌介導的水稻高效遺傳轉化體系的建立[J].湖南農業大學學報,1999,25(5):349-356.

