南極磷蝦酶解工藝的研究
呂傳萍,李學(xué)英,楊憲時,遲 海,郭全友
(1.中國水產(chǎn)科學(xué)研究院東海水產(chǎn)研究所,上海 200090;2.上海海洋大學(xué)食品學(xué)院,上海 201306)
南極磷蝦資源豐富,據(jù)估計最高有數(shù)億噸之巨[1],具有極大的開發(fā)和利用潛力[2]。南極磷蝦營養(yǎng)豐富,蛋白質(zhì)、脂肪等營養(yǎng)物質(zhì)含量高,其肌肉鮮樣中含粗蛋白16.31%,粗脂肪1.30%[3]。Chen等[4]指出南極磷蝦蛋白所含的必須氨基酸含量可滿足FAO/WHO/UNU1985推薦的成年人對蛋白的攝入要求。南極磷蝦中含有豐富的礦物質(zhì)元素,包括鈣、磷、鐵、鋅、硒等[5],其中,鎂、鈣、磷3種元素均滿足美國農(nóng)業(yè)部推薦的人類各個年齡階段每日膳食營養(yǎng),還含有多種活性物質(zhì),如蛋白消化酶、類胞菌素氨基酸等。這些酶與磷蝦體內(nèi)的酶抑制系統(tǒng)結(jié)合使得南極磷蝦的消化系統(tǒng)非常強大,但是一旦其酶抑制系統(tǒng)遭到破壞,南極磷蝦即會自溶[6-8]。試驗以水解度為指標(biāo),探討添加中性蛋白酶酶解南極磷蝦的效果,通過試驗篩選南極磷蝦最優(yōu)酶解工藝條件,以期為南極磷蝦高值化加工利用提供理論依據(jù)。
1 材料與方法
1.1 材料
南極磷蝦由我國南極海洋生物資源開發(fā)利用項目組于2010年1月南極FAO 48.1區(qū)捕撈,2010年4月冷凍條件運抵實驗室,在-28℃條件下貯藏備用;枯草桿菌中性蛋白酶,實測酶活力145 733 U/g,(諾維信(中國)生物技術(shù)有限公司);木瓜蛋白酶,實測酶活力57 866 U/g,(上海江萊生物科技有限公司);硫酸銅、甲醛、氫氧化鈉、鹽酸等,均為國產(chǎn)分析純,(國藥集團(tuán)化學(xué)試劑有限公司)。
1.2 儀器與設(shè)備
CF 16XII高速冷凍離心機(jī)(日本Hitachi公司);電熱恒溫水浴鍋(上海精宏實驗設(shè)備有限公司);85-2恒溫磁力攪拌器(上海梅穎浦儀器儀表制造有限公司);FA1004A電子天平(上海精天電子儀器有限公司);testo 230 pH值/溫度測量儀(德圖儀器上海有限公司);DS-1組織搗碎機(jī)(上海精科實業(yè)有限公司);KDN-04定氮消化爐(上海嘉定糧油儀器有限公司)。
1.3 測定方法
改進(jìn)的Folin-酚法測定酶活力[9],總氮含量采用GB/T5009.5-2003凱氏定氮法,甲醛電位滴定法[10]測定氨基酸態(tài)氮(AAN)含量,水解度按如下公式[11-14]計算:

1.4 南極磷蝦自溶水解度分析
(1)自溶條件為固液比1:1(即取南極磷蝦勻漿15 g,加水15 mL),水解溫度50℃,水解時間分別設(shè)置在 0.5、1、1.5、2、2.5、3、3.5、4 h,測定不同溫度下的自溶水解度(自溶條件下的水解度),以確定50℃時的最佳水解時間。
(2)自溶條件同上,水解溫度設(shè)置為 3、20、30、40、50、60、70℃,水解時間為 4 h,測定不同溫度下的水解度,以確定在最佳水解時間時的最高水解溫度,從而確定南極磷蝦的最大自溶量。
1.5 蛋白酶酶解南極磷蝦的單因素試驗
選擇木瓜蛋白酶和枯草桿菌中性蛋白酶對南極磷蝦進(jìn)行酶解,酶解條件同上,分別以酶解時間(1、2、3、4、5、6 h)、 酶 解 溫 度(3、30、40、50、60、70℃)、酶添加量(0.1%、0.2%、0.3%、0.4%)、pH 值(6.0、6.5、7.0、7.5、8.0、8.5)為單因素,選擇各因素影響酶解的最適條件。
1.6 蛋白酶酶解南極磷蝦工藝流程及工藝條件優(yōu)化
南極磷蝦酶解工藝流程:凍南極磷蝦15 g→加水勻漿(按質(zhì)量比1∶1)→調(diào)節(jié)pH值→指定時間內(nèi)保溫酶解→滅酶(沸水浴10min)→冷卻→離心(11 000 r/min,5min,4℃)→南極磷蝦水解液。
酶解條件同上,選擇L9(3)4正交設(shè)計方案,以水解度為指標(biāo),著重研究酶解時間、溫度、pH值以及酶添加量4個因素對南極磷蝦蛋白水解效果的影響,并確定木瓜蛋白酶和枯草桿菌中性蛋白酶的水解工藝條件。
2 結(jié)果與分析
2.1 南極磷蝦最大自溶量的確定
圖1所示,南極磷蝦的自溶水解度隨著時間的延長而不斷升高,從第3 h開始水解度為(27.87±0.59)% ,3.5 h 時 為 (28.28 ±0.08)% ,4 h 時 為28.63%,自溶水解度增速放緩,這說明隨著時間的延長,南極磷蝦的自溶水解度上升空間較小,因此,本實驗設(shè)計中選擇南極磷蝦的自溶時間為4 h。
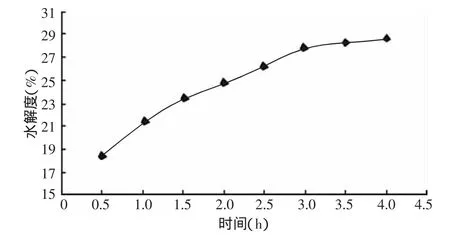
圖1 南極磷蝦在不同時間下的自溶水解度
圖2可得,在冷藏溫度3℃條件下,南極磷蝦仍有較強的自溶能力,自溶水解度為(16.59±0.30)%。2~50℃時,隨著溫度的升高,南極磷蝦自溶水解度不斷升高,50℃時達(dá)到最高值(28.11±0.16)%,50~70℃時,自溶水解度呈下降趨勢,且60~70℃時下降較快。這說明,南極磷蝦體內(nèi)的自溶酶在50℃時活性最高,小于50℃時,自溶酶活性隨溫度的升高而不斷升高;大于50℃時,自溶酶活性隨溫度的升高而降低,且下降速度較快。但即使是在70℃的高溫下,南極磷蝦的自溶水解度仍有(15.84±0.95)%,這說明南極磷蝦體內(nèi)自溶酶能適應(yīng)較大的溫度范圍,這與任艷等[15]的觀點一致。
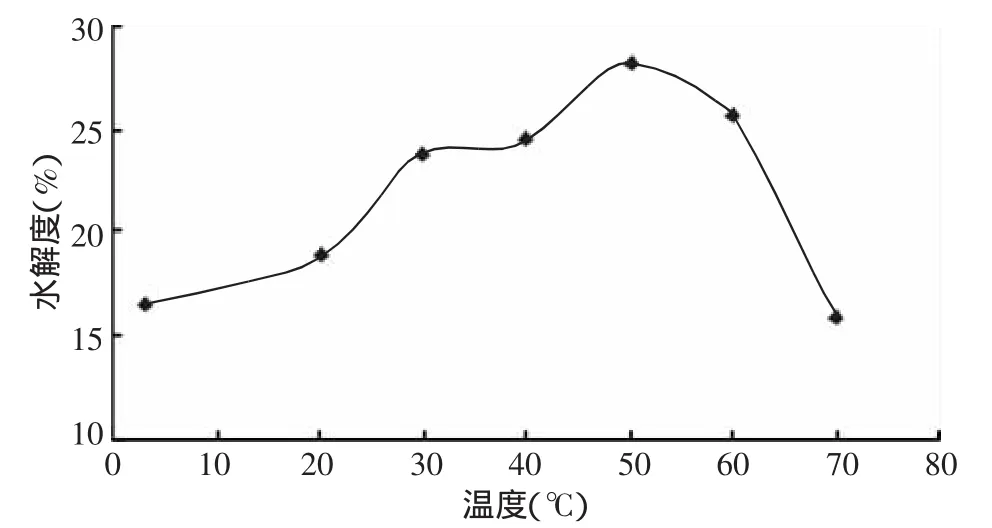
圖2 南極磷蝦在不同溫度下的自溶水解度
綜合圖1和圖2可知,南極磷蝦在50℃、自溶時間為4 h時,自溶水解度可達(dá)到28.63%。
2.2 中性蛋白酶酶解南極磷蝦的單因素試驗結(jié)果
2.2.1 時間對蛋白酶酶解南極磷蝦水解度的影響圖3所示,隨著時間的延長,蛋白酶酶解南極磷蝦的水解度不斷升高,1~4 h內(nèi)水解度升高顯著,4~6 h水解度變化不大,這說明水解4 h時,蛋白酶基本將南極磷蝦水解完全,為了準(zhǔn)確確定蛋白酶酶解南極磷蝦的時間,于是設(shè)置4、5、6 h為正交試驗的3個時間因素。
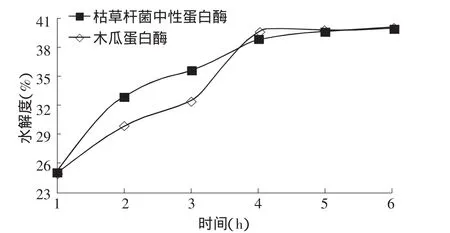
圖3 蛋白酶酶解南極磷蝦的水解度隨時間的變化
2.2.2 溫度對蛋白酶酶解南極磷蝦水解度的影響圖4所示,3~50℃時,隨著溫度的升高,蛋白酶酶解南極磷蝦的水解度不斷升高,50℃時達(dá)到最高,這是由于酶促反應(yīng)與一般化學(xué)反應(yīng)一樣,溫度升高速度加快;50~70℃時,水解度不斷下降,由于酶是一種蛋白質(zhì),隨溫度升高,酶蛋白逐漸變性失活,引起酶反應(yīng)速率下降。由圖中可知,在不同的酶解溫度下,枯草桿菌中性蛋白酶酶解南極磷蝦的水解度一直低于木瓜蛋白酶的水解度,為了更加準(zhǔn)確的確定蛋白酶酶解南極磷蝦的溫度,選取45、50、55℃為正交試驗的3個溫度指標(biāo)。
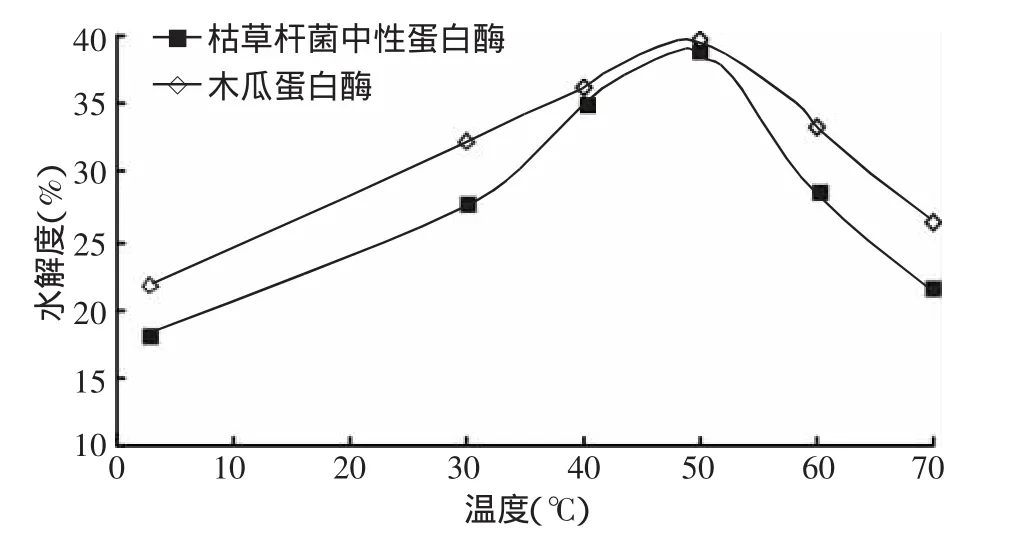
圖4 蛋白酶酶解南極磷蝦的水解度隨溫度的變化
2.2.3 pH值對蛋白酶酶解南極磷蝦水解度的影響
圖5所示,當(dāng)pH值在6.0~7.5范圍內(nèi)變化時,木瓜蛋白酶和枯草桿菌中性蛋白酶酶解南極磷蝦的水解度均在不斷升高,且木瓜蛋白酶的酶解效率一直高于枯草桿菌中性蛋白酶;當(dāng)pH值在7.5~8.5范圍內(nèi)變化時,兩種酶酶解南極磷蝦的水解度均下降,且木瓜蛋白酶水解效率下降更快,這說明,兩種中性蛋白酶酶解南極磷蝦時的最高水解度均出現(xiàn)在pH值為7.5而不是中性pH值為7.0,這可能是因為南極磷蝦體內(nèi)存在偏堿性的酶[16]。因此,選擇pH值 7.5最為臨近的pH值為7.0、7.5和8.0為正交試驗的3個指標(biāo)。
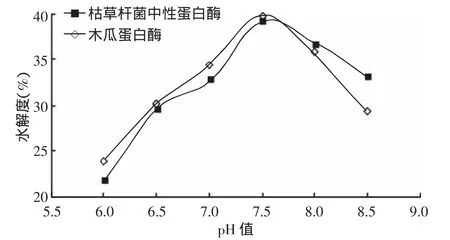
圖5 蛋白酶酶解南極磷蝦的水解度隨pH值的變化
2.2.4 酶添加量對蛋白酶酶解南極磷蝦水解度的影響 圖6所示,隨著蛋白酶添加量的不斷增加,南極磷蝦酶解率不斷升高,且酶添加量為0.1%~0.2%時水解度升高顯著;添加量為0.3%~0.4%時,蛋白酶水解南極磷蝦的水解度變化不大,其中木瓜蛋白酶的水解效率基本不變。因此,選擇0.2%、0.3%和0.4%為正交試驗酶添加量的3個指標(biāo)。
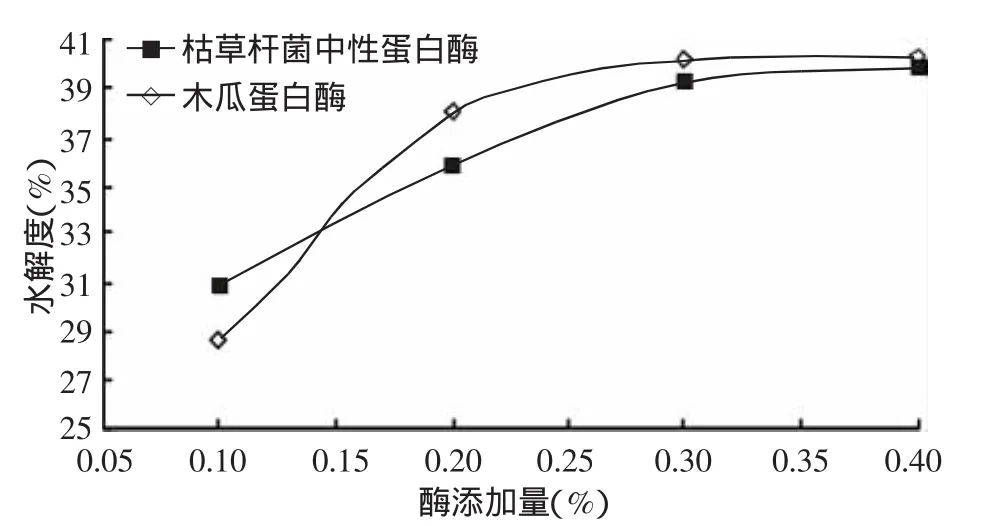
圖6 蛋白酶酶解南極磷蝦的水解度隨酶添加量的變化
2.3 蛋白酶酶解南極磷蝦最佳工藝研究條件
由表1和表2可以看出,影響木瓜蛋白酶和枯草桿菌中性蛋白酶水解南極磷蝦的各因素的主次順序均為酶解溫度、pH值、酶解時間和加酶量。木瓜蛋白酶水解南極磷蝦的最優(yōu)工藝為酶解溫度50℃、pH值 7.5、酶解時間5 h、酶添加量 0.3%,此條件下水解度達(dá)(42.17±0.17)%;枯草桿菌中性蛋白酶酶解南極磷蝦的最優(yōu)工藝為酶解溫度50℃、pH值 7.5、酶解時間5 h、酶添加量0.4%,水解度達(dá)(41.86±0.23)%。由此可知,木瓜蛋白酶對南極磷蝦的酶解能力略高于枯草桿菌中性蛋白酶的,但是木瓜蛋白酶水解南極磷蝦后的酶解液中脂類懸浮物較多,不易于分離,枯草桿菌中性蛋白酶水解南極磷蝦后的酶解液澄清透明易于分離。

表1木瓜蛋白酶酶解南極磷蝦L9(34)正交設(shè)計方案及試驗結(jié)果
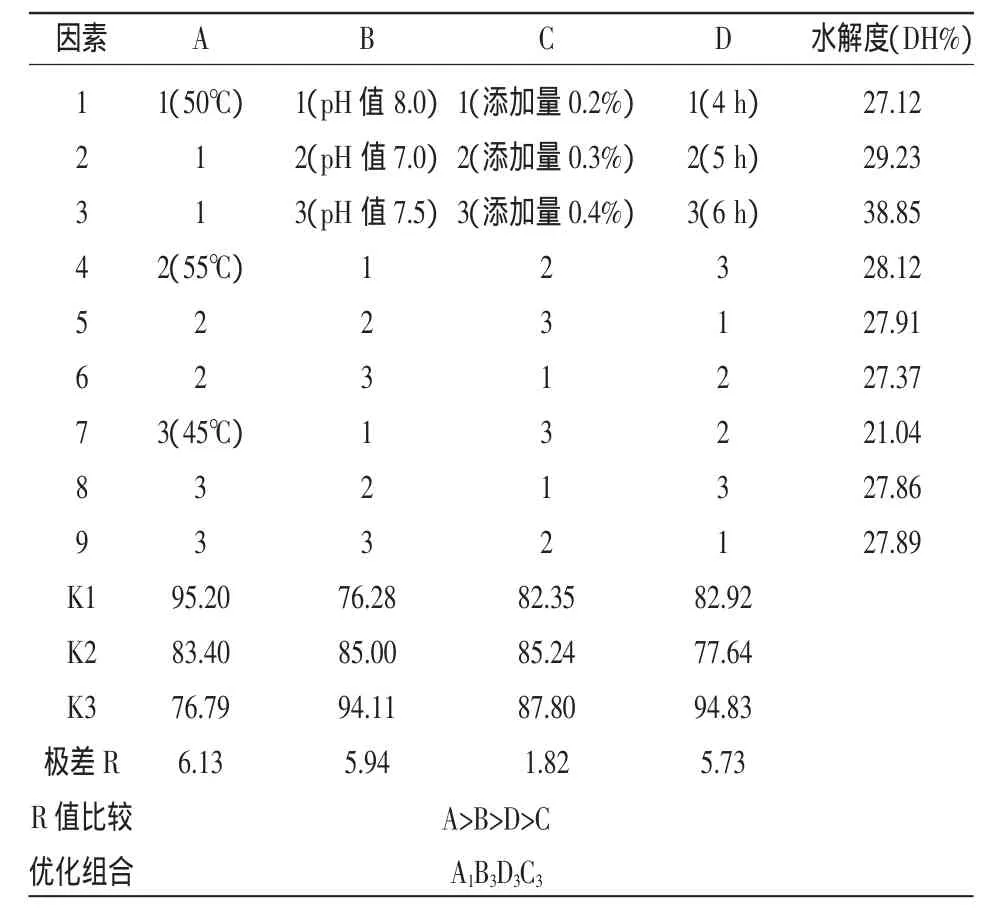
表2 枯草桿菌中性蛋白酶酶解南極磷蝦L9(34)正交設(shè)計方案及試驗結(jié)果
3 結(jié)論
試驗確定了南極磷蝦自溶最適溫度為50℃,自溶時間為4 h,自溶水解度為28.63%。單因素試驗和正交試驗證明添加中性蛋白酶可顯著提高南極磷蝦水解度,因此可以通過添加中性酶來水解南極磷蝦,以實現(xiàn)南極磷蝦食用的目的。同時,試驗確定木瓜蛋白酶水解南極磷蝦的最優(yōu)工藝為酶解溫度50℃、pH值 7.5、酶解時間6 h、酶添加量 0.3%,此條件下水解度達(dá)(42.17±0.17)%;枯草桿菌中性蛋白酶水解南極磷蝦的最優(yōu)工藝為酶解溫度50℃、pH值 7.5、酶解時間6 h、加酶量0.4%,此條件下水解度達(dá)(41.86±0.23)%。
[1] 吳偉平,謝營樑.南極磷蝦及磷蝦漁業(yè)[J].現(xiàn)代漁業(yè)信息,2010,25,(1):10-13.
[2] 劉 麗,劉承初,趙 勇,等.南極磷蝦的營養(yǎng)保健功效以及食用安全性評價[J].食品科學(xué),2010,31(17):443-447.
[3] 孫 雷,周德慶,盛曉風(fēng).南極磷蝦營養(yǎng)評價與安全性研究[J].海洋水產(chǎn)研究,2008,29(2):57-64.
[4] Chen Y C,Tou JC,Jaczynski J.Amino acid and mineral composition of protein and other components and their recovery yields from whole Antarctic krill(Euphausia superba)using isoelectric solubilization/precipitation[J].JFood Sci,2009,74(2):31-39.
[5] 朱元元,尹雪斌,周守標(biāo).南極磷蝦硒及礦質(zhì)營養(yǎng)的初步研究[J].極地研究,2010,22(2):135-140.
[6] Bustos R O,Romo C R,Healy M G.Purification of trypsin-like enzymes from Antartic krill processing wastewater[J].Process Biochemistry,1999,35:327-333.
[7] Newmwn S J,Dunlap W C,Nicol S,et al.Antartic krill(Euphausia superba)acquire a UV-absorbing mycosporine-like amino acid from dietary algae[J].Journal of Experimental Marine Biology and Ecology,2000,255:93-110.
[8] Sj o dahl J,Vincent J.Characterization of proteinases from Antarctic krill(Euphausia superba)[J].Protein Expression and Purification,2002,26:153-161.
[9] Kamarudlin M S,Jones D A,Vay L L,et al.Ontogenetic change in digestive enzyme activity during larval development ofmacrobrachium rosenbergii[J].Aquaculture,1994,123:320-324.
[10] 張 恒,鄔應(yīng)龍.雞骨的酶解及酶解液的電泳分析[J].食品與發(fā)酵工業(yè),2010,36(9):102-105.
[11] 林 孌,陳麗嬌.文蛤肉復(fù)合酶分步酶解工藝的研究[J].食品科學(xué),2009,30(9):158-162.
[12] 陳文芳,左偉勇,李 倬,等.伴大豆球蛋白的酶解研究[J].安徽農(nóng)業(yè)科學(xué),2009,37(7):2835-2837.
[13] 吳少輝,葉偉娟,于 新.酶法水解鰱魚蛋白及活性碳脫腥苦的工藝研究[J].廣東農(nóng)業(yè)科學(xué),2010,37(11):182-185.
[14] 馬燕燕,魯曉翔.響應(yīng)面優(yōu)化酶法提取柿葉黃酮的工藝研究[J].安徽農(nóng)業(yè)科學(xué),2010,(19):10251-10254.
[15] 任 艷.南極磷蝦蛋白加工利用的初步研究[D].青島:中國海洋大學(xué),2009.
[16] Osnes K,Mohr V.Peptide hydrolases of Antarctic krill(Euphausia superba)[J].Comp Biochem Physiol,1985,82(4):599-606.

