重組質粒介導hTGF-β1基因在體轉染模型動物椎間盤髓核細胞的表達
謝延平 劉利 劉振武 顏繼英 楊朝暉 劉炳智 江麗強
近年來隨著分子生物學等相關學科的飛速發展,基因工程作為一種治療手段越來越被廣泛應用于外科領域。該項目的研究,就是運用當今的分子生物學技術,采用重組質粒載體基因轉染模型動物腰椎間盤髓核細胞,定量的觀察基因的有效表達,從而為椎間盤退變的基因治療提供實驗依據。
1 材料與方法
1.1 材料 重組質粒DNA(15 μl TGF-β1 cDNA,克隆在 EcoRⅠ位點,購于上海第二軍醫大學微生物實驗室),質粒快速提取試劑盒(購于北京鼎國生物技術有限公司),大腸桿菌JM109菌液(購于上海生工生物技術有限公司),EcoRⅠ內切酶、蛋白Marker(購于北京鼎國生物技術有限公司),胰蛋白胨、酵母提取物、瓊脂粉(購于美國sigma生物技術有限公司),TGF-β1兔抗兔一抗(購于武漢博士德生物技術有限公司),IgG鼠抗兔二抗(購于北京中山生物技術有限公司)。
1.2 構建椎間盤退行性變的動物模型 選擇健康成年的新西蘭大白兔21只,雌雄不拘,用20%的烏拉坦4 ml/kg靜脈注射麻醉實驗動物后,采用腰椎側前方倒八字手術入路,于腹膜外顯露腰椎間盤,用髓穿針于 L3~4,L4~5,L5~6間隙各注入 20 μl 0.9%氯化鈉溶液,并于L3~4所對應的腰大肌處以黑色絲線做標記,術后8周隨機處死1只實驗動物,檢測退變程度。
1.3 重組質粒DNA的擴增與提取 采用劃痕法在平板培養基上接種大腸桿菌JM109菌液,37℃過夜培養,挑選單菌落于液體培養基中37℃劇烈搖震培養至OD260=0.3~0.4。采用CaCl2法制備大腸桿菌感受態,然后加入含有目的基因的質粒DNA,通過42℃熱休克轉化至大腸桿菌體內,繼續于液體培養基中過夜培養。將培養好的菌液平鋪于含有抗生素和X-gal、IPTG的平板培養基中,通過抗藥性篩選及藍白斑試驗挑選所需的大腸桿菌菌株,繼續于液體培養基中過夜培養。采用離心柱式快速回收提取質粒DNA的方法,提取并純化小量的重組質粒DNA,用分光光度法測定其濃度及純度,最后用限制性內切酶酶切及瓊脂糖凝膠電泳鑒定。
1.4 活體轉染 對已形成椎間盤退行性變的動物模型,再次施行對側腹部入路手術,用髓穿針于L5~6間隙注射20 μl含有治療基因 TGF-β1 的重組質粒 DNA,L3~4間隙注射20 μl蛋白因子TGF-β1,術后分籠飼養,自由活動。
1.5 動物分組及標本處理 所有實驗動物于2次手術后分成1 d、4 d、1周、2周4個時間組,每個時間組5只實驗動物,其中各個時間組內又按腰椎間隙的不同又分為實驗組(L5~6)、實驗對照組(L3~4)和空白組(L4~5)。各時間組分別于手術后不同時期處死動物,取出相應椎間盤后置4%多聚甲醛保存,常規脫水、透明、石蠟包埋、切片,應用TGF-β1免疫組織化學試劑盒和DAB顯色試劑盒進行免疫組織化學染色。
1.6 統計學分析應用SPSS 11.0統計軟件,計量資料以表示,采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 動物模型的鑒定 (1)肉眼觀察:造模術后8周,隨機處死 1 只模型動物解剖觀察,L3~4、L4~5、L5~6椎間盤周緣與毗鄰組織粘連緊密,不易分離,椎間盤成骨樣硬化,間盤突向硬脊膜,脊神經根有粘連,分離困難。(2)鏡下觀察:8周后,椎間盤縮小,骨質增生明顯,大部分區域為類骨質和骨質,纖維組織被擠向邊緣,髓核消失。(3)腰椎X線片顯示:8周后腰椎間隙明顯變窄,甚至消失,可見到椎間隙內有線形鈣化。見圖1~4。
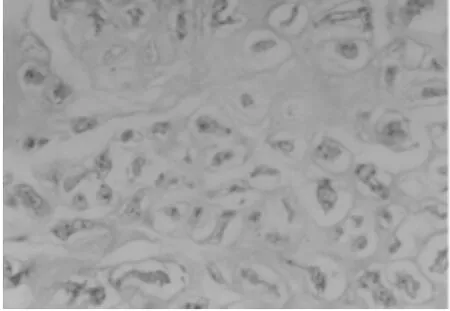
圖1 鏡下觀察正常髓核組織(HE×200)
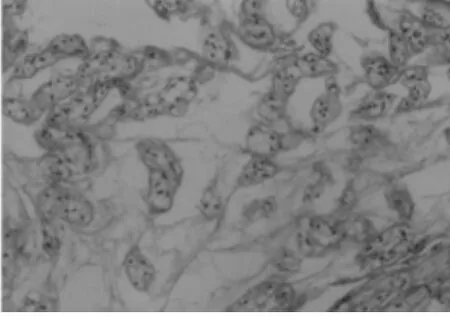
圖2 造模術后2周鏡下觀察退變的髓核組織(HE×200)
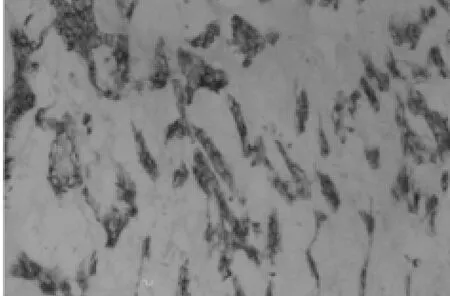
圖3 基因轉染后2周注射轉基因的椎間盤髓核組織(免疫組化×200)

圖4 瓊脂糖凝膠電泳后基因片段的表達
2.2 重組質粒DNA的鑒定 (1)濃度與純度的鑒定:算得所提重組質粒 DNA 溶液的濃度為 0.067 μg/μl,純度為 1.782。(2)重組質粒DNA的鑒定:進行瓊脂糖凝膠電泳后,結果顯示:經過酶切的重組質粒DNA樣品中,可見一條插入的外源基因DNA區帶。根據對比參照物蛋白Marker分子量標準,可初步判斷其為目的基因TGF-β1的插入片斷。
2.3 基因表達活性的鑒定 術后實驗組4 d即呈現陽性顆粒,陽性表達可持續至少2周,實驗對照組陽性表達僅維持3 d,空白組均呈陰性反應。如圖 TGF-β1抗體被染成棕色,利用CMIAS圖像分析系統對各個時間組內不同間隙的椎間盤的陽性蛋白表達進行半定量測定,其光密度值如附表所示。實驗組與實驗對照組比較,差異有統計學意義(P﹤0.05);4 d、1周、2周時實驗組與空白組比較,差異有統計學意義(P﹤0.05);1 d時實驗對照組與空白組比較,差異有統計學意義(P<0.05)。見表 1,圖 5。
表1 3組在不同時期基因表達的光密度評分比較
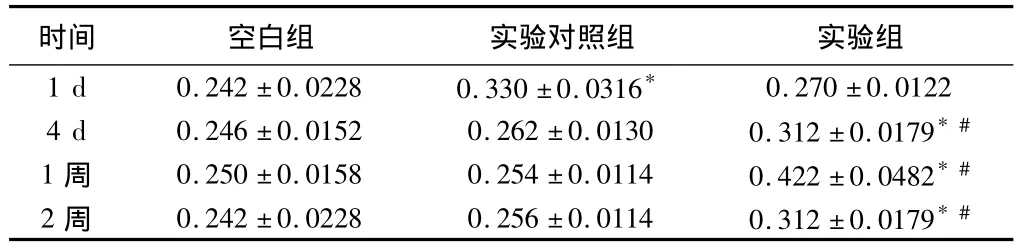
表1 3組在不同時期基因表達的光密度評分比較
注:與空白組比較,*P<0.05;與實驗對照組比較,#P<0.05
時間 空白組 實驗對照組 實驗組1 d 0.242±0.0228 0.330±0.0316*0.270±0.01224 d 0.246±0.0152 0.262±0.0130 0.312±0.0179*#1 周 0.250±0.0158 0.254±0.0114 0.422±0.0482*#2 周 0.242±0.0228 0.256±0.0114 0.312±0.0179*#

圖5 3組在不同時期基因表達的光密度評分
3 討論
3.1 模型動物的構建 (1)實驗動物的選擇:家兔為非直立嚙齒類動物,其髓核與纖維細胞形態改變同人類變化相似,但其退變程度,不如人類明顯。雖然兩者存在物種上的差別,但可作為研究椎間盤退變的實驗模型。根據本實驗觀察,造模后實驗兔的腰椎間盤病理性退變與人類相似,基本符合椎間盤退變的模型要求。(2)造模方法的選擇:綜合考慮要椎間盤退變的生理、病理機制,以及條件和地方的可行性,對實驗動物進行無創性經棘旁穿刺造模方法設計本實驗方法。實驗較順利,經X線片,組織切片觀察,說明椎間盤退變符合實驗造模要求。(3)實驗造模機制:促使椎間盤退變的原因眾多,至今尚未清楚。實驗結果,正是椎間盤局部人為壓力,可以加劇椎間盤退變,并且光鏡下觀察其形態退變過程可以證實其造模的機制,因此,實驗模型的構建可作為研究人體腰椎間盤退行性變的基礎,可用于病因、病機,治療學的探討。
3.2 基因轉移方式及重組載體DNA的選擇 (1)基因轉移方式:當前實施基因轉移的途徑有兩類[1],一類是 in vivo(在體)即活體直接轉移;另一類是 ex vivo(體外)方法。后者比較經典、安全,而且效果較易控制,但是步驟多,技術復雜,難度大不容易推廣。相反前者方法操作簡單,容易推廣,這類方法目前技術雖未成熟,存在起療效短、免疫排斥及安全性等問題,但它是基因轉移研究的方向,只有in vivo基因轉移方法成熟了,基因治療才能真正走向臨床[2]。另外由于椎間盤髓核細胞處于一種高封閉狀態,故選擇直接體內的轉染方法可以基本達到對靶細胞的較高選擇,有利于保持高濃度的目的基因載體。(2)載體DNA的選擇:目前,基因治療所采用的載體很多,大體上可以分成兩大類:病毒載體類和非病毒載體類。前者容量大、效率高、滴度穩定,但在技術上有待成熟,且由于其含有病毒蛋白,容易引起宿主體內的不良反應,嚴重者可以導致腫瘤的發生。相對于前者,后者雖然轉移效率低,持續時間短,組織特異性不強,但通過采用特異性啟動子(如CMV)和增強子以及修飾識別蛋白的方法可以提高其靶向性。而且非病毒載體易于操作、純化,可以根據目的基因的大小來選擇有不同容量的真核表達載體,沒有DNA整合和產生野病毒的危險,無免疫反應等。質粒載體的優點在于便于制備,安全性好,缺點在于體內轉染效率低,但隨著分子生物學技術的發展,高轉染效率的質粒越來越受青睞[3]。
3.3 髓核細胞轉染外源性基因后表達的持續性 綜合文獻報道,在體實驗中,Nishida等[4]采用腺病毒作為載體攜帶hTGF-β1基因轉染兔椎間盤髓核細胞僅報道了1周的結果,國內實驗室雖然對體外培養退變椎間盤髓核細胞進行目的基因的轉染獲得較高的表達,但未能進行細胞的傳代。體外轉染椎間盤軟骨終板的軟骨細胞,只有1%~3%細胞出現了標記基因表達的陽性染色。由于基因表達的調控是一個多層次,多水平的復雜過程,其中包括基因組、轉錄、轉錄后、翻譯及翻譯后等多種水平,所以椎間盤退變的研究要從多個層次尋找高效、長期的目的基因表達方法。
1 張雷,胡有谷.hTGF-β1基因治療腰椎間盤退變研究進展.中華矯形外科雜志,2001,12:1216-1218.
2 Evans CH,Robbins PD.Genetically augmented tissue engimeering of the musculo-skeletal system.Cline Orthop,2003,367:410-418.
3 張維康,徐杰.瘤體內轉化生長因子β1基因轉移對實體瘤的治療作用.中華實驗外科雜志,2003,15:507-509.
4 Nishida K,Kang JD,Gilbertson LG,et al.1999 volvo award winer in basic science studis:modulstion of the biologic activity of the rabbit intervertebral disc by gene therapy;an in vivo study of adenovirus mediated transfer of the human transforming growth factor β1encoding gene.Spine,2002,24:2419-2425.

