玉米灰斑病研究方法:Ⅰ.玉米灰斑病菌孢子的培養
趙正龍, 吳興興, 毛自朝, 何月秋,*
(1.云南農業大學農業生物多樣性應用技術國家工程研究中心,昆明 650201;2.云南農業大學農學與生物技術學院,昆明 650201)
玉米灰斑病(maize gray leaf spot)也稱玉米尾孢葉斑病,是由Cercospora zeae-mayd is Tehon&Daniels引起的重要病害[1]。該病以發病早、傳播和蔓延速度快、危害重、損失大為特點,特別是在玉米成株期暴發流行,重病地塊大部分玉米葉片灰色枯焦,果穗下垂,籽粒松脫干癟,百粒重下降,嚴重影響產量和品質。玉米發病后一般田塊損失5%~30%,嚴重田塊達60%以上,甚至絕收[2-3]。該病主要發生在玉米生長中后期,且常與雨季相吻合,加上植株密集、高大,發病后難以施藥。品種抗病性存在差異是抗病育種的基礎[4-6],然而,該病菌生長速度慢,難于分離,在人工培養條件下不易產孢[7-8],給抗病育種中的接種鑒定帶來了困難。為了加速病菌孢子的培養,本文在他人研究的基礎上開展了產孢條件的研究。
1 材料和方法
1.1 病菌的分離
病葉標本采自云南省峨山縣雙江鎮寶山村,在實驗室采用單孢分離法分離病菌。即在酒精燈上,將直徑1mm毛細管前端部燒成圓球(取孢器),用取孢器于病斑上蘸取分生孢子,在XTS-20體視顯微鏡下,將孢子涂抹于加有氯霉素的4%水瓊脂平板培養基上,以50倍視野下1~5個孢子為宜,再將平板培養基置于25℃的恒溫培養箱內培養8 h。取出平板后,置于體視顯微鏡下,挑取單個萌發的孢子,并置于加有氯霉素馬鈴薯蔗糖瓊脂(PSA)斜面培養基上,于25℃培養、備用。
1.2 培養基和菌絲生長速度的測定
試驗共有PSA,燕麥番茄碳酸鈣瓊脂(燕麥粉15 g,番茄 200 g,碳酸鈣 1 g,瓊脂粉 12 g,水1 000ML,pH6.8。下稱OTCA),玉米葉粉碳酸鈣瓊脂(玉米葉粉15 g,碳酸鈣1.5 g,瓊脂粉12 g,水1 000 ML。下稱MLPCA),燕麥粉瓊脂(燕麥粉20 g,瓊脂粉12 g,水 1 000ML。下稱OA),粗面粉瓊脂(粗面粉 20 g,瓊脂粉 12 g,水1 000 ML。下稱CWPA)5種固體培養基和馬鈴薯汁蔗糖(PS)液體培養基。每個培養皿(直徑90mm)加入40 ML固體培養基,每皿均等地接種3個直徑7 mm的菌塊,于25℃下培養33 d。自接種后第3天開始測量菌落直徑,以后每隔1 d測一次,連續測16次。PS培養基用于菌絲體片段懸液的培養。
1.3 病菌孢子培養
1.3.1 菌絲片段懸液制備
在250 ML的三角瓶中加入100 ML PS培養基,10~20粒直徑5 mm玻璃珠,滅菌冷卻后,在超凈工作臺上,接種直徑為2mm左右的灰斑病菌菌絲塊。在25℃,180 r/min條件下振蕩培養15 d,此時三角瓶中的菌絲已成懸浮液,取出置于4℃冰箱中保存、備用。
1.3.2 光照對病菌產孢的影響
在MLPCA平板上,加入0.2 ML菌絲懸浮液,用無菌曲玻棒涂布均勻,分別放入溫度為25℃的RXZ型智能人工氣候箱中全光照(12000lx)、光照(12000lx)與黑暗各12 h,以及隔水式303-4S恒溫箱中培養。第12天和第14天測量產孢量,每次各處理測量3皿。測量方法:取10 ML滅菌自來水洗下培養皿中孢子,制成孢子懸浮液;用上海市求精生化試劑儀器有限公司生產的25×16規格的血球計數板在顯微鏡下計量孢子數。
1.3.3 培養基對病菌產孢量的影響
吸取0.2 ML菌絲懸浮液均勻地涂布于PSA、OTCA、MLPCA、OTCA和CWPA平板培養基上,放入25℃恒溫箱中黑暗培養。第3天開始,在顯微鏡下,隔1 d測培養基孢子量1次,連續測16次,測量方法同1.3.2。
2 結果與分析
2.1 病菌在不同培養基上的生長速度
玉米灰斑病菌菌落在供試的5種固體培養基上生長速度均非常緩慢,菌落直徑每天增長量在0.33 mm左右(圖1)。其中以在OA(0.38 mm/d)和PSA(0.37 mm/d)上生長速度較快,在CWPA(0.32 mm/d)和OTCA(0.30 mm/d)上生長速度居中,以在 MLPCA培養基上生長速度最慢,僅0.28 mm/d。采用0.2ML菌絲懸浮液涂平板的方法培養時,大量菌絲段分散形成的菌落在第8天于5種培養基上都能長滿直徑90 mm的培養皿。在5種培養基上,菌落顏色有所不同。在OTCA培養基上,菌落顏色最深,為灰綠色,其次,按 PSA、CWPA、OA、MLPCA的順序,菌落的顏色逐漸變淺,在MLPCA上菌落顏色為灰白色。氣生菌絲在OA上生長最好、最致密,其次是 PSA、OTCA 、MLPCA,CWPA上的菌絲短且稀疏。在PSA和OTCA上,單個菌落獨立地形成堅硬小突起,里面含有大量的水分。
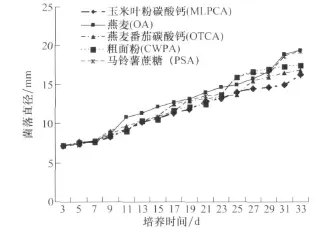
圖1 不同培養基上玉米灰斑病菌菌落直徑
2.2 不同光照時間對病菌產孢量的影響
在不同光照條件下,用菌絲懸液在MLPCA上涂平板的方法,檢查產孢量。結果表明,在培養第12天和第14天調查,全光照處理的灰斑病菌菌落完全不產孢,只形成較多灰白色的氣生菌絲。在全黑暗條件下培養12 d和14 d后,每個培養皿平均分別產生1.1×107和8.2×106孢子。在12 h光照條件下,氣生菌絲多于完全黑暗條件下的菌絲,每皿分別產生4.8×106和4.0×106孢子。
2.3 玉米灰斑病菌在不同培養基上的產孢情況
采用菌絲懸浮液涂平板法,在 OTCA、PSA、CWPA、OA、MLPCA上檢測灰斑病菌產孢情況,自接種后的第3天開始,隔天檢測產孢數。結果表明,不同培養基上產生的孢子量存在顯著差異,PSA在培養9 d時,出現產孢高峰,但與其他處理相比,孢子量少,僅 1.89×105個/皿;MLPCA在 13 d出現產孢高峰,孢子量達到77.78×105個/皿,是 PSA培養基產孢量的41倍,差異達極顯著水平。MLPCA培養基在第13天產生的孢子量也極顯著地高于OA培養基的第 25天的孢子量(24.07×105個/皿)。在CWPA培養基上,孢子產生的高峰期在第23天才出現,產孢量(85.65×105個/皿)才與MLPCA上孢子量相當。與上述4種培養基相比,OTCA上產孢高峰日出現時間更晚,需要27 d,其孢子量(75.00×105個/皿)才與MLPCA 的第13天相當。從連續觀察的結果(圖2)來看,各培養基均是在最大產孢量后,培養基上的菌絲逐漸增多,孢子量迅速下降。這可能與大量孢子萌發,而培養基中的營養逐漸消耗殆盡有關。
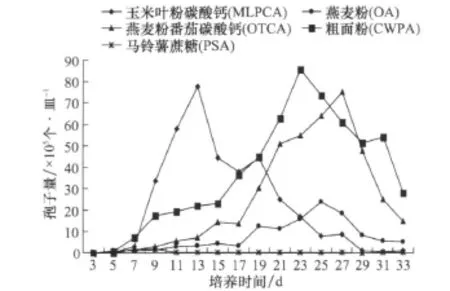
圖2 不同培養基上玉米灰斑病菌的產孢量
3 討論
玉米灰斑病菌在培養基上生長非常緩慢。由于生長慢,產孢所需時間長,在培養過程中易發生污染,影響對病原菌的生物學、玉米抗性鑒定等研究。為了克服灰斑病菌生長慢的缺點,研究者們常采用增加接種體的方法來提高工作效率。如孢子懸液涂抹平板的方法,縮短培養時間,Beckman等[8]采用長有菌落的瓊脂塊搗碎后,涂在玉米葉煎汁碳酸鈣平板和V 8碳酸鈣培養基上,置于25℃的恒溫箱中,光照和黑暗各12 h培養14 d后,兩種培養基分別可得到孢子 1.83×105個/皿和2.36×105個/皿。佟淑杰等[9]和徐秀德等[10]采用在培養基上繼代的分生孢子涂布平板的方法,于25℃下培養5 d,每皿可獲孢子高達1.36×109。然而,上述兩種方法對無菌操作要求嚴格,否則培養基易于污染。此外,采用高粱粒培養灰斑病菌也是一種常用方法[9],但病菌在高粱粒上不產生分生孢子[9,11],不能開展噴霧接種,接種時只能將帶菌的高粱粒直接施入玉米心葉中,而因灰斑病菌的潛育期較長,從建立侵入關系到病斑形成大量孢子需13 d左右,也就是從心葉上病斑產生孢子再侵染,往往需要較長時間,且發病不夠均勻,從而給玉米抗性鑒定帶來困難。洗脫田間病葉上的孢子也可以直接用于接種,但不能做病菌生理分化研究。本研究采用接種菌絲塊于馬鈴薯汁蔗糖培養基(PS),加入少量氯霉素和小玻璃珠,振蕩培養。一方面在培養過程中可以直接觀察液體培養基中的細菌污染情況;另一方面加入了抗菌素可以最大限度地避免細菌污染,培養好的菌體懸液可置于冰箱中保存1年以上,可以隨要隨取,按本研究每9 cm直徑培養皿接種200μL菌絲碎片懸液,培養100 ML菌懸液,便可以接種500個培養皿;第三是加入了玻璃珠后,可以打斷生長中的菌絲體,便于形成更多的生長點和易于用移液器取出與涂抹。實際上,在180 r/min轉速下,250 ML三角瓶中加入100 ML液體培養基,15 d左右便可以培養出粥樣濃稠的菌絲體片段懸液。如果以上述懸液繼代培養,則培養這種懸液的時間可以縮短至8 d左右。因此,本研究采用先培養菌絲體片懸液,再以懸液涂布固體培養基的二級分段培養法,可以明顯提高玉米灰斑病菌培養效率。這種方法不僅可用于玉米灰斑病菌的孢子培養,而且還可以適用于其他在人工培養基上生長慢的真菌。
玉米灰斑病菌的產孢速度和孢子產生量與光照條件、培養基類型及接種體用量有關。連續光照不利于孢子的形成,而有利于氣生菌絲生長,連續黑暗培養有利于孢子產生。應用玉米葉粉碳酸鈣培養基[10]所需時間短,成本低,產生孢子量大。燕麥番茄汁碳酸鈣培養基的營養豐富,與燕麥培養基相比,推遲了產孢高峰期出現,但孢子量幾近是后者的3倍。常用于真菌培養的PSA,盡管有利于菌絲生長,但其產孢量較少,不適用于產孢培養基,這一結果與Beckman等[8]報道的PDA相似。然而,它適用于二級分段培養法中的菌絲培養階段,且成本低。本研究的結果是在9 cm直徑培養皿中加入200μL第1階段培養的菌絲碎片懸液條件下取得的,如果適當增加接種體的數量,從涂板到產孢的時間是否還將縮短有待于進一步研究。
本研究中所得到的產孢量與BeckMan等[8]和Brunelli等[12]相似,即每9 cm直徑的培養皿可產生百萬級的孢子,與佟淑杰等[9]的十億級的孢子相差1 000倍,這可能與各實驗室培養條件不一致有關。
[1]Tehon L R,Daniels E.Notes on parasitic fungiof Illinois[J].My cologia,1925,17:240-249.
[2]涂永海,沙本才,何月秋.鳳慶縣玉米灰斑病發生規律初步研究[J].云南農業大學學報,2007,22(4):604-607.
[3]李富華,吳炯波,王玉濤.玉米灰斑病的研究現狀、問題與展望[J].玉米科學,2005,13(3):117-121.
[4]馬榮,吳景芝,吳毅歆,等.云南省區試玉米新品種對4種葉斑病的抗性鑒定[J].種子,2009,28(3):64-67.
[5]Gordon SG,Bartsch M,Matthies I,et al.Linkage ofmolecularMarkers to Cercospora zeae-mayd is resistance inmaize[J].C rop Science,2004,44:628-636.
[6]Derera J,Tongoona P,Pixley K V,et al.Gene action controlling gray leaf spot resistance in sou thern A frican maize germplasm[J].Crop Science,2008,48:93-98.
[7]王桂清,陳捷.玉米灰斑病菌致病性分化的寄主鑒定方法[J].沈陽農業大學學報,2005,36(4):432-436.
[8]Beckman PM,Payne G A.Cultu ral techniquesand conditions influencing grow th and sporulation of Cercospora zeae-may dis and lesion developmen t in corn[J].Phytopathology,1983,73(2):286-289.
[9]佟淑杰,徐秀德,董懷玉,等.玉米灰斑病菌產孢特性的初步研究[J].雜糧作物,2005,25(3):201-203.
[10]徐秀德,董懷玉,姜鈺,等.玉米灰斑病抗性鑒定技術[J].植物保護學報,2003,30(2):129-132.
[11]王桂清,陳捷.玉米灰斑病菌人工接種方法[J].玉米科學,2006,14(6):148-150.
[12]BrunelliK R,Fazza A C,A thayde Sobrinho C,etal.Efeito do meio de cultu rae do regime de luzna esporulacao de Cercospora zeae-mayd is[J].Summa Phytopathologica,2006,32(1):92-94.

