葫蘆種子傳黃瓜綠斑駁花葉病毒的檢測*
秦碧霞, 蔡健和, 陸秀紅, 林 林, 廖富榮, 劉志明
(1.廣西農業(yè)科學院植物保護研究所,南寧 530007; 2.廣西作物遺傳改良生物技術重點開放實驗室,南寧 530007;3.廣西玉林市農業(yè)科學研究所,玉林 537000; 4.廈門出入境檢驗檢疫局,廈門 361012)
黃瓜綠斑駁花葉病毒(Cucumber green mottle mosaic virus,CGMMV)是煙草花葉病毒屬(Tobamovirus)成員,是葫蘆科重要病毒之一,1935年Ainsworth在英國首次發(fā)現(xiàn)和報道,隨著葫蘆科作物在各國間的交流引種日益頻繁,目前該病毒在英國 、希臘、羅馬尼亞、巴西 、日本 、伊朗 、印度、韓國等及中國部分地區(qū)均有分布[1-5],在一些地區(qū)已造成大田瓜類作物的毀滅性損失,嚴重威脅葫蘆科作物安全生產[3-4,6-7]。2006年我國農業(yè)部(農業(yè)部公告第788號)已將該病毒確定為全國農業(yè)植物檢疫性有害生物。
種子帶毒是黃瓜綠斑駁花葉病毒遠距離傳播的主要途徑,建立健全種子病毒檢測方法,了解種子攜帶病毒情況,對從源頭控制該病毒的擴散蔓延有重要指導意義。血清學檢測及分子生物學檢測是快速診斷該病毒的主要方法,酶聯(lián)免疫吸附法(ELISA)廣泛應用于黃瓜綠斑駁花葉病毒的檢測,RT-PCR及免疫捕獲RT-PCR(IC-RT-PCR)的應用使黃瓜綠斑駁花葉病毒的檢測靈敏度大大提高[8-9],Lee[10]等利用生物芯片技術使黃瓜綠斑駁花葉病毒的檢測更準確和快捷,鄧叢良[11]等建立了實時熒光RT-PCR檢測黃瓜綠斑駁花葉病毒方法,檢測靈敏度比RTPCR高10倍。ELISA和RT-PCR、IC-RT-PCR已被廣泛應用于黃瓜綠斑駁花葉病毒帶毒種子的檢測[12-15]。本文通過生物學、血清學及分子生物學方法測定了感染黃瓜綠斑駁花葉病毒的葫蘆(Lagenaria siceraria)種子攜帶病毒的情況,并測定了種子各部位攜帶病毒的侵染活性及DAS-ELISA檢測葫蘆種子攜帶病毒的靈敏度。
1 材料與方法
1.1 供試材料
檢測用種子是感染黃瓜綠斑駁花葉病毒并表現(xiàn)明顯癥狀的葫蘆植株留的種子,于2006年12月開瓜取種,經洗凈曬干后保存在4℃冰箱備用,陽性對照為本實驗室分離純化接種保存在葫蘆上的黃瓜綠斑駁花葉病毒,健康對照為健康葫蘆植株收取的種子。
1.2 種子帶毒率測定
1.2.1 苗期癥狀觀察法
2007年3月和6月分別在防蟲網(wǎng)室水泥池內播種供試葫蘆種子150粒和100粒,觀察至5~6葉期,記錄發(fā)病株數(shù),統(tǒng)計發(fā)病率,并用ELISA方法檢測驗證。
1.2.2 雙抗體夾心酶聯(lián)免疫吸附法(DAS-ELISA)
CGMMV抗血清、酶標抗體等購自美國Agdia公司。隨機取30粒供試葫蘆種子,每粒種子為1份樣品,將種子剝開后加1ML 0.1 mol/L磷酸鹽緩沖液(pH 7.4)和少量金剛砂研磨,低速離心取上清液進行檢測,設感染CGMMV的葫蘆葉片做陽性對照,健康葫蘆葉片和種子為陰性對照,檢測步驟及結果判斷參照試劑說明書進行。
1.2.3 免疫捕獲反轉錄PCR法(IC-RT-PCR)
根據(jù)黃靜等[12]設計的CGMMV基因組保守序列合成上下游特異引物,上游引物CGM1:5′-CGTGGTAAGCGGCATTCTAAACCTC-3′,下游 引物CGM2 :5′-CCGCAAACCAATGAGCAAACCG-3′,擴 增片段約 650 bp。AMV、RNasin、Taq DNA聚合酶、dNTPs等購自寶生物工程(大連)有限公司。
在0.2 ML PCR管中加入100μL用包被緩沖液稀釋至工作濃度的CGMMV抗血清,37℃孵育2~3 h,倒凈,PBST洗3次,每次 3 min,加入1.2.2制備的整粒種子研磨上清液100μL,37℃孵育2~3 h或4℃冰箱過夜,倒凈,PBST洗3次,ddH 2O洗1次,吸盡余液,向管中加入 DEPC水11.5μL,5×RT buffer 4μL,dNTPs(10 mmoL/L)2μL,下游引物 CGM2(100μmol/L)1.0μL,混勻后 82 ℃4Min,迅速置冰上 3 min,加入 AMV(5U/μL)1.0μL,RNasin(40 U/μL)0.5 μL,總體積 20μL,混勻后42℃80Min,85℃10min。
PCR反應總體積20μL:ddH2 O 14.7μL,反轉錄產物1μL,10×PCR bu ffer 2μL、10mmoL/L dNTPs 0.2 μL、CGM1(10 μmol/L)、CGM2(10μmol/L)各1.0μL,Taq DNA聚合酶(5 U/μL)0.1μL,混勻后進行PCR擴增。擴增條件為:94℃預變性3 min,94℃變性30 s,56℃退火30 s,72℃延伸1min,循環(huán)35次,最后72℃延伸10 Min,用1.2%瓊脂糖電泳檢測PCR產物。
1.3 種子不同部位病毒檢測
分別取整粒種子、剝離的種皮及其對應的種仁各10粒用于檢測,每粒為1份樣品。種子及種皮分別用1ML磷酸鹽緩沖液(0.1 mol/L,pH 7.4)浸泡2 h得到浸泡液,種仁加1 ML緩沖液研磨,低速離心后取上清液,分別用DAS-ELISA和IC-RT-PCR方法檢測帶毒情況。
1.4 DAS-ELISA檢測靈敏度
取1粒病種(0.16 g),加3.2 ML磷酸鹽緩沖液(pH 7.4),研磨后低速離心取上清液,按倍比法系列稀釋至 40、80、160、320、640、1 280 、2 560、5 120、10 240倍,用DAS-ELISA檢測,用安托斯全自動酶標儀(Anthos 2010)讀取405 nm吸光值,根據(jù)待測樣品與陰性對照的吸光值比值判斷結果。出現(xiàn)陽性反應的最大稀釋度即該法檢測靈敏度。
1.5 種子攜帶病毒的侵染活性
分別取1.3制備的整粒種子表面(種表)、種皮浸泡液、種仁及整粒種子研磨上清液各接種葫蘆8株,觀察記錄發(fā)病情況,并用ELISA檢測驗證。
2 結果與分析
2.1 種子帶毒率測定
苗期癥狀觀察法播種的兩批種子分別成苗110株和89株,觀察至6葉期,各有1株表現(xiàn)花葉癥狀,平均發(fā)病率為1.01%,經DAS-ELISA檢測,顯癥植株與CGMMV抗血清呈陽性反應,隨機抽取10株無癥狀植株進行檢測,均與CGMMV抗血清呈陰性反應,未發(fā)現(xiàn)隱癥帶毒植株。葫蘆種子攜帶CGMMV從種子到幼苗的傳毒率為1.01%。
DAS-ELISA法檢測結果表明,隨機抽檢的30粒病株種子全部與CGMMV抗血清呈陽性反應,健康種子呈陰性反應,感病葫蘆種子帶毒率100%。
IC-RT-PCR擴增產物經1%瓊脂糖電泳檢測,30份病株種子及陽性對照均擴增出約650 bp片段,與預期片段大小一致,健康對照無任何擴增條帶(圖1),與DAS-ELISA檢測結果一致,感病葫蘆種子帶毒率100%。

圖1 帶毒葫蘆種子IC-RT-PCR產物電泳結果
2.2 種子不同部位病毒檢測
DAS-ELISA檢測結果表明:10份種皮浸泡液及9份種仁研磨上清液與CGMMV抗血清呈陽性反應,1份種仁上清液及10份種表浸泡液與CGMMV抗血清呈陰性反應;IC-RT-PCR檢測結果:種表浸泡液無預期片段擴增,種皮浸泡液及種仁研磨上清液均出現(xiàn)約650 bp預期片段(表1)。在抽檢的10粒種子中,種子表面未檢出CGMMV,種皮及種仁均檢測到CGMMV。
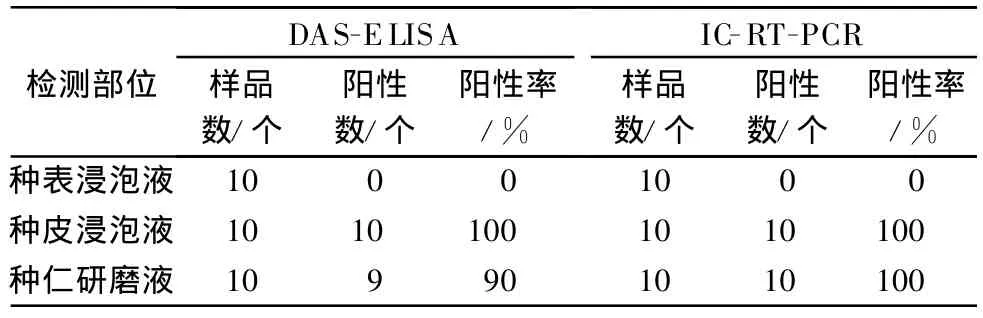
表1 帶毒種子不同部位檢測結果
2.3 DAS-ELISA檢測靈敏度
從表2看出,種子研磨上清液最大稀釋至5 120倍仍與CGMMV抗血清呈陽性反應,相當于可以檢測31.25μg帶毒種子攜帶的CGMMV。
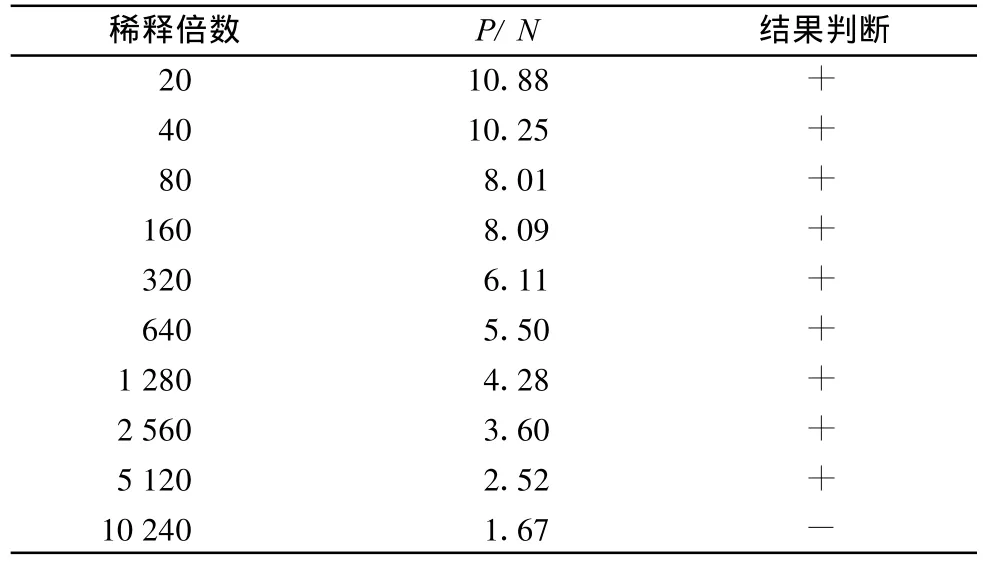
表2 種子研磨上清液不同稀釋倍數(shù)檢測結果1)
2.4 種子攜帶病毒的侵染活性
種表浸泡液接種的8株葫蘆均生長正常,未表現(xiàn)任何癥狀,而種皮浸泡液、種仁及整粒種子研磨上清液分別接種的8株葫蘆,各有6、5株和7株表現(xiàn)脈綠、斑駁花葉等典型CGMMV侵染癥狀,對顯癥與不顯癥的植株進行ELISA檢測,結果與癥狀表現(xiàn)一致,說明種子各部位攜帶的CGMMV具有侵染活性。
3 結論與討論
ELISA和IC-RT-PCR隨機抽檢 30粒感染CGMMV的葫蘆植株種子帶毒率為100%,播種出苗的199粒種子傳毒率只有1.01%。Choi Gug-Seoun[16]檢測感染CGMMV的葫蘆種子帶毒率為84%,傳毒率為2%。由于種子傳毒與否及種傳率高低除與病毒本身有關外,還受植株品種、感染時期、環(huán)境條件及各種因素互作影響[17],因此不同批次的同品種種子帶毒率和傳毒率也不同,隨機取樣和抽取足量樣本進行檢測更能真實反映種子的帶毒情況。有研究認為甘蔗花葉病毒(SCMV)存在于玉米種皮和胚乳中的病毒不是導致幼苗發(fā)病的主要原因,胚攜帶的病毒才是導致種子傳毒的內在因素[18]。本研究在葫蘆種子表面未檢出CGMMV,可能是由于檢測的樣品少,或者表面病毒量少未能檢出。葫蘆種皮和種仁經檢測攜帶CGMMV,但未對具體的帶毒部位做進一步檢測,CGMMV在葫蘆種子上的傳毒率與種子各部位攜帶病毒的關系及其傳毒機理尚需進行更深入系統(tǒng)的研究。
種子傳毒對病害的流行傳播有重要影響,雖然至今未明確CGMMV的田間傳毒媒介,但該病毒極易通過汁液摩擦、葉片接觸、嫁接、農事操作等非介體傳播[19],一旦田間出現(xiàn)因種子帶毒發(fā)生的病苗,即使是很低的比例,也會以此為初侵染源,通過非介體因素傳播開來,從而造成嚴重損失。此外,葫蘆是我國很多西瓜產區(qū)用于嫁接防治枯萎病的主要砧木,葫蘆種子帶毒很容易通過嫁接傳染接穗西瓜苗,從而擴散到大田引起嚴重的后果[3]。
CGMMV是我國農業(yè)植物檢疫性有害生物和進境檢疫性有害生物,由于該病毒極強的穩(wěn)定性、具有廣泛的適宜寄主和多種傳播特性,在我國定殖和擴散的風險性極高[20]。DAS-ELISA和 RT-PCR(IC-RT-PCR)等方法已經成功應用于快速靈敏檢測種子攜帶的 CGMMV[12-15],本研究表明 DASELISA檢測葫蘆種子CGMMV的靈敏度為1/5120種子研磨液。種子攜帶病毒的滅活處理也已經有很多成功的方法[13-14],當務之急是加強葫蘆科種子檢驗檢疫規(guī)程制定和監(jiān)管,對商品用種和引進調運的種子進行消毒處理,加強抗病品種培育等,多途徑阻斷該病毒的傳入、定殖及擴散危險,促進葫蘆科作物生產持續(xù)、穩(wěn)定、健康發(fā)展。
[1]馮蘭香,謝丙炎,楊宇紅,等.檢疫性黃瓜綠斑駁花葉病毒的檢測和防疫控制[J].中國蔬菜,2007(9):34-38.
[2]秦碧霞,蔡健和,劉志明,等.侵染觀賞南瓜的黃瓜綠斑駁花葉病毒的初步鑒定[J].植物檢疫,2005,19(4):198-200.
[3]陳紅運,趙文軍,程毅,等.遼中地區(qū)西瓜花葉病病原的分子鑒定[J].植物病理學報,2006,36(4):306-309.
[4]周玲玲,吳元華,趙秀香,等.黃瓜綠斑駁花葉病毒生物學特性及對西瓜生長的影響[J].沈陽農業(yè)大學學報,2008,39(4):417-422.
[5]李小妮,任小平,王琳,等.廣東省黃瓜綠斑駁花葉病毒分子檢測及防疫[J].植物保護學報,2009,36(3):283-284.
[6]Lee K Y,Lee B C,Park H C.Occu rrence of Cucumber g reen mottlemosaic virus disease of waterMelon in Korea[J].Korea J Plant Pathol,1990,6:250-255.
[7]Park JW,Cheon J U,Choi H S.Occu rrence and con trol of seed-borne p lan t viruses in Korea[C]Crop Prot Res Ru ral DevelopMen t AdMinistration,2001:194-218.
[8]Varveri C,Vassilakos N,Ben F.Characterization and detection of Cucumber g reen mottlemosaic virus in Greece[J].Phytoparasitica,2002,30(5):493-501.
[9]Maroon C JM.PCR based tests for the detection of tobamoviruses and carlaviruses[J].Acta Horticulturae,2002,568:117-122.
[10]Lee G P,Min B E,KiMCS,etal.Plant virus cDNA chip hyb ridization fo r detection and differen tiation of four cucurbit infecting tobamoviruses[J].Jou rnal of V irological Methods,2003,110(1):19-24.
[11]鄧叢良,黃峰,呂玉峰,等.實時熒光 RT-PCR方法檢測黃瓜綠斑駁花葉病毒[J].植物檢疫,2009,23(4):29-31.
[12]黃靜,廖富榮,林石明,等.南瓜種子中黃瓜綠斑駁花葉病毒ICRT-PCR檢測方法的建立[J].漳州職業(yè)技術學院學報,2009,11(1):12-15.
[13]K iMDuHyun,Lee JungMyung.Seed treatMent for Cucumber green mottle mosaic virus(CGMMV)in gou rd(Lagenaria siceraria)seedsand its detection[J].Jou rnal of the Ko rean Society for Horticu ltural Science,2000,41:1.
[14]KiMSang-Min,NaMSang-Hyum,Lee Jung-Myung,et al.Destru ction of Cucumber green mottle mosaic virus by heat treatment and rapid detection of virus inactivation by RT-PCR[J].Molecules and Cell,2003,16(3):338-342.
[15]K iMDu-H yun,Lee Jung-Myung,Bae Jin-Ju.235 Seed Treatments for inactivation of CGMMV in gou rd and its detection[J].HortScience,1999,34:482.
[16]ChoiGugSeoun.Occurrence of tw o Tobamovirus diseases in cucu rbits and control measu res in Korea[J].Plant Pathology Jou rnal,2001,17(5):243-248.
[17]季良.植物種傳病毒與檢疫[M].北京:中國農業(yè)出版社,1995:1-29.
[18]李莉,王錫鋒,郝宏京,等.甘蔗花葉病毒在玉米種子中的分布及其與種子傳毒的關系[J].植物病理學報,2004,34(1):37-42.
[19]張永江.黃瓜綠斑駁花葉病毒研究進展[J].河南農業(yè)科學,2006(8):9-12.
[20]吳元華,李立梅,趙秀香,等.黃瓜綠斑駁花葉病毒在我國定殖和擴散的風險性分析[J].植物保護,2010,36(1):33-36.

