α-突觸核蛋白在人腦膜瘤組織中的表達(dá)
吳 楊 蘇玉金 李 昕 劉光偉 李堯華 于 順*
(1.首都醫(yī)科大學(xué)宣武醫(yī)院神經(jīng)生物學(xué)研究室,教育部神經(jīng)變性病重點(diǎn)實(shí)驗(yàn)室,北京 100053;2.首都醫(yī)科大學(xué)天壇醫(yī)院神經(jīng)科學(xué)研究所,北京 100050)
α-突觸核蛋白(α-synuclein,α-syn)由 140 個(gè)氨基酸組成,在中樞及外周神經(jīng)組織中含量豐富,主要存在于成年人腦組織神經(jīng)元的突觸前終末端,與突觸可塑性的形成有關(guān)[1]。α-syn在胚胎腦組織主要存在于神經(jīng)元的胞體中,隨著胚胎發(fā)育,逐漸分布到突觸前終末端[2-3]。以往的研究[4-5]表明,α-syn 可以促進(jìn) β-微管蛋白組裝成微管,并提高培養(yǎng)的MES23.5多巴胺神經(jīng)細(xì)胞增生速度。鑒于α-syn家族中的另一個(gè)成員 γ-突觸核蛋白(γ-synuclein,γ-syn)也具有促進(jìn) β-微管蛋白組裝成微管的作用[6],并影響腫瘤細(xì)胞的增生、遷移和侵襲性[7],推測(cè) α-syn也可能存在于腫瘤細(xì)胞中,并發(fā)揮與γ-syn類似的作用。本課題組利用免疫組織化學(xué)方法證明α-syn在人腦膜瘤組織中的表達(dá),觀察其與β-微管蛋白之間的關(guān)系。
1 材料和方法
1.1 實(shí)驗(yàn)材料
1.1.1 組織切片
人腦組織切片來自首都醫(yī)科大學(xué)天壇醫(yī)院神經(jīng)外科患者經(jīng)手術(shù)切除的腦組織,其中20例為腦膜瘤組織。5例為癲癇病人異常放電腦組織,作為對(duì)照腦組織。所有組織均制備成石蠟包埋切片。
1.1.2 主要試劑
兔抗人α-syn多克隆抗體、鼠抗人α-syn單克隆抗體 3D5 均由本室制備[8-9];鼠抗人突觸素(synaptophysin,SYP)抗體(美國(guó)Santa cruz公司);鼠抗人β-微管蛋白單克隆抗體、生物素標(biāo)記山羊抗兔IgG、生物素標(biāo)記山羊抗小鼠IgG、鏈霉親和素標(biāo)記辣根過氧化物酶、FITC標(biāo)記山羊抗兔IgG、TRITC標(biāo)記山羊抗小鼠IgG(美國(guó)Vector Laboratory公司);其他試劑為分析純。
1.2 方法
1.2.1 免疫組織化學(xué)染色
將腦組織切片依次通過二甲苯、不同濃度乙醇和檸檬酸緩沖液進(jìn)行脫蠟和抗原修復(fù),3%牛血清白蛋白(bovine serum albumin,BSA)溶液封閉,然后與不同抗人 α-syn的抗體(兔多克隆抗體 1∶10 000、3D5 1∶4 000)于4℃反應(yīng)過夜,與生物素標(biāo)記的山羊抗兔或山羊抗鼠IgG(1∶1 000)室溫反應(yīng)2 h,再與鏈霉親和素標(biāo)記的辣根過氧化物酶(1∶1 000)室溫反應(yīng)1 h,用含有DAB的顯色液顯色,在顯微鏡下觀察結(jié)果。
1.2.2 免疫熒光雙重標(biāo)記
脫蠟和抗原修復(fù)腦組織切片,經(jīng)3%BSA封閉后,在4℃條件下與兔抗人α-syn多抗(1∶500)和鼠抗人β-微管蛋白單抗(1∶50)或鼠抗人 SYP單抗(1∶400)反應(yīng)過夜,再與FITC標(biāo)記的山羊抗兔IgG(1∶800)和TRITC明標(biāo)記的山羊抗小鼠IgG(1∶800)室溫反應(yīng)2 h。熒光標(biāo)記結(jié)果用熒光共聚焦顯微鏡觀察。
2 結(jié)果
2.1 α-syn在對(duì)照腦組織中的表達(dá)
在正常腦組織中,α-syn免疫活性物質(zhì)呈細(xì)小的顆粒狀,均勻分布于腦組織的神經(jīng)元之間,提示這種蛋白在神經(jīng)末梢存在(圖1)。免疫熒光雙重標(biāo)記證明,α-syn在神經(jīng)末梢與突觸特異蛋白突觸素共存。α-syn免疫活性物質(zhì)還見于神經(jīng)元的胞體和近端突起部位。α-syn在神經(jīng)元末梢與 β-微管蛋白共存(圖2)。
2.2 α-syn在腦膜瘤組織中的表達(dá)
在腦膜瘤組織,α-syn免疫陽(yáng)性細(xì)胞呈漩渦狀或巢狀分布。α-syn免疫活性物質(zhì)主要分布于腫瘤細(xì)胞的胞質(zhì)與核膜。此外,α-syn也見于少數(shù)腫瘤細(xì)胞的胞核中。在不同腫瘤細(xì)胞團(tuán)中的α-syn免疫活性物質(zhì)的含量不同,有些細(xì)胞團(tuán)含量較高,而另一些則較低(圖3,4)。兩種不同抗體所顯示 α-syn的表達(dá)位置相同。
免疫熒光雙重標(biāo)記結(jié)果顯示,在腦膜瘤細(xì)胞中,α-syn和β-微管蛋白在胞質(zhì)均呈陽(yáng)性反應(yīng),并且共存(圖5),在腫瘤組織中β-微管蛋白表達(dá)量多,而在正常組織中表達(dá)量則較少。

圖1 抗人α-syn抗體顯示α-syn在對(duì)照腦組織中的分布Fig.1 Anatomical distribution of α-syn in control humen brain
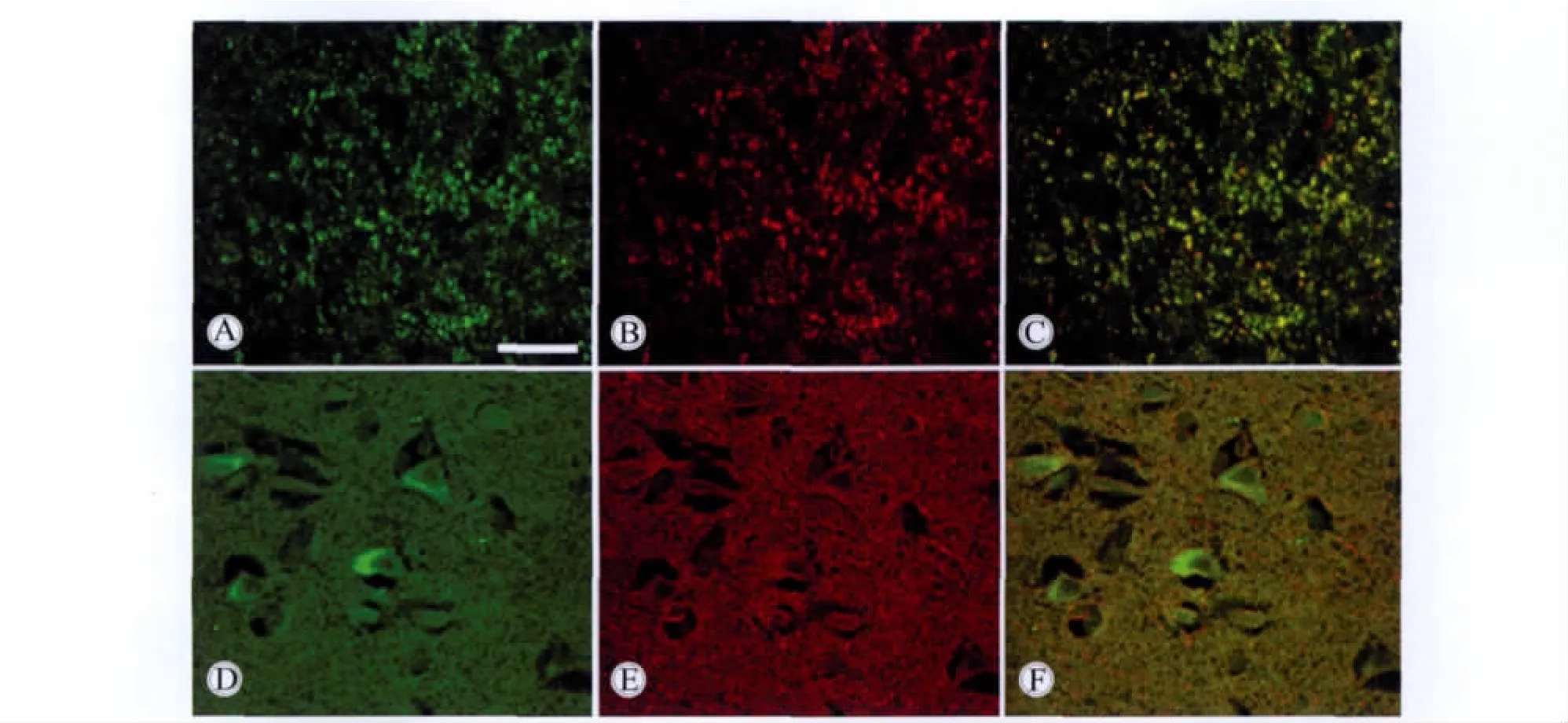
圖2 免疫熒光雙重標(biāo)記顯示α-syn和突觸素、β-微管蛋白在對(duì)照腦組織中共存Fig.2 Double immunofluorescent labeling by polyclonal antibody of α-syn and SYP/β-tubulin antibody
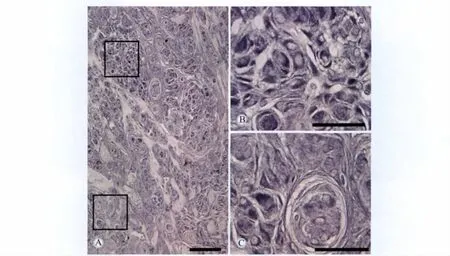
圖3 抗人α-syn多克隆抗體顯示α-syn在腦膜瘤組織中的分布Fig.3 Anatomical distribution of α-syn in meningiomas tissue by polyclonal antibody
3 討論
本課題組采用了2種抗人α-syn抗體進(jìn)行免疫組織化學(xué)染色,均證明α-syn在腦膜瘤組織中腫瘤細(xì)胞的胞質(zhì)與胞核中存在。而在正常腦組織,α-syn免疫活性物質(zhì)除少量存在于神經(jīng)元的胞體和近端突起部位外,主要呈細(xì)小的顆粒狀分布于神經(jīng)元之間,這些α-syn免疫活性物質(zhì)與突觸特異性蛋白突觸素共存,提示α-syn在正常腦組織存在于神經(jīng)末梢的突觸前終末。以往研究[10-11]表明,α-syn 主要存在于具有神經(jīng)元分化特性的腦腫瘤中,而在非神經(jīng)元來源的腦膜瘤則不表達(dá)。本研究結(jié)果表明,非神經(jīng)元來源的腦腫瘤也表達(dá) α-syn。

圖4 3D5顯示α-syn在腦膜瘤組織中的分布Fig.4 Anatomical distribution of α-syn in meningiomas tissue by 3D5

圖5 免疫熒光雙重標(biāo)記顯示α-syn和β-微管蛋白在腦膜瘤組織中共存Fig.5 Double immunofluorescent labeling by polyclonal antibody of α-syn and β-tubulin antibody
α-syn在腦膜瘤細(xì)胞中的功能尚不清楚。以往研究[6-7]表明,α-syn 家族的另一個(gè)成員 γ-syn 與腫瘤細(xì)胞的增生、遷移、侵襲性有關(guān),γ-syn對(duì)腫瘤細(xì)胞的影響與其促進(jìn)微管蛋白組裝成微管有關(guān)。鑒于α-syn與γ-syn在氨基酸序列上具有高度的一致性,體外研究[4]證明,α-syn也具有促進(jìn)微管的聚合的作用,推測(cè)α-syn在腦膜瘤細(xì)胞也可能參與微管的形成過程,并進(jìn)而影響腫瘤的增生、遷移和侵襲性。作為支持這一推測(cè)的證據(jù)有α-syn在腦膜瘤細(xì)胞與β-微管蛋白共存,提示α-syn與微管組裝具有密切的關(guān)系。支持以上推測(cè)的另一個(gè)證據(jù)是,本課題組以往的研究[5]表明,α-syn可以促進(jìn)細(xì)胞的增生,而其促進(jìn)細(xì)胞增生的活性部位與其促進(jìn)微管聚合的活性部位相同,均在其蛋白質(zhì)羧基末端。
微管作為細(xì)胞的重要骨架蛋白參與的核分裂與胞質(zhì)分裂過程[12],而β-微管蛋白是構(gòu)成微管的主要成分。鑒于微管參與細(xì)胞分裂過程中的核分裂和胞體分裂以及腫瘤細(xì)胞的遷移[13-15],推測(cè) α-syn 也可能與腫瘤的增生、遷移和侵襲性有關(guān)。
[1]Lavedan C.The synuclein family[J].Genome Res,1998,8(9):871-880.
[2]Hsu L J,Mallory M,Xia Y,et al.Expression pattern of synucleins(non-Ab component of Alzheimer's disease amyloid precursor protein/α-synuclein)during murine brain development[J].J Neurochem,1998,71(1):338-344.
[3]Galvin J E,Schuck T M,Lee V M,et al.Differential expression and distribution of α-,β-,γ-synuclein in the developing human substantia nigra[J].Exp Neurol,2001,168(2):347-355.
[4]Alim M A,Ma Q L,Takeda K,et al.Demonstration of a role for alpha-synuclein as functional microtubule-associated protein[J].J Alzheimers Dis,2004,6(4):435-442.
[5]Yin J,Han J,Zhang C,et al.C-terminal part of α-synuclein mediates its activity in promoting proliferation of dopaminergic cells[J].J Neural Transm,2011,118(8):1155-1164.
[6]Zhang H,Kouadio A,Cartledge D,et al.Role of gammasynuclein in microtubule regulation[J].Exp Cell Res,2011,317(10):1330-1339.
[7]Liu C,Dong B,Lu A,et al.Synuclein gamma predicts poor clinical outcome in colon cancer with normal levels of carcinoembryonic antigen[J].BMC Cancer,2010,10:359.
[8]Yu S,Li X,Liu G,et al.Extensive nuclear localization of alpha-synuclein in normal rat brain neurons revealed by a novel monoclonal antibody[J].Neuroscience,2007,145(2):539-555.
[9]賈春松,李昕,李堯華,等.缺血/再灌注大鼠腦和血漿中α-突觸核蛋白含量的變化[J].首都醫(yī)科大學(xué)學(xué)報(bào),2010,31(3):368-372.
[10]Kawashima M,Suzuki S O,Doh-ura K,et al.Alpha-synuclein is expressed in a variety of brain tumors showing neuronal differentiation[J].Acta Neuropathol,2000,99(2):154-160.
[11]Raghavan R,White C L 3rd,Rogers B,et al.Alphasynucelin expression in central nervous system tumors showing neuronal or mixed neuronal/glial differentiation[J].J Neuropathol Exp Neurol,2000,59(6):490-494.
[12]Katsetos C D,Herman M M,M?rk S J,et al.ClassⅢ beta-tubulin in human development and cancer[J].Cell Motil Cytoskeleton,2003,55(2):77-96.
[13]Esteves A R,Arduino D M,Swerdlow R H,et al.Microtubule depolymerization potentiates alpha-synuclein oligomerization[J].Front Aging Neurosci,2010,1:5.
[14]Nakayama K,Suzuki Y,Yazawa I.Microtubule Depolymerization Suppresses α-synuclein accumulation in a mouse model of Multiple system atrophy[J].Am J Pathol,2009,174(4):1471-1480.
[15]Zhou R M,Huang Y X,Li X L,et al.Molecular interaction of alpha-synucelin with tubulin influences on the polymerization of microtubule in vitro and structure of microtubule in cells[J].Mol Biol Rep,2010,37(7):3183-3192.

