欖香烯抑制Raf/MEK/ERK信號通路誘導人源膠質瘤U87細胞凋亡
趙永順,吳春明,董 斌,位振清,徐英輝*
膠質瘤作為最常見的惡性腦腫瘤,具有高度侵襲性,即使經手術及放化療,平均生存期也很短[1]。欖香烯(Elemene)是從中藥莪術中提取的、由我國自主開發的國家二類抗腫瘤新藥,主要成分為β-欖香烯,屬于不含氧的倍半烯烴類。由于其低毒、高效和廣譜,被廣泛用于治療多種腫瘤[2-3]。體外研究發現,欖香烯能有效抑制膠質瘤細胞生長,具有明確的抗膠質瘤作用[4]。欖香烯抑制膠質瘤細胞增殖和誘導膠質瘤細胞凋亡是其抗膠質瘤的重要機制,并且抑制增殖作用與p38MAPK信號通路的活化密切相關[5-7],但其誘導膠質瘤細胞凋亡的機制尚未闡明。本研究旨在通過觀察欖香烯對人源膠質瘤U87細胞系Raf/MEK/ERK信號通路各蛋白活性及癌基因Bcl-2家族成員表達的影響,探討其誘導膠質瘤細胞凋亡的相關機制,為欖香烯治療膠質瘤提供理論依據和實驗基礎。
1 材料和方法
1.1 材料 2%欖香烯乳劑購自大連金港制藥公司;人源膠質瘤U87細胞系購自中國科學院上海細胞生物學研究所;DMEM培養基購自美國GIBCO BRL公司;Raf-1、ERK、磷酸化ERK蛋白質單克隆抗體購自美國 Cell Signaling公司;磷酸化Raf-1(Tyr340/341)、Bcl-2、Bax、β-actin 蛋白質單克隆抗體購自Santa Cruz Biotechnology公司。
1.2 方法
1.2.1 細胞培養 將人源膠質瘤U87細胞培養于含10%胎牛血清(FBS)的DMEM(Dulbecoo's modified Eagle'smedium)培養基(青霉素50 IU/mL、鏈霉素 50 mg/mL)中,置 37℃、5%CO2培養箱中培養至對數生長期。
1.2.2 流式細胞儀檢測細胞凋亡 取對數期U87膠質瘤細胞,以5×104/mL密度接種25 cm2培養瓶,每瓶5mL。24 h后,以欖香烯(40μg/mL)分別處理 U87 細胞0(對照組)、1、3、5、7、9 d,用含欖香烯(40μg/mL)的培養液每2 d換液。分別于處理后各個時間點收集各組細胞,PBS洗2次,1000 r/min離心5min,用4℃ PBS懸浮細胞并計數,制成約1×106/mL的單細胞懸液。在振蕩器上,緩慢加入2倍體積預冷-20℃的95%乙醇,充分搖勻,固定。4℃冰箱保存,2周內檢測。檢測當天,固定細胞用PBS洗2次,1000 r/min離心5min,加入RNase A 100 U/mL,置37℃水浴搖床30min,用10μg/mL 含 Triton X-100 的 PI染液染色,4℃避光30min。尼龍網過濾,流式細胞儀檢測,根據DNA直方圖中出現的亞二倍體峰(Ap峰),由CellQuest軟件分析結果并計算凋亡細胞百分率(Apoptosis rate,AR)。
1.2.3 Raf-1、ERK、Bcl-2、Bax 蛋白質表達的Western blot檢測 ①取對數生長期的人源U87膠質瘤細胞,以4×105/孔密度接種于6孔培養板中,培養24 h,再分別與 0、20、40、60 及 80μg/mL濃度的欖香烯共同孵育2 h。②吸掉培養液,PBS沖洗2次(在冰上操作),每孔加裂解緩沖液RIPA buffer[50mm Tris-HCl(pH 7.4),1.0%NP-40,0.25%Na-deoxycholate,150mm NaCl,1mm EDTA,1mm aprotinin,1 mg/mL PMSF,leupeptin and pepstatin]100μL,刮除細胞后混勻 30min,離心,取上清,分光光度計檢測濃度,加入上樣緩沖液調至相同終濃度,94℃煮5min。③配制10%SDS聚丙烯酰胺凝膠,上樣,60 V電泳1 h,然后調至100 V繼續電泳,直至溴酚藍稍跑出,將蛋白從SDS聚丙烯酰胺凝膠轉至PVDF膜上。④加一抗,4℃過夜。加二抗,室溫1 h。⑤ECL(Amersham)檢測,圖像定量分析軟件(ImageQuant 5.2 software,Amersham)分析蛋白條帶。
1.2.4 統計學處理 數據統計采用SPSS 10.0軟件,細胞計數檢測值以表示,數據差異采用方差齊性檢驗及單因素方差分析,P<0.05為差異有統計學意義。
2 結果
2.1 欖香烯呈時間依賴性誘導U87細胞凋亡流式細胞儀檢測結果顯示,U87細胞未經欖香烯處理時,自然凋亡率很低。經40μg/mL欖香烯處理0(對照組)、1、3、5、7、9 d 后,呈時間依賴性誘發凋亡。DNA含量直方圖可見,G0/G1峰前出現明顯的亞二倍體峰(Ap峰),與對照組細胞相比,差異有統計學意義(P<0.05)。見圖1、圖2。
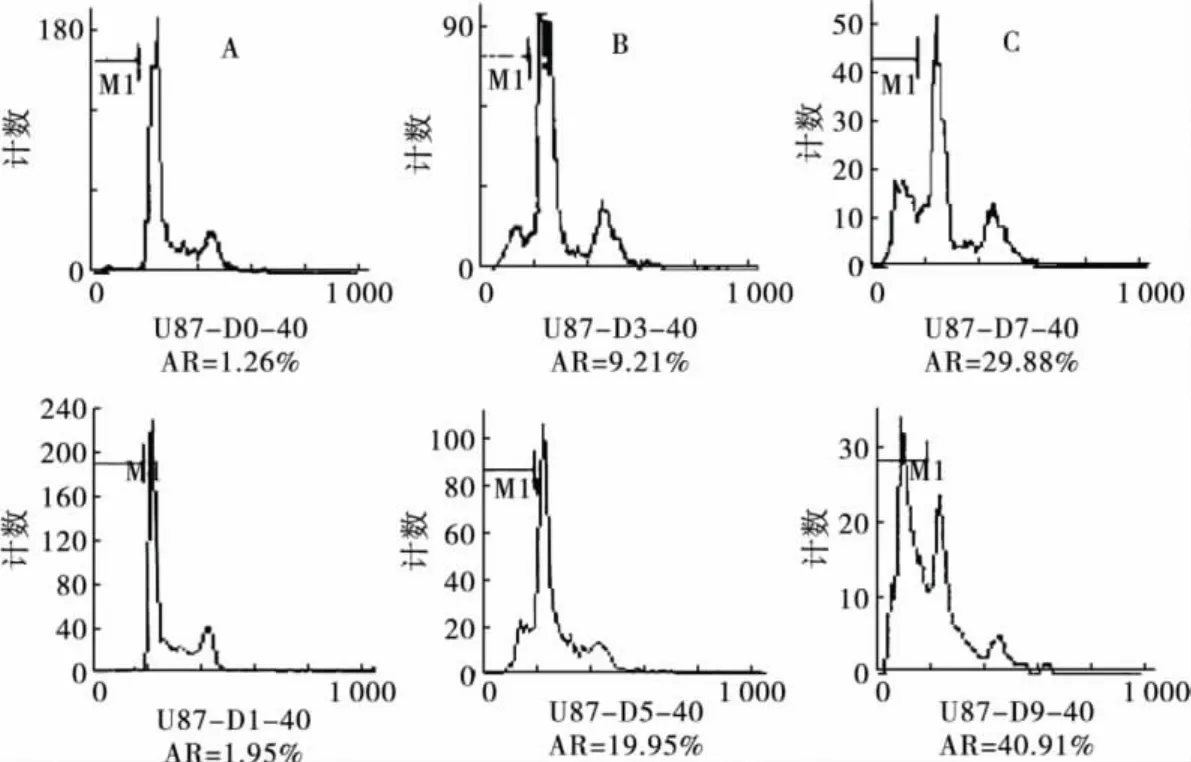
圖1 欖香烯誘導U87膠質瘤細胞凋亡的DNA含量直方圖
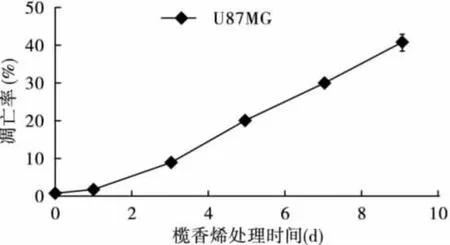
圖2 欖香烯對U87膠質瘤細胞的凋亡誘導
2.2 欖香烯抑制U87膠質瘤細胞Raf/MEK/ERK 信號通路 20、40、60、80μg/mL 欖香烯分別處理U87細胞2 h后,磷酸化的ERK和Raf-1蛋白表達呈現漸進性降低,均低于對照組,但非磷酸化的ERK和Raf-1蛋白無明顯改變,見圖3。
2.3 欖香烯使U87瘤細胞的Bax/Bcl-2比值增高20、40、60、80μg/mL 欖香烯分別處理 U87 細胞48 h后,Bcl-2表達呈現漸進性降低,均低于對照組,但Bax表達無明顯改變,見圖4。

圖3 欖香烯下調U87細胞磷酸化Raf-1和磷酸化ERK蛋白表達水平

圖4 欖香烯下調U87細胞Bcl-2蛋白表達水平,使Bax/Bcl-2比值增加
3 討論
絲裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)是細胞內的一類絲氨酸/蘇氨酸蛋白激酶,普遍存在于多種生物(包括酵母和哺乳動物細胞),參與介導生長、發育、分裂、分化、死亡以及細胞間功能同步等多種細胞過程[8]。MAPK信號通路主要包括:Extracellular signal-regulated kinases(ERK1/2)、Jun N-terminal kinases(JNK)及 p38MAPK 通路[9]。其中 ERK1/2信號通路(即Raf/MEK/ERK信號通路)調控細胞生長和分化,是將胞外的生長和神經營養信號傳到核內的蛋白激酶級聯反應中的重要組分[10-11]。而ERK1/2蛋白的下游底物有很多,包括癌基因Bcl-2。
Lyustikman等[12]報道,多數人類膠質瘤中存在Ras蛋白的活性增高,引起其下游Raf/MEK/ERK信號通路的激活。而該通路的持續激活可以導致癌基因(如Bcl-2)的表達上調,最終腫瘤細胞得以“永生”。本研究表明,對照組(欖香烯濃度為0)的p-Raf-1及p-ERK含量最高,說明對照組的Raf-1及ERK蛋白活性最高。推測對照組的Raf/MEK/ERK信號通路的活性最高,具有組成性激活的特征。
線粒體凋亡途徑是細胞的重要凋亡途徑,該凋亡途徑利用線粒體作為核心成分,激活細胞凋亡。Bcl-2家族成員是調控線粒體介導的凋亡過程中的關鍵調節因子。Bcl-2家族包括促凋亡蛋白(包括 Bax、Bak等)和抗凋亡蛋白(Bcl-2、Bcl-XL、Mcl-1 等)[13]。細胞內 Bcl-2 家族成員中的Bax/Bcl-2的比值增加能誘導線粒體釋放細胞色素c(cyt-c),線粒體內的cyt-c釋放入細胞質后,與凋亡蛋白激活因子-1(Apaf-1)和Caspase-9的前體組合,形成凋亡小體,導致Caspase-9自身剪切和活化,活化的Caspase-9再酶解Caspase-3前體,從而活化Caspase-3,活化的Caspase-3剪切inhibitor ofcaspase-3-activated Dnase(ICAD),于 是Caspase-3-activated DNase(CAD)被激活,剪切DNA,最終誘導細胞凋亡[14]。本研究結果表明,欖香烯可以使U87細胞的Bax/BcL-2比值增加,啟動細胞線粒體凋亡,最終使U87細胞凋亡;從而從側面驗證了Lyustikman等的結論。因此,Raf/MEK/ERK通路的組成性激活對于U87細胞的生存至關重要。
綜上所述,本研究證實:①欖香烯呈時間依賴性誘導U87細胞凋亡。②欖香烯呈劑量依賴性地下調人源膠質瘤U87細胞磷酸化的Raf-1和ERK蛋白的表達,提示欖香烯抑制U87細胞的Raf/MEK/ERK信號通路。③欖香烯下調U87細胞中Bcl-2家族成員中的Bcl-2表達,但對Bax的表達無影響;欖香烯使U87細胞Bax/Bcl-2比值增高。
由此推斷,欖香烯誘導U87細胞凋亡的機制:抑制U87細胞賴以生存的Raf/MEK/ERK通路,從而下調Raf/MEK/ERK通路下游信號癌基因Bcl-2表達,增加Bax/Bcl-2比值,啟動線粒體凋亡程序,最終誘導U87細胞凋亡。
[1]邱虹,韓依軒,闞志生,等.CD105、CD34在人腦膠質瘤中的表達及其臨床意義[J].中國臨床醫學,2007,14(1):40-42.
[2]儲德節,郭水根,姚冬娥.欖香烯乳聯合GP方案治療晚期非小細胞肺癌[J].中國臨床醫學,2010,17(4):491-494.
[3]田力,曹悅鞍,彭朝勝,等.欖香烯乳劑聯合化療治療晚期非小細胞肺癌的臨床觀察[J].中國臨床醫學,2009,16(5):725-727.
[4]徐英輝,董斌,羅其中,等.欖香烯對大鼠膠質瘤C6細胞Bcl-2家族基因及蛋白表達的影響[J].中華醫學雜志,2005,24(85):1700-1703.
[5]周洪語,侯菊生,王勇,等.欖香烯誘導神經膠質瘤細胞凋亡作用的劑量和時間依賴性研究[J].中華腫瘤雜志,2006,4(8):270-271.
[6]Yao YQ,Ding X,Xu YH,et al.Anti-tumor effect of beta-elemene in glioblastoma cells depends on p38 MAPK activation[J].Cancer Lett,2008,264(1):127-134.
[7]姚軼群,徐英輝,周洪語,等.ERK在欖香烯抑制大鼠C6膠質瘤細胞增殖中的作用[J].腫瘤,2007,27(10):777-779.
[8]俞華芳,樊曉明,蔣淼,等.P38MAPK抑制劑對小鼠急性水腫型胰腺炎的作用[J].中國臨床醫學,2008,15(1):82-83.
[9]賈慶哲,葛均波,梁春,等.糖基化終產物對人單核細胞源樹突狀細胞絲裂原激活蛋白激酶表達的影響[J].中國臨床醫學,2008,15(1):1-4.
[10]Qi MS,Elion EA.MAP kinase pathways[J].J Cell Sci,2005,118(16):3569-3572.
[11]趙永順,董斌,吳春明,等.欖香烯阻礙大鼠膠質瘤C6細胞ERK信號通路中Hsp90/Raf-1分子復合體的形成[J].實用藥物與臨床,2011,14(4):274-276.
[12]Lyustikman Y,Momota H,Pao W,et al.Constitutive activation of Raf-1 induces glioma formation in mice[J].Neoplasia,2008,10(5):501-510.
[13]Zhang R,Banik NL,Ray SK.Combination of all-trans retinoic acid and interferon-gamma suppressed PI3K/Akt survival pathway in glioblastoma T98G cells whereas NF-kappaB survival signaling in glioblastoma U87MG cells for induction of apoptosis[J].Neurochem Res,2007,32(12):2194-2202.
[14]Parone PA,James D,Martinou JC.Mitochondria:regulating the inevitable[J].Biochimie,2002,84:105-111.

