鹽度對銅綠微囊藻生長的影響
季高華,許 莉,王麗卿
(上海海洋大學(xué)水產(chǎn)與生命學(xué)院,農(nóng)業(yè)部水產(chǎn)種質(zhì)資源與養(yǎng)殖生態(tài)重點(diǎn)開放實(shí)驗(yàn)室,上海 201306)
近年來,我國有80%以上的湖泊面積面臨水華的威脅,多種藻類均能大量繁殖形成水華;銅綠微囊藻(Microcystis aeruginosa)是其中最典型且常見的水華種類,不僅經(jīng)常在湖泊中形成水華,在淡水養(yǎng)殖池塘中也很常見。對銅綠微囊藻的生長、抑制機(jī)理的探索一直是一個(gè)研究熱點(diǎn)。影響銅綠微囊藻生長的環(huán)境因子眾多,對其研究也較多[1-7],而在河口區(qū)及濱海區(qū),鹽度對銅綠微囊藻的分布和生長也起著重要的影響,但對于此方面的研究少見報(bào)道。
對于鹽度與藻類的關(guān)系,相關(guān)研究大致可分為兩方面。一是不同鹽度對藻類生長的影響,此類研究比較多。Barron等(2002)研究了不同營養(yǎng)條件下鹽度對浮游植物特別是固氮藍(lán)藻生長的影響,發(fā)現(xiàn)在高營養(yǎng)水平下鹽度對浮游植物生長的影響更明顯[8]。Taylor等研究了8種綠藻在不同鹽度下的生長速率,發(fā)現(xiàn)有的藻類在6.8~27.2 PSU(實(shí)際鹽度單位)生長最快,而有的藻類只能耐受0~3.4 PSU的鹽度[9];徐寧等研究了鹽度對錐狀斯氏藻(Scrippsiella trochoided)生長的影響,發(fā)現(xiàn)鹽度為25 g/L是錐狀斯氏藻的最佳生長條件,此時(shí)種群比生長率和最大細(xì)胞數(shù)達(dá)到最高[10]。二是藻類對鹽度的生理反應(yīng),如Jiménez和Niell研究了鹽度對綠色杜氏藻(Dunaliella viridis)葉綠素合成的影響,發(fā)現(xiàn)在氮缺乏和高鹽度下,葉綠素a和葉綠素b的含量都有下降,但是葉綠素b的下降更為明顯[11]。總體看來鹽度與藻類關(guān)系的研究多集中在海水種,對淡水種類的相關(guān)研究較少。而利用鹽度控制藻類的相關(guān)研究就更少,Vincent嘗試了用提高鹽度的方法控制藍(lán)藻水華,發(fā)現(xiàn)鹽度的提高會(huì)導(dǎo)致大型沉水植物對營養(yǎng)物質(zhì)吸收的減少,從而使浮游植物在水體中占優(yōu)勢[12]。
筆者應(yīng)用實(shí)驗(yàn)生態(tài)學(xué)手段,在相同的溫度、光照強(qiáng)度和營養(yǎng)條件下,確定鹽度對銅綠微囊藻生長的影響,探討利用鹽度控藻的可能性,旨在為微囊藻防治提供基礎(chǔ)數(shù)據(jù)。
1 材料與方法
1.1 藻液制備
試驗(yàn)藻種為銅綠微囊藻FACHB-469(Microcystis aeruginosa),來源于中國科學(xué)院水生生物研究所淡水藻種庫。將藻種(約300 mL)在與試驗(yàn)培養(yǎng)條件相同情況下放置兩晝夜使其穩(wěn)定,取處于指數(shù)生長期的上層藻液接種。以每個(gè)三角燒瓶中培養(yǎng)液100 mL計(jì),接種后銅綠微囊藻的初始密度為1.2×107cells/mL,置于恒溫培養(yǎng)箱中一次性培養(yǎng)。
1.2 試驗(yàn)設(shè)計(jì)
設(shè)置 1、2、3、4、5、7、9 和 11 共 8 個(gè)鹽度梯度和一個(gè)鹽度為0的對照組,每組設(shè)3個(gè)平行樣品。鹽度用蒸餾水和NaCl調(diào)節(jié),ATAGO S/Mill-E型光學(xué)折射鹽度計(jì)測定,培養(yǎng)時(shí)間為14 d。
1.3 培養(yǎng)條件
按照BG-11培養(yǎng)基配置銅綠微囊藻的營養(yǎng)鹽,所有試驗(yàn)在光照培養(yǎng)箱內(nèi)進(jìn)行,(28±1)℃,光源為日光燈光源(1 000 Lx),光暗周期為 14 h,10 h。在培養(yǎng)期間每天定時(shí)搖瓶3~4次。
1.4 計(jì)算與統(tǒng)計(jì)
藻類生長的變化由細(xì)胞密度和生長速率反映出來。試驗(yàn)期間每天定時(shí)取樣,先將三角燒瓶中的藻液搖勻,取0.1 mL置于血球計(jì)數(shù)板上,計(jì)數(shù)細(xì)胞密度。
細(xì)胞比生長速率μ的計(jì)算公式為
μ=(lnNt-lnN0)/(t·ln2)
式中:Nt是第t天的細(xì)胞數(shù)量(個(gè));N0為初始細(xì)胞數(shù)量(個(gè));t為培養(yǎng)時(shí)間(d)。
所用數(shù)據(jù)經(jīng)SPSS17.0處理,采用方差分析、LSD多重比較等方法,選取0.05為顯著性水平。
2 結(jié)果與分析
2.1 生長曲線
由BG-11培養(yǎng)基中銅綠微囊藻各處理組的生長曲線(圖1)表明,較低的鹽度(即鹽度為1)有利于細(xì)胞的生長和分裂,而高鹽度則抑制細(xì)胞生長。在鹽度超過5的三組中(即鹽度為7、9和11),試驗(yàn)開始的24 h內(nèi)藻體即出現(xiàn)發(fā)白、沉底現(xiàn)象,生長速率為負(fù)值。在0到第6天中,1鹽度組的銅綠微囊藻細(xì)胞生長最快,比對照組(鹽度為0)稍快一些(p<0.05);從第3天起,1、2鹽度組和對照組均進(jìn)入指數(shù)生長期,且2鹽度組在第12天進(jìn)入生長穩(wěn)定期;3、4和5鹽度組的指數(shù)生長期較短,在第6天即進(jìn)入生長穩(wěn)定期。
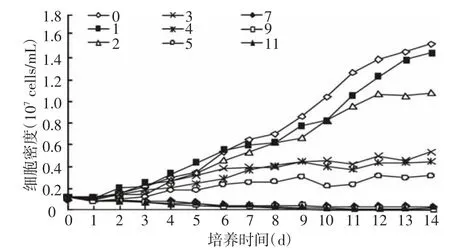
圖1 藻細(xì)胞生長曲線
此外,鹽度相對較高的處理組中(鹽度3以上),處于分裂期的銅綠微囊藻發(fā)育不太正常,出現(xiàn)細(xì)胞變得粗大、個(gè)體分裂數(shù)增多等現(xiàn)象。這可能是由于高鹽度對細(xì)胞造成的傷害,也可能是該藻適應(yīng)高鹽脅迫的一種生理機(jī)制。
2.2 生長速率與最大細(xì)胞密度
銅綠微囊藻各鹽度處理組生長速率的總體趨勢是隨鹽度的增大而減小,且1鹽度組的生長速率與對照組很接近,約為0.257 cells/d(表1);在試驗(yàn)鹽度范圍內(nèi),鹽度超過5的處理組生長速率為負(fù)值。銅綠微囊藻的各處理組細(xì)胞最大密度的趨勢也是隨鹽度的增大而減小,對照組的藻細(xì)胞最大密度為最大,約 1.53×107個(gè)/mL(見圖 2),明顯高于 3~5鹽度組。

表1 不同鹽度下微囊藻的生長速率(平均值±標(biāo)準(zhǔn)差)
不同鹽度對銅綠微囊藻生長的影響有顯著差異(p<0.05)。由方差分析可知,銅綠微囊藻各鹽度處理組的生長速率差異顯著;通過1~5鹽度組的LSD多重比較可知,除了1鹽度組與對照組的差異不顯著(p>0.05),其余各處理組間差異均達(dá)到顯著水平(p<0.05);且 1、2 鹽度組分別與 3、4、5 鹽度組的差異極顯著(p<0.01),3鹽度組與4鹽度組的差異顯著(p<0.05),3、4鹽度組和5鹽度組間也達(dá)到極顯著水平(p<0.01)。由相關(guān)分析可知,鹽度與銅綠微囊藻生長速率之間的相關(guān)系數(shù)為0.971,二者呈極顯著相關(guān)(p<0.01)。
當(dāng)鹽度在2~5時(shí),銅綠微囊藻的生長速率(μ)隨鹽度(S)升高而降低,相關(guān)方程為
μ=-0.040 3S+0.295 9(R2=0.967 1)。根據(jù)此公式推算,致死鹽度約為7.3,與試驗(yàn)結(jié)果基本一致。
細(xì)胞最大密度與生長速率兩者之間的對比關(guān)系見圖2。從圖2中可見,細(xì)胞最大密度與生長速率的變化趨勢相類似,兩者都是在鹽度2~3時(shí)發(fā)生了跳躍式的變化,鹽度3的生長率為0.155 cells/d。
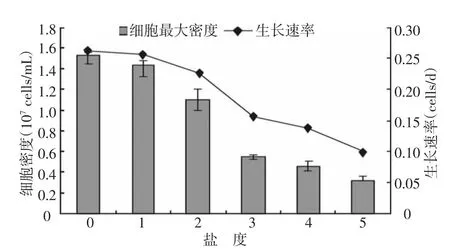
圖2 細(xì)胞最大密度與生長速率的對比
3 討論
關(guān)于鹽度影響藻類生長機(jī)制的報(bào)道不多,對于藻細(xì)胞而言,在高鹽度下生長需要更多的能量以維持其正常的滲透壓以及特定的離子濃度,從而使用于生長的能量減少。近年來,研究者對藻類耐鹽機(jī)制作了進(jìn)一步的研究,特別是對Na+在藻類耐鹽生理上的作用獲得了不少證據(jù)。有研究者在Tetraselmis virldis的質(zhì)膜中,發(fā)現(xiàn)了Na+轉(zhuǎn)運(yùn)ATP酶,有證據(jù)顯示它在細(xì)胞質(zhì)離子動(dòng)態(tài)平衡中起著關(guān)鍵作用[13]。另有研究指出,離子傳遞系統(tǒng),特別是Na+的傳遞,是藻類耐鹽的最重要決定因素(Serrano et a1,1999)。Strizh等最近的研究也證實(shí),Tetraselmis viridis在適應(yīng)高濃度NaC1介質(zhì)時(shí)會(huì)誘導(dǎo)Na+-ATP酶的合成[14]。至于陰離子如Cl-,是否存在類似的作用機(jī)制,目前鮮有相關(guān)報(bào)道。
鹽度是影響水生生物原生質(zhì)滲透壓的一個(gè)重要因素。由于不同水域的鹽度不同,變化幅度也各異,長期在各種鹽度不同的水域中生活的浮游微藻,對生活環(huán)境的鹽度變化均有其一定的適應(yīng)范圍和最適范圍。鹽度較高的水域有利于硅藻的繁殖,而不利于喜淡水生境的藍(lán)藻繁殖。正如試驗(yàn)中9組培養(yǎng)液中的銅綠微囊藻的生長情況所顯示,銅綠微囊藻和其它水生生物一樣,對生活環(huán)境的鹽度變化有一定的適應(yīng)范圍,在適應(yīng)范圍內(nèi)又存在最適鹽度范圍,在此范圍內(nèi)藻類生長繁殖最快,一旦超過最適范圍,過高或過低的鹽度都會(huì)對藻類細(xì)胞造成傷害,直至死亡(圖1)。在試驗(yàn)開始的24 h內(nèi),鹽度超過5的三組中(即鹽度為7、9和11),藻體出現(xiàn)發(fā)白、沉底現(xiàn)象,生長速率為負(fù)值;并且在整個(gè)試驗(yàn)過程中鹽度相對較高的處理組中(3以上),處于分裂期的銅綠微囊藻發(fā)育不太正常,出現(xiàn)細(xì)胞變得粗大、個(gè)體分裂數(shù)增多等現(xiàn)象。圖2顯示,銅綠微囊藻各鹽度處理組生長速率的總體趨勢是隨鹽度的增大而減小,且1鹽度組的生長速率與對照組很接近。作為淡水藻類,鹽度小于1的水體銅綠微囊藻均能生長;當(dāng)鹽度大于2時(shí),會(huì)抑制與破壞藻細(xì)胞的分裂,甚至對藻細(xì)胞自身的細(xì)胞結(jié)構(gòu)產(chǎn)生嚴(yán)重的破壞。
4 結(jié)論
銅綠微囊藻較適合生長于鹽度較低的淡水環(huán)境中,在1~5鹽度范圍內(nèi),銅綠微囊藻的生長速率隨鹽度上升而下降;最大耐受鹽度在7左右。利用鹽度控制湖泊水庫或池塘銅綠微囊藻水華的發(fā)生并不可行,因其致死鹽度較高。
[1]胡小貞,馬祖友,易文利,等.4種不同培養(yǎng)基下銅綠微囊藻和四尾柵藻生長比較[J].環(huán)境科學(xué)研究,2004,17(1):55-57.
[2]易文利,金相燦,儲昭升,等.不同質(zhì)量濃度的磷對銅綠微囊藻生長及細(xì)胞內(nèi)磷的影響[J].環(huán)境科學(xué)研究,2004,17(1):58-61.
[3]連 民,劉 穎,俞順章,等.氮、磷、鐵、鋅對銅綠微囊藻生長及產(chǎn)毒的影響[J].上海環(huán)境科學(xué),2001,20(4):166-170.
[4]易文利,王國棟,劉選衛(wèi),等.氮磷比例對銅綠微囊藻生長及部分生化組成的影響[J].西北農(nóng)林科技大學(xué)學(xué)報(bào):自然科學(xué)版,2005,33(6):151-154.
[5]譚 香,沈 宏,宋立榮.三種水華藍(lán)藻對不同磷濃度生理響應(yīng)的比較研究[J].水生生物學(xué)報(bào),2007,31(5):693-699.
[6]王兆新,袁峻峰,楊紅軍,等.三種有機(jī)物對銅綠微囊藻異養(yǎng)生長的影響 [J].上海師范大學(xué)學(xué)報(bào):自然科學(xué)版,2001,30(1):97-98.
[7]錢 蕓,戴樹桂,劉廣良,等.硝酸鑭對銅綠微囊藻生長特性的影響[J].中國環(huán)境科學(xué),2003,23(1):7-11.
[8]Barron S,Weber C,Marino R.Effects of varying salinity on phytoplankton growth in a low-salinity coastal pond under two nutrient conditions[J].Marine Biological Laboratory,2002,203:260-261.
[9]Taylor R,Fletcher R L,Raven J A.Preliminary Studies on the Growth of Selected"Green Tide"Algae in Laboratory Culture:Effects of Irradiance,Temperature,Salinity and Nutrients on Growth Rate[J].Botanica Marina.,2001,44(4):327-336.
[10]徐 寧,呂頌輝,陳菊芳,等.溫度和鹽度對錐狀斯氏藻生長的影響[J].海洋環(huán)境科學(xué),2004,23(3):36-38.
[11]Jiménez C,Niell F X.Influence of high salinity and nitrogen limitation on package effect and C/N ratio in Dunaliella viridis[J].Hydrobiologia,2003,492(1):201-206.
[12]Vincent W J.Nutrient partitioning in the upper Canning River,Western Australia,and implications for the control of cyanobacterial blooms using salinity[J].Ecological Engineering,2001,16(3):359-371.
[13]Popova L,Balnokin Y,Dietz K,et al.Na+-ATPase from the plasma membrane of the marine alga Tetraselmis(Platymonas)viridis forms a phosphorylated intermediate[J].FEBS Letters,1998,426(2):161-164.
[14]Strizh I G,Popova L G,Andreev I M,et al.Possible Changes of Na+-ATPase Kinetic Characteristics in Tetraselmis viridis Microalga upon Adaptation to Various Concentrations of NaCl[J].Doklady Biochemistry and Biophysics,2002,383(1):75-78.

