高效液相色譜法測定魚粉中組胺含量
梅光明 ,郭遠明 ,陳雪昌 ,張小軍 ,朱敬萍 ,李鐵軍 ,龍 舉
(1.浙江海洋學院海洋與漁業研究所,浙江海洋水產研究所,浙江舟山 316100;2.浙江省海水增養殖重點實驗室,浙江舟山 316100)
組胺為一種生物胺,可在許多動植物中發現,是生物體中的組氨酸在微生物脫羧酶的作用下脫羧而產生[1],少量的組胺不僅是機體炎癥反應和免疫損傷的重要介質之一,而且對應答和炎癥反應有著重要的調節作用[2]。但過量的組胺通過通過與細胞膜上的兩類受體H1和H2作用而發生組胺中毒[3]。魚粉作為優質的動物蛋白飼料原料被廣泛使用于動物生產中。實際上使用不新鮮、腐敗霉變的魚制作的魚粉很容易引起組胺含量過高,從而引起一系列組胺中毒事故[4-6]。我國食品衛生標準對水產品中的組胺限量有規定要求,但是還沒有制定魚粉組胺的限量標準。目前報道組胺的測定主要有分光光度法[7]、熒光檢測法[8]和液相色譜分析法[9-12]。由于魚肉基質的復雜性,普通光譜法容易受雜質干擾,定量不準確,因而本文探討了利用高效液相色譜法來測定魚粉飼料中的組胺。
1 材料與方法
1.1 材料
所用飼料為市售常見魚粉飼料。
1.2 主要試劑
碳酸氫鈉、氫氧化鈉、氨水(濃度25%~28%)為分析純,高氯酸為優級純,甲醇、乙腈、丙酮和丹磺酰氯均為色譜純,鹽酸組胺標準品(C5H9N3.2HCl,德國 Dr.公司),純度>99%。
0.4 mol/L 高氯酸溶液:取 24 mL 高氯酸(ρ=1.67 g/mL),用水稀釋至 1 000 mL;2 moL/L 氫氧化鈉:取4.0 g氫氧化鈉溶于50 mL水中;10 mg/mL丹磺酰氯溶液:稱取0.20 g丹磺酰氯,用20 mL丙酮溶解;鹽酸組胺標準儲備液;準確稱取8.3 mg的標準品于5 mL容量瓶中,用純水溶解并定容,配成標準儲備液,折算成組胺濃度為1.00 mg/L,避光4℃冷藏保存,使用時用水稀釋成適當濃度的標準工作液。
1.3 主要儀器與設備
Waters 600E高效液相色譜儀(配2489紫外檢測器),美國Waters公司;AL204型電子天平,瑞士梅特勒-托利多儀器有限公司;漩渦振蕩器,德國IKA公司;Centrifuge 5810臺式高速離心機,德國艾本德公司;SHA-B水浴恒溫振蕩器,江蘇常州華普達儀器制造廠。
1.4 實驗方法
1.4.1 樣品提取
稱取1.0 g(精確至0.01 g)樣品于50 mL離心管中,加入10 mL的0.4 M高氯酸溶液,渦旋振蕩2 min,于6 000 r/min離心6 min,上層清液移入25 mL棕色容量瓶中。殘渣再用10 mL高氯酸溶液提取1次,離心后上清液合并于容量瓶中,最后用0.4 M高氯酸溶液定容至25.00 mL。取出1.0 mL移入5 mL容量瓶中,依次加入100 μL的2 moL/L氫氧化鈉溶液、300 μL飽和碳酸氫鈉溶液和2 mL丹磺酰氯溶液,蓋緊蓋子,在水浴恒溫振蕩器中50℃下避光反應50 min。反應完畢后,加入100 μL濃氨水,靜置30 min,用已經定容至5.0 mL,振蕩混勻,取適量的溶液過0.45 μm的有機相針式濾膜,供液相色譜測定。
1.4.2 色譜條件
色譜柱:Waters Sunfire-C18 柱(250 mm×4.6 mm,5 μm);流動相及流速:水—乙腈(10+90,含 0.01 mol/L 乙酸銨)+0.01 mol/L 乙酸銨(75:25);流速:1.0 mL/min;柱溫:30 ℃;進樣量:20 μL;檢測器:紫外檢測,檢測波長為254 nm。
1.4.3 標準曲線
準確移取組胺標準貯備液,用純水稀釋成濃度分別為 2.0、5.0、10.0、20.0、40.0 和 80.0 μg/mL 的標準品工作液各1 mL,然后按照1.4.1的衍生化步驟反應處理后供高效液相色譜分析。根據組胺標準品的保留時間定性,以峰面積為縱坐標,以組胺濃度為橫坐標,繪制標準曲線。
1.4.4 回收率和精密度
稱取1.00 g飼料樣品,分別向其中加入一定量的不同濃度的組胺標準溶液,旋渦混勻放置30 min,然后再進行提取、衍生化反應和凈化后進行高效液相色譜分析。
2 結果與討論
2.1 衍生劑的選擇
組胺分子中缺少發色基團,本身無紫外吸收,因此為了提高檢測的靈敏度及其響應,必須衍生化反應才能經紫外檢測。衍生方法有柱前衍生[13-14]和柱后衍生[15-16],常見的衍生劑有鄰苯二甲醛(OPA)[13]、丹磺酰氯[17]、偶氮試劑[7]、苯甲酰氯[18]等。
鄰苯二甲醛(OPA)存在衍生試劑易失效、衍生物不穩定等不足之處,有文獻報道組胺的OPA-亞硫酸鈉衍生物的穩定性僅為20 min[19],采用偶氮試劑比色法測定飼料中的組胺,易受魚粉中雜質的干擾,苯甲酰氯也是測定組胺常用的衍生試劑之一,但苯甲酰氯不溶于水,與提取液分層,導致后續衍生化效果不佳,因此本實驗采用了丙酮溶解的丹磺酰氯作為衍生試劑,能夠保證衍生化效率。組胺與丹磺酰氯的反應式如圖1所示。
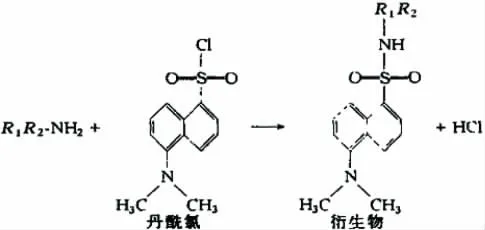
圖1 組胺衍生化反應示意圖Fig.1 Schematic diagram of histamine derivatization reaction
2.2 色譜圖
在上述實驗條件下,得到組胺標準品、空白及空白加標樣品色譜圖如圖2~4所示。
由圖2~4結果可見,用本實驗中的方法對魚粉樣品中的組胺進行提取、衍生化反應后經高效液相色譜檢測,色譜圖峰型較好,信號響應高,且無干擾雜峰,說明整個方法的提取和衍生化反應效果好。
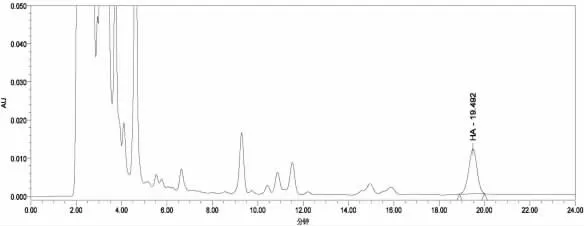
圖2 20.0 μg/mL組胺標準品衍生化后色譜圖Fig.2 Chromatogram of histamine standard after derivatization

圖3 陰性魚粉樣品衍生化后色譜圖Fig.3 Chromatogram of negative fish meal sample after derivatization
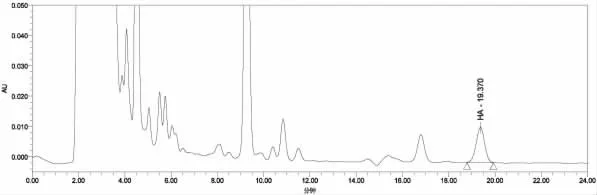
圖4 陰性魚粉樣品300 mg/kg組胺加標衍生化色譜圖Fig.4 Chromatogram of negative fish meal after derivatization spiked at 300 mg/kg histamine
2.3 線性范圍及檢測限
圖5為陰性魚粉樣品50 mg/kg組胺加標衍生化反應后的色譜圖,目標峰信噪比大于10,方法回收率大于70%,由此可知50 mg/kg作為方法的定量檢出限可以滿足魚粉樣品中組胺的檢測需要。
配制組胺的工作曲線濃度系列為2.0~80.0 μg/mL,衍生化反應后用配有紫外檢測器的液相色譜分析,繪制標準曲線如圖6所示,計算相關系數。實驗結果表明:組胺衍生物在2.0~80.0 μg/mL濃度范圍內呈線性關系,相關系數 R2=0.999 3,回歸方程為 Y=3.01×104x+2.56×104。
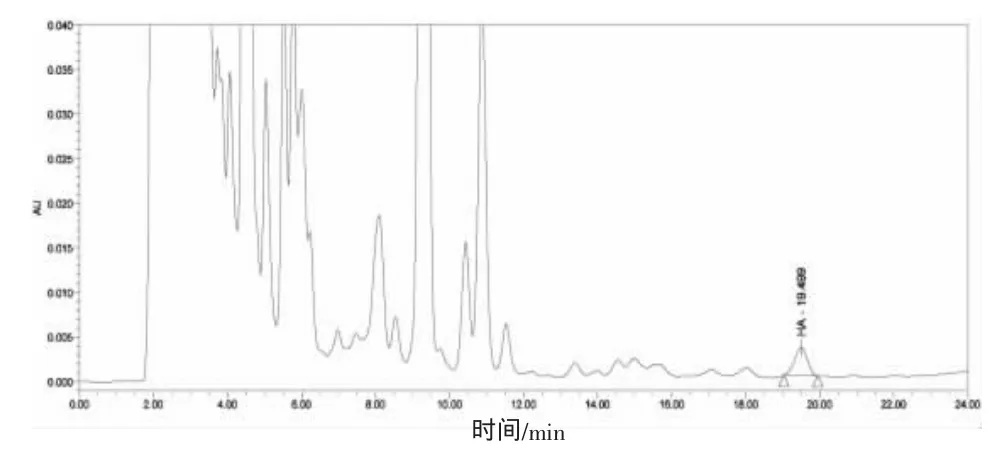
圖5 陰性魚粉樣品50 mg/kg組胺加標衍生化色譜圖Fig.5 Chromatogram of negative fish meal after derivatization spiked at 50 mg/kg histamine
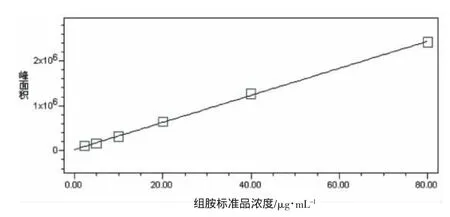
圖6 組胺衍生物標準工作曲線Fig.6 Standard curve of histamine after derivatization
2.4 方法回收率和精密度實驗
為驗證該方法檢測魚粉產品中組胺含量的適用性以及方法的準確度和精密度,選取了市售2種魚粉產品為測試對象,進行加標回收率和精密度實驗。結果表明,2種魚粉中添加組胺濃度為50~1 000 mg/kg范圍內的3個加標梯度下,回收率均大于70%,相對標準偏差小于7%,滿足分析檢測要求。
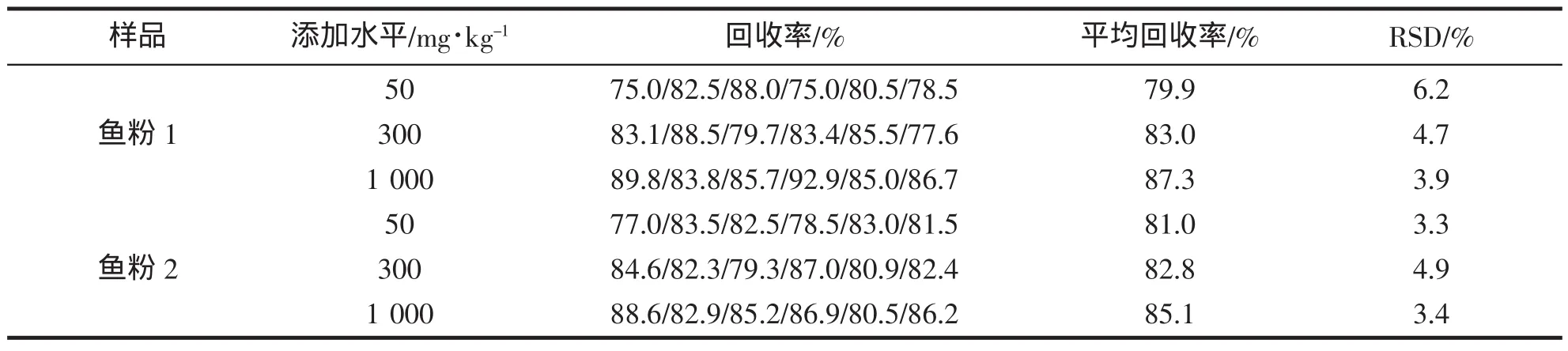
表1 魚粉樣品不同加標濃度下的回收率和精密度實驗Tab.1 Results of recovery and precision of spiked samples
3 結論
本文研究了利用柱前衍生和高效液相色譜儀測定魚粉產品中組胺的含量,建立了合適的樣品提取、衍生化反應條件等前處理方法和最佳色譜分離條件。該方法簡便快速,基體干擾小,線性范圍寬,回收率和檢出限令人滿意,可以適用于魚粉產品中組胺的檢測。

