中國漢族人群GSTM1、GSTT1基因多態性與結直腸癌遺傳易感性的Meta分析
閆書山,王 平,徐棟花,孫倍成※
(1.南京醫科大學第一附屬醫院肝移植中心,南京210000;2.南京江北人民醫院感染科,南京210048)
谷胱甘肽 S-轉移酶(glutathione S-transferase,GST)是人體內重要的Ⅱ相代謝酶系,能夠通過結合各種親電子的化合物(包括環境致癌物質及其中間代謝產物),使其水溶性增加并排出體外,從而起到解毒作用[1,2]。已知人類 GST 有 α(GSTA)、 μ(GSTM)、 θ(GSTT)、π(GSTP)和 σ(GSTS)五種[3,4],目前研究較多的是 GSTM1、GSTT1基因。GSTM1、GSTT1具有基因多態性,其中 GSTM1、GSTT1基因缺失的純合子,缺乏GST的活性,導致機體對外來毒物的解毒能力降低。近年來,越來越多的研究發現,GSTM1、GSTT1 基因多態性與腫瘤的發生關系密切[5],但與結直腸癌發生的關聯,報道并不一致。因此,該研究應用Meta分析方法對GSTM1、GSTT1基因多態性與結直腸癌遺傳易感性的相關研究進行綜合再分析,以探討中國漢族人群中GSTM1及GSTT1的基因多態性與結直腸癌遺傳易感性的關系。
1 材料與方法
1.1 資料來源 通過計算機文獻檢索(PubMed、Em-Base、中國學術期刊全文數據庫、萬方全文數據庫)和文獻追溯等途徑,收集1994年1月至2011年5月國內外公開發表的關于中國漢族人種GST基因多態性與結直腸癌易患性的病例對照研究。采用主題詞、關鍵詞(包括 ccolorectal carcinoma,colorectal cancer,CRC,glutathione S-transferase,GST,GSTT,GSTM,GSTT1,GSTM1,polymorphism,polymorphisms和 genetic polymorphism)及著者相結合的方法進行檢索,檢索語種包括中文和英文。
1.2 納入標準 ①1994年1月至2011年5月國內外公開發表的谷胱甘肽轉移酶基因多態與結直腸癌易感性的病例對照研究;②各文獻提供病例組和對照組的觀察人數;③暴露的定義相同;④各文獻直接或間接地提供綜合的統計指標比值比(OR);⑤各文獻研究假設和方法相似。
1.3 排除標準 對每篇文獻進行質量評估,剔除重復報告、數據不充分、報道信息太少及無法利用的文獻。
1.4 統計分析 用Meta分析進行合并OR值,得出合并OR值及其95%的可信區間(P<0.05時差異有統計學意義)[6]。采用基于χ2檢驗的Q檢驗法分析各研究組間的異質性[7],當P>0.05時即認為異質性不明顯,選用固定效應模型[8];P <0.05時,各研究間存在異質性,選用隨機效應模型[9];發表偏倚用funnel plot法進行分析,當funnel倒漏斗圖左右對稱時代表無發表偏倚;并且用Egger's回歸法[10]進一步對funnel倒漏斗圖的對稱性進行定量評價,P>0.05時不存在發表偏倚。以上統計分析主要在STATA10.1上完成。
2 結果
2.1 研究資料基本情況 依據標準共選入文獻13篇,其中英文2篇,中文11篇;累計病例1480例,對照3057例。暴露定義分別為GSTM1空白基因型、GSTT1空白基因型、GSTM1和GSTT1同時存在空白基因型(表1)。
2.2 Meta分析結果 根據異質性檢驗結果,GSTM1和GSTT1分別按隨機效應模型和固定效應模型計算合并的OR值,GSTM1-GSTT1研究按固定效應模型計算合并的OR值和95%的可信限。合并的結果顯示(表2及圖1~3):GSTM1的空白基因型與結直腸癌的發生有關(ORGSTM1=1.38,95%CI 1.09 ~1.74,POR=0.007);GSTT1的空白基因型與結直腸癌的發生不存在關聯關系(ORGSTT1=1.15,95%CI 1.00 ~1.32,POR=0.058);GSTT1和GSTM1的共同空白基因型與結直腸癌的發生存在關聯,合并的OR值為1.40(95%CI 1.14 ~1.74;POR=0.002)。
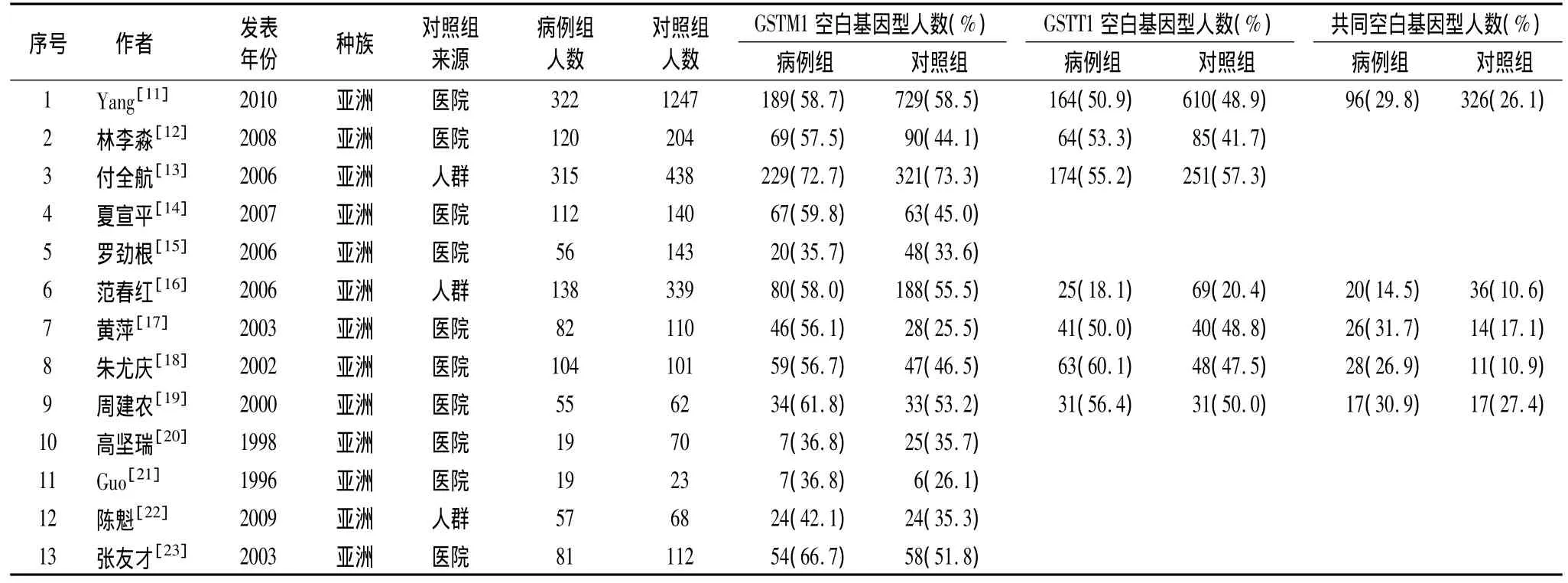
表1 本Meta分析納入研究的基本特征及提取的相關數據
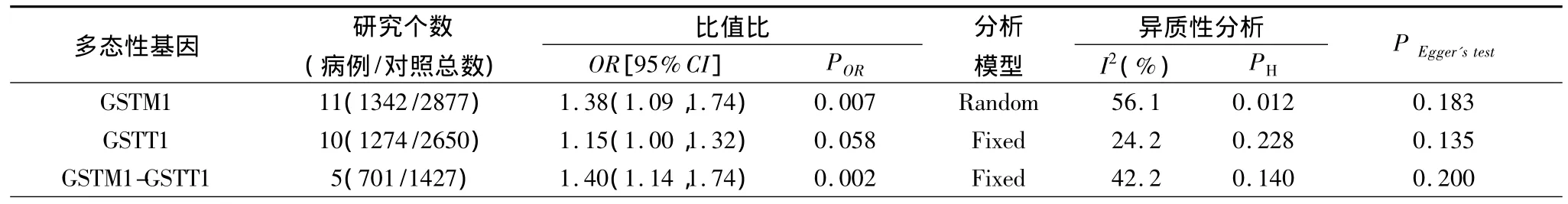
表2 Meta分析結果匯總
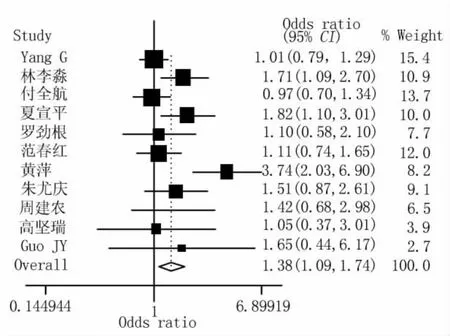
圖1 GSTM1多態性與CRC易感性關聯關系Meta分析的森林圖(隨機效應模型)
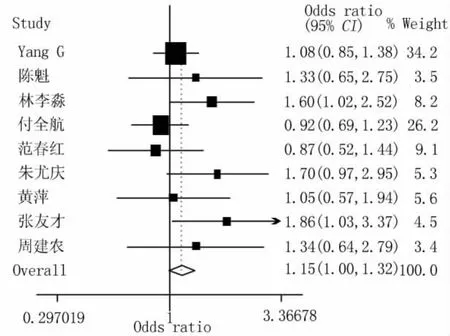
圖2 GSTT1多態性與CRC易感性關聯關系Meta分析的森林圖(固定效應模型)
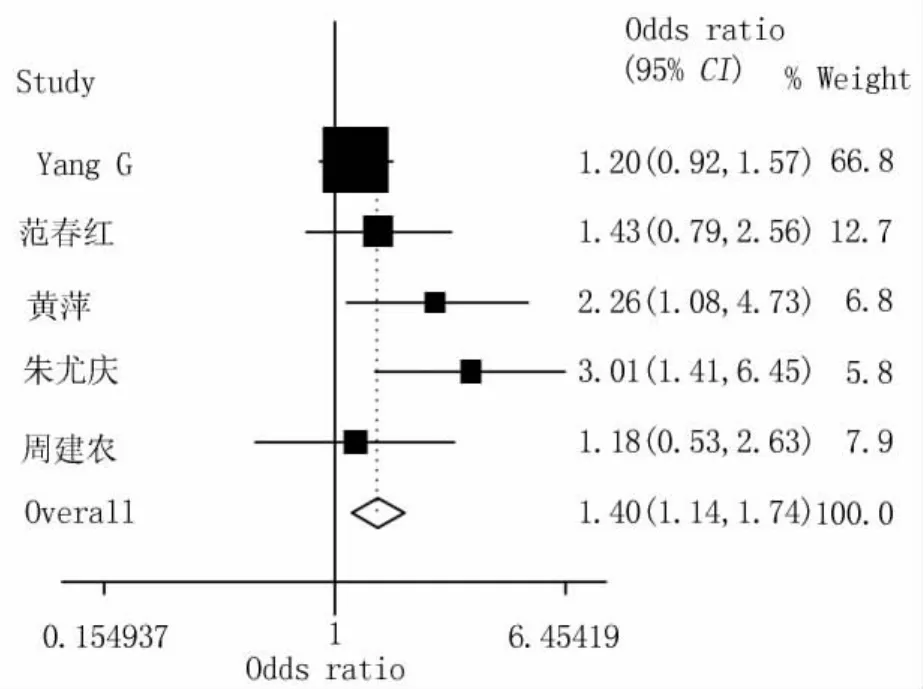
圖3 GSTM1/GSTT1多態性與CRC易感性關聯關系Meta分析的森林圖(固定效應模型)
2.3 發表偏倚分析 Funnel plot法進行分析所采納研究有無發表偏倚,如圖4及圖5所示,funnel倒漏斗圖左右對稱,代表不存在發表偏倚。采用Egger's Regression Test法進一步對funnel倒漏斗圖的對稱性進行定量評價,P>0.05,所以本研究所納入的研究均不存在發表偏倚(表2)。
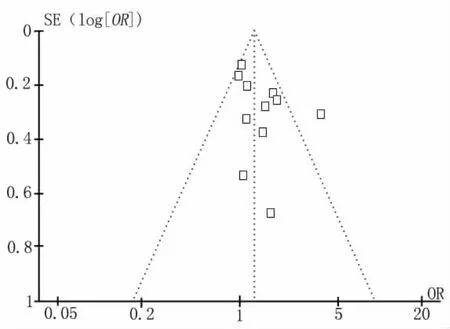
圖4 檢測GSTM1多態性與CRC易感性關聯關系研究的發表偏倚的倒漏斗圖分析
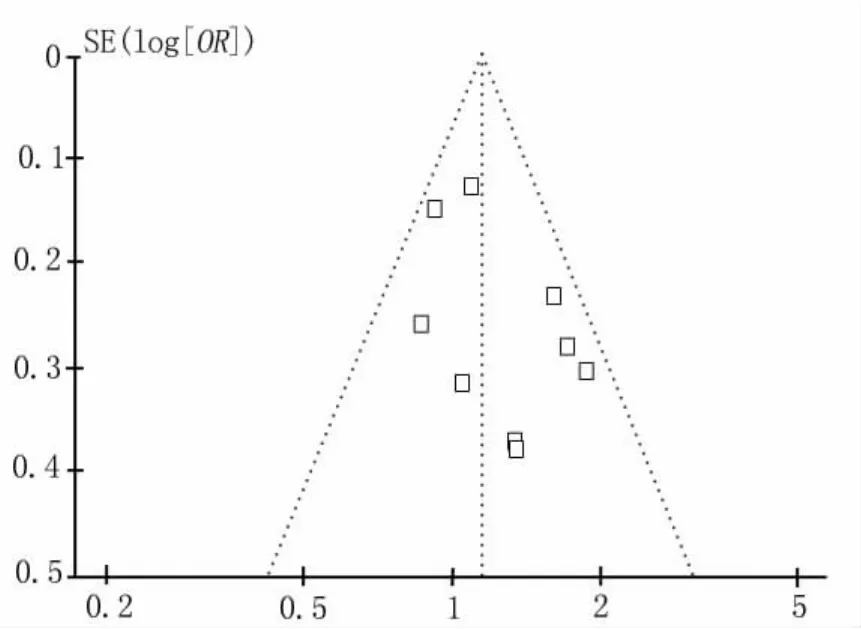
圖5 檢測GSTT1多態性與CRC易感性關聯關系研究的發表偏倚的倒漏斗圖分析
3 討論
結直腸癌的發生既與環境因素相關,又具有遺傳易感性。多環芳烴類、雜環芳香胺類等致癌物在肝內經細胞色素P4501A2氧化作用后,形成前致癌物,隨血液循環進入腸黏膜,在腸上皮細胞內經N-乙酰化轉移酶O的乙酰化作用活化。GST是谷胱甘肽結合反應的關鍵酶,可通過催化谷胱甘肽結合反應的起始步驟,使上述致癌物質轉化為無毒性、高水溶性的代謝產物,促進其排出體外,減少致病[24]。GST基因位點上不同等位基因的個體,對結直腸癌的易感性不同,在GST家族成員中,GSTM1、GSTT1基因的多態性與結直腸癌的發生關系密切。
為明確GSTM1、GSTT1基因多態性與結直腸癌易感性的關聯情況,已有多個研究中心利用Meta分析方法對這一問題進行探討[25-28]。GST(GSTM1、GSTT1)的基因多態性與結直腸癌易感性在歐洲人群中存在關聯關系。Di Pietro 等[1]發現,GSTM1、GSTT1基因缺失型不僅與結直腸癌的發病危險性有關,而且與吸煙、肉類攝入等環境因素有交互作用。但在亞洲人種中,這種關聯關系并不明顯。由于上述Meta分析只納入了少量中文研究,因此GSTM1、GSTT1基因多態性與結直腸癌的關系是否在中國漢族人群中存在關聯關系仍存在明顯爭議,值得進一步研究。
文獻綜述是一種描述性方法,是評價既往同類項目的多項研究結果的良好方法之一,但是主觀評價性太強,特別是對研究結果不一甚至相反的結果更缺少客觀評價,因而不同的綜述者可能會得出不同的結論。另外,單一研究可能由于研究對象的代表性不強或樣本量的局限,導致統計學檢驗效能較低而不能作出明確的結論。Meta分析是一種觀察性研究,它是對以往研究結果進行系統合并以得到所研究問題綜合性結論的定量分析方法,綜合評價研究結果,通過系統合并,增大總樣本量,從而提高統計檢驗的效能,評價各研究結果不一致或矛盾,定量評估效應大小[29]。由于既往研究的樣本量小,GSTM1或GSTT1基因多態性單獨作用的效應較弱等原因,研究效能太低,現有許多相關Meta分析未能得出GSTM1或GSTT1基因缺失型與結直腸癌的發生關系有統計學意義的結果。本Meta分析結果顯示,GSTM1的空白基因型與結直腸癌易感性相關,ORGSTM1=1.38,95%CI 1.09~1.74(POR=0.007);而GSTT1的空白基因型與結直腸癌的發生沒有關聯(ORGSTT1=1.15,95%CI 1.00~1.32,POR=0.058),有待于累積更多的臨床資料進一步深入探討;除此之外,GSTT1和GSTM1的共同空白基因型與結直腸癌也存在關聯關系,合并的OR值為1.40,95%CI 1.14~1.74(POR=0.002)。該結果提示,在中國漢族人群中,攜帶GSTM1或GSTT1的空白基因的個體較兩種基因都存在的個體患結直腸癌的危險性有所增加,且GSTM1和GSTT1空白基因型在影響結直腸癌易感性上可能存在協同作用,為結直腸癌的預防、診斷和治療提供了重要的理論基礎。
[1]Di Pietro G,Magno LA,Rios-Santos F,et al.Glutathione S-transferases:an overview in cancer research[J].Expert Opin Drug Metab Toxicol,2010,6(2):153-170.
[2]Lin D,Meyer DJ,Ketterer B,et al.Effects of human and rat glutathione S-transferases on the covalent DNA binding of the N-acetoxy derivatives of heterocyclic amine carcinogens in vitro:a possible mechanism of organ specificity in their carcinogenesis[J].Cancer Res,1994,54(18):4920-4926.
[3]Slonchak AM,Obolens'ka MIu.Structure and functions of glutathione S-transferase P1-1[J].Ukr Biokhim Zh,2009,81(1):5-13.
[4]Meyer DJ,Coles B,Pemble SE,et al.Theta,a new class of glutathione transferases purified from rat and man[J].Biochem J,1991,274(Pt 2):409-414.
[5]Shukla RK,Kant S,Mittal B,et al.Polymorphism of cytochrome p450,glutathione-s-transferase and N-acetyltransferases:influence on lung cancer susceptibility[J].Niger J Med,2010,19(3):257-263.
[6]Cochran WG.The combination of estimates from different experiments[J].Biometrics,1954,10(1):101-129.
[7]Higgins JP,Thompson SG,Deeks JJ,et al.Measuring inconsistency in meta-analyses[J].BMJ,2003,327(7414):557-560.
[8]Mantel N,Haenszel W.Statistical aspects of the analysis of data from retrospective studies of disease[J].J Natl Cancer Inst,1959,22(4):719-748.
[9]DerSimonian R,Laird N.Meta-analysis in clinical trials[J].Control Clin Trials,1986,7(3):177-188.
[10]Egger M,Davey Smith G,Schneider M,et al.Bias in meta-analysis detected by a simple,graphical test[J].BMJ,1997,315(7109):629-634.
[11]Yang G,Gao YT,Shu XO,et al.Isothiocyanate exposure,glutathione S-transferase polymorphisms,and colorectal cancer risk[J].Am J Clin Nutr,2010,91(3):704-711.
[12]林李淼,閔小彥,陳浩,等.谷胱甘肽轉硫酶基因型與浙江漢族人群散發性大腸癌的易感性[J].中華內科雜志,2008,47(5):413-414.
[13]付全航,高長明,吳建中,等.谷胱苷肽S轉硫酶T1、M1和P1基因多態性與結直腸癌易感性的關系[J].實用癌癥雜志,2006,21(3):247-260.
[14]夏宣平,王文星,蔣益,等.谷胱甘肽轉硫酶M1基因型與漢族潰瘍性結腸炎及大腸癌易感性的關系[J].中華內科雜志,2007,46(7):583-585.
[15]羅勁根,何銘均,柳息洪.谷胱甘肽S轉移酶M1基因多態性與直腸癌的相關性的初步探討[J].解剖學研究,2006,28(1):52-54.
[16]范春紅,金明娟,張揚,等.代謝酶基因多態性與結直腸癌的易感性[J].中華預防醫學雜志,2006,40(1):13-17.
[17]黃萍,周紫垣,劉晉祎,等.重慶地區人群GSTT1和GSTM1基因多態性與結直腸癌易感性研究[J].第三軍醫大學學報,2003,25(19):1714-1717.
[18]朱尤慶,鄧長生,張友才,等.谷胱甘肽S-轉移酶M1、T1基因多態與散發性大腸腺癌遺傳易感性[J].中華內科雜志,2002,41(8):538-540.
[19]周建農,許發培,李忠佑,等.谷胱甘肽轉硫酶M1和T1多態性與大腸癌易患性關系研究[J].江蘇臨床醫學雜志,2000,4(2):90-94.
[20]高堅瑞,陳傳芬,張橋.GSTM1基因多態與肺癌及腸癌易感性研究[J].鎮江醫學院學報,1998,8(4):446-447.
[21]Guo JY,Wan DS,Zeng RP,et al.The polymorphism of GSTM1,mutagen sensitivity in colon cancer and healthy control[J].Mutat Res,1996,372(1):17-22.
[22]陳魁,黃立榮.GSTT1基因多態性與吸煙者結直腸腫瘤易感性的研究[J].中外醫學研究,2009,7(12):19-21.
[23]劉彩霞,蘇烏云.大腸癌的靶向治療進展[J].醫學綜述,2011,16(24):3735-3738.
[24]Nisa H,Kono S,Yin G,et al.Cigarette smoking,genetic polymorphisms and colorectal cancer risk:the Fukuoka Colorectal Cancer Study[J].BMC Cancer,2010(10):274.
[25]Economopoulos KP,Sergentanis TN.GSTM1,GSTT1,GSTP1,GSTA1 and colorectal cancer risk:a comprehensive meta-analysis[J].Eur J Cancer,2010,46(9):1617-1631.
[26]Liao C,Cao Y,Wu L,et al.An updating meta-analysis of the glutathione S-transferase T1 polymorphisms and colorectal cancer risk:a HuGE review[J].Int J Colorectal Dis,2010,25(1):25-37.
[27]Wan H,Zhou Y,Yang P,et al.Genetic polymorphism of glutathione S-transferase T1 and the risk of colorectal cancer:A meta-analysis[J].Cancer Epidemiology,2010,34(1):66-72.
[28]Gao Y,Cao Y,Tan A,et al.Glutathione S-transferase M1 polymorphism and sporadic colorectal cancer risk:an updating Meta-analysis and HuGE review of 36 case-control studies[J].Ann Epidemiol,2010,20(2):108-121.
[29]Walsh D,Downe S.Meta-synthesis method for qualitative research:a literature review[J].J Adv Nurs,2005,50(2):204-211.

