美國獸藥產品不良反應事件管理
溫 芳,劉艷華,楊永嘉,吳好庭,王在時
(中國獸醫藥品監察所,北京 海淀 100081)
獸藥(注:本文獸藥如非特別指明均指化學藥品)不良反應事件管理是獸藥風險管理的重要組成內容,對獸藥不良反應事件的分析、匯總和評價有利于指導和規范獸藥產品臨床合理用藥、有利于鼓勵創新獸藥的研究與發展,并且為獸藥再評價和獸藥使用說明書修訂等提供科學依據,也對獸用藥物流行學研究具有重要的價值和意義。
美國經過多年發展,已形成一套較為完善的獸藥產品不良反應事件管理機制,發布并實施3個獸藥不良反應事件管理行業指南,由畜主、獸醫和獸藥生產商報告不良反應事件,美國食品藥品管理局(FDA)獸藥中心(CVM)對報告的不良反應事件進行收集、分析和評價并將評價結果反饋給生產商等;而我國雖然目前在《獸藥管理條例》和獸藥企業GMP中均規定要建立獸藥產品不良反應報告制度,并報告當地獸醫行政管理部門[1-2],但對于如何管理卻缺乏相關技術以及法規支持,也沒有形成部門間協調和反饋機制[3]。本文通過對美國獸藥產品不良反應事件管理機制的研究,旨在為我國開展相關工作提供參考和借鑒。
1 概述
美國獸藥產品不良反應事件由FDA管理,FDA獸藥中心依據藥品風險管理行業指導原則《良好藥物警戒性規范和藥物流行病學評估的行業指南》中相關要求起草了獸藥產品不良事件管理的3個行業指導原則,經國際獸藥產品注冊技術要求合作和協調委員會批準于2010年6月最終全部發布并實施。
FDA獸藥中心發布獸藥不良反應報告表格(1932、1932a),規定了獸藥不良反應事件提交要求和方式,建立不良反應事件提交追蹤和報告系統(STARS),由CVM的監督和服從部門對獸藥不良反應事件進行分析、匯總和評價,以期對可能需要的獸藥安全性和有效性特性進行調整。
2 行業指導原則
依據《良好藥物警戒性規范和藥物流行病學評估的行業指南》相關原則要求,CVM制定并頒布了3個獸藥產品藥物警戒性-不良反應事件報告管理、不良反應事件報告條款目錄控制和不良反應事件提交數據要素3個行業指導原則,這3個指導原則文件最終由VICH批準,被成員國和一些觀察員國家采用,并于2010年6月起正式實施。這3個指南文件對不良事件報告的管理、提交程序和提交數據元素等方面進行了標準化規定。具體簡介如下。
2.1 不良事件報告管理(GL24VICH) 這一指南中的術語和定義傾向于協調一致先前使用的相同概念術語,并對指南范圍內的術語或行為進行定義,規定了不良事件報告的提交程序。該指南僅適用于市場化使用后的獸藥產品自然發生的不良反應事件。
2.2 術語控制列表(GL30VICH) 管理當局和行業合作制定了控制術語列表和它的維護程序,為將來發展需要,這一列表提供了一個足夠記錄、搜索和分類的列表目錄,并規范了術語分組、分組大小以滿足標準化的輸入和分析。這個術語列表通過VICH秘書處網站和RA網站可以獲得,并依據維護程序要求保持在線更新。詳細描述了提交AER所要求的強制性數據元素和非強制性數據元素,并對數據元素描述內容和格式進行標準化要求。
2.3 不良事件報告提交數據元素(GL42VICH) 當收到遵守VICH指導原則的電子報告,所有的系統必須能輸入和儲存所有的報告信息包括標準術語和代碼,沒有信息缺失。在特定情況下,對提交一些不完整的不受控制內容條款有一些規定,這些數據元素足夠全面覆蓋來自大多數原始資料、不同的設置和傳送方式或要求的復雜報告。
3 不良反應事件報告的提交
FDA鼓勵獸醫或畜主報告獸藥不良事件,通常首先應報告給獸藥產品生產商的技術服務獸醫,并完成1932表格填寫,若為FDA未批準用作動物用藥或不希望提交給獸藥生產商可直接提交給CVM,并完成1932a表格填寫,1932和1932a表格均為CVM設計用于收集不良反應事件,這兩個表格均可在FDA網站查詢到,填寫內容需符合獸藥產品不良反應事件3個指導原則對提交信息的要求,標準化的不良反應事件提交元素利于國際間的協調。
“獸藥產品藥物警戒-不良反應事件報告管理”指導原則中規定不良反應事件報告(AER)信息流轉如圖1。
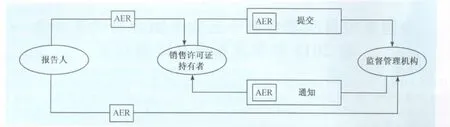
圖1 AER信息流轉示意圖
CVM收到一份AER后,收錄到中心資料控制部并設定一個提交編號,交給CVM 監督與服從部處理,CVM安全評價人員(有經驗的臨床獸醫)評價每一個AER,評價人員將所有的相關信息,如年齡、動物種、病史和合并用藥等輸入Oracle數據庫,該數據庫的名稱為提交追蹤和報告系統(STARS),評價人員用Kramer計算方法,對報告的每個臨床表現進行評估,藥物和臨床相關程度評價分值為-9到+7之間。臨床表現評價分值≥0被認為是可能的或確切地與藥物相關。
4 對不良反應事件報告的分析評估
CVM有專職獸醫對獸藥不良反應事件進行評價。不良反應事件是指由使用獸藥引起的任何不良反應,不良反應事件包括產品的無效、缺陷和與動物藥品使用相關的人類安全,收集不良反應報告的目的是進行數據收集,對于新獸藥(銷售少于3年)不良反應事件的收集是很重要的[4],這些數據用來評估趨勢和臨床信號出現的相對頻率和療效缺失,評估對最初批準標簽的修訂、制劑改變、產品包裝改變或進一步的臨床研究,少數情況下,這些信息可能導致藥物從市場退出,并且應用這些數據監控包括野生動物和人類使用的安全關注點標簽外用藥[5]。CVM通過多種渠道和公眾進行相關信息交流包括定期在其網站上發布對不良反應事件的評價和分析[6]。
CVM在網站上發布的藥物ProHeart 6不良反應評價案例如下。
1只4歲的閹割雜種狗,身體狀況良好,犬惡絲蟲檢測陰性,接受Proheart 6標簽劑量注射,8d后嘔吐。標簽最初標注的不良反應有嘔吐、腹瀉、疲倦、體重減輕、驚厥、發燒等;引起嘔吐的可能因素有飲食改變、腸內寄生蟲、嘔吐病史及器官畸形等;有用的信息包括獸醫進行的身體檢查、用藥史、藥品的評價、獸醫的意見和查詢的資料;不完整的信息包括有飲食結構的改變、寄生蟲檢查陰性、未進行血液檢測。結果見表1。
依據Kramer判定標準判定嘔吐可能和用藥有關。
5 建議和意見
由于每個國家養殖業發展水平及人民飲食結構和習慣的不同導致動物養殖方式和品種不同,所以我們應在參考和借鑒一些國家先進經驗的基礎上,建立一套適合我國國情的獸藥產品不良反應事件管理機制。通過對美國獸藥不良反應事件管理的研究,對我國獸藥產品不良反應事件管理提出以下幾點思考意見和建議。

表1 應用校準后的kramer方法計算得出的評價分數
在管理層面上看,美國形成一套完善的不良反應報告體系。獸醫和畜主可將獸藥不良反應事件報告給獸藥生產商,也可直接報告給CVM,并有專職獸醫進行評價,評價信息通過多種渠道反饋給獸藥生產商等,并且這些數據可作為獸藥再評價的技術資料以及評判獸藥從市場退出的依據。而我國雖然在《獸藥管理條例》和獸藥GMP驗收中都要求建立獸藥不良反應報告制度,并報告當地獸醫行政管理部門,但缺乏完整實施體系,這也是地方獸醫行政部門對接受不良反應報告存在的一些困擾。
從技術層面上看,美國發布3個不良反應事件管理指南規定了不良反應報告流程,并對不良反應報告中的要素進行標準化定義,1932表格和1932a表格依據這3個不良反應事件管理指南進行設計,并通過校準后的Kramer計算方法對這些報告的不良反應事件進行分析和評價,為獸藥再評價、獸藥安全使用以及人類安全保障提供科學依據。我國目前基本未開展相關工作,美國相關工作對我國具有重要借鑒意義。
通過對美國獸藥不良反應事件管理研究可以看出,因其側重從單個報告的臨床癥狀進行判斷,所以對獸藥安全性評價也有其局限性,美國已有獸醫流行病學家參與到不良反應事件評價工作之中,所以我國在開展獸藥不良反應事件管理的同時,也應開展藥物流行病學研究,運用藥物流行病學的病歷對照的方法來鑒別不良反應事件在用藥和非用藥動物中出現的頻率,以期對獸藥的安全性使用做出一個更客觀和科學的評價;另外我國養殖動物品種較多包括有一些特種經濟動物等,而很少有專用于這些動物的獸藥,所以盡快在我國開展獸藥不良反應事件管理,也可指導使用者在一些特種經濟動物方面更加安全有效的使用獸藥,也可更好地促進我國養殖業的健康穩定發展。
[1]中華人民共和國國務院.獸藥管理條例[Z].中華人民共和國國務院令第404號.2004.
[2]中華人民共和國農業部.獸藥生產質量管理規范[Z].中華人民共和國農業部令第11號.2002.
[3]馮忠武.試論獸藥管理法規的立法原則[J].北京:中國獸藥雜志,2002,36(12):3-5.
[4]Hampshire V A,Doddy F M,Post L O,et al.Adverse drug event reports at the United States Food and Drug Administration Center for Veterinary Medicine[J].J Am Vet Med Assoc,2004,224(2):177.
[5]Keller W C,Bataller N,Oeller D S.Processing and evaluation of adverse drug experience reports at the Food and Drug Administration Center for Veterinary Medicine[J].J Am Vet Med Assoc,1998,213(2):208-211.
[6]Bataller N,Keller W C.Monitoring adverse reactions to veterinary drugs.Pharmacovigilance[J].Vet Clin North Am Food Anim Pract,1999,15(1):13-30,vii-viii.

