不同低溫處理對甜瓜幼苗生長和根系生理特性的影響
李琦,別之龍,牛蒙亮,劉志雄,張朝霞
(華中農業大學園藝林學學院/園藝植物生物學教育部重點實驗室,湖北武漢,430070)
近年來,厚皮甜瓜設施栽培面積持續增長,但在春季設施栽培中,育苗及定植初期常常會遭受低溫冷害侵襲,導致幼苗受到傷害,從而影響秧苗的正常生長,導致品質和產量降低,因而冷害是厚皮甜瓜生產中面臨的一個突出問題[1]。
寒冷季節露地栽培作物在白天和夜間都會遇到持續低溫冷害,而在設施栽培中,由于設施的升溫和保溫作用,白天的溫度較為適宜,但晚上有時會遇到低于生長發育適溫10℃左右的夜間低溫。夜間低溫影響番茄光合作用及物質積累,從而影響番茄幼苗的生長發育,以及品質和產量[2]。目前,關于晝夜低溫脅迫對甜瓜影響的報道較多,但是關于晝夜低溫與夜間低溫脅迫對甜瓜幼苗生長是否具有差異鮮有報道。本試驗通過人工氣候箱控制不同的溫度,研究晝夜低溫以及夜間低溫脅迫對甜瓜幼苗生長、根系MDA含量及活性氧代謝的影響,為探討低溫脅迫影響甜瓜幼苗生理的機制奠定基礎。
1 材料與方法
1.1 材料與處理
供試甜瓜(Cucumis melonL.)品種為伊麗莎白(用Y表示)和玉金香(用J表示),分別購自北京利得農業科技開發公司和甘肅省河西瓜菜科學技術研究所。
試驗于2011年春季在華中農業大學進行。選擇籽粒飽滿、色澤正常的種子,浸種催芽后播在50孔的塑料穴盤中,基質配方為泥炭∶珍珠巖=2∶1(體積比),配制過程中每1 m3基質摻入1.5 kg復合肥。待幼苗長至3葉1心時,選取生長一致的植株放入HP1500GS-B型人工氣候植物箱(武漢瑞華儀器設備有限公司),晝夜溫度為25℃/18℃,光照為95 μmol·m-2·s-1,光照時數為12 h,相對濕度為90%。在生長箱內適應3 d后開始處理,以正常溫度(25℃/18℃,12 h)為對照(CK),分別進行晝夜低溫D(10℃/5℃,12 h)及夜低溫 YD(20℃/5℃,12 h)處理,每個處理3次重復,每次重復50株苗。處理7 d后進行第一次取樣,隨機取25株,測量生長和生理指標。取樣后停止低溫處理,將余下的植株放回正常溫度(25℃/18℃,12 h)下生長,待恢復 7 d后再進行第二次取樣,取剩下25株進行分析。試驗數據用SAS 9.1軟件進行分析。
1.2 測定方法
丙二醛(MDA)含量的測定采用硫代巴比妥酸法;超氧化物歧化酶(SOD)活性測定采用NBT法,以抑制NBT光化學還原的50%的酶量為1個酶活性單位;過氧化物酶(POD)活性測定采用愈創木酚法,以每1 min OD470變化0.1為1個酶活單位[3];過氧化氫酶(CAT)活性測定采用過氧化氫法,以每1 min OD值降0.043 6的酶量為1個酶活單位[4]。
2 結果與分析
2.1 不同溫度處理對甜瓜幼苗生長的影響
如表1所示,晝夜低溫及夜間低溫處理顯著抑制了甜瓜幼苗的生長,在這兩種溫度處理下的植株株高,葉片數,葉面積,根、莖、葉鮮質量均顯著低于對照,晝夜低溫處理和夜間低溫處理間差異不顯著,表明夜間低溫處理對甜瓜幼苗生長的抑制效果與晝夜低溫處理相似。玉金香和伊麗莎白2個品種在不同溫度處理下均表現出相似的響應特征,正常生長時,玉金香比伊麗莎白有更大的葉片干鮮質量和葉面積,但晝夜低溫及夜間低溫處理后,玉金香葉片干鮮質量和葉面積則比伊麗莎白較小,說明玉金香葉片生長受到的抑制較嚴重,可能比伊麗莎白對低溫更加敏感。
低溫處理結束再恢復生長7 d之后,與對照溫度相比,夜間低溫處理的幼苗根長和根干鮮質量無顯著性差異,晝夜低溫處理下伊麗莎白根長和根干鮮質量與對照無顯著性差異,玉金香根長與對照無顯著性差異;晝夜低溫及夜間低溫處理的幼苗株高、莖干鮮質量、葉鮮質量、葉片數和葉面積均顯著低于對照,說明恢復生長7 d之后,夜間低溫處理下2個甜瓜品種的幼苗根系以及晝夜低溫處理下伊麗莎白幼苗根系能夠較快恢復生長,并達到對照水平,但晝夜低溫處理下玉金香幼苗根系和2個甜瓜品種幼苗地上部還沒有恢復到對照水平,暗示晝夜低溫處理下玉金香幼苗根系受到的傷害程度比伊麗莎白大。恢復生長7 d后晝夜低溫及夜間低溫處理的玉金香比伊麗莎白有較大的葉片干鮮質量,較小的莖粗、根長、莖干鮮質量、根鮮質量、葉面積和較少的葉片數。

表1 不同溫度處理對甜瓜幼苗生長的影響
2.2 不同溫度處理對甜瓜幼苗根系中MDA含量的影響
MDA是細胞膜脂過氧化的產物,通常用于衡量膜脂過氧化的程度和對逆境條件反應的強弱[5]。李天來等[6]研究結果表明,夜間低溫處理的番茄幼苗根系MDA、H2O2含量顯著上升,O2-·產生速率也顯著高于對照。
經過雙因素方差分析(P<0.05)發現,處理7 d后,不同品種以及不同溫度處理間甜瓜幼苗根系中MDA含量差異顯著;恢復7 d之后,品種之間差異不顯著,不同溫度處理之間的差異顯著。
如圖1所示,與對照相比,低溫處理顯著提高2個甜瓜品種幼苗根系MDA含量,表明晝夜低溫與夜間低溫處理都對植物細胞膜產生了破壞。各溫度處理中伊麗莎白根系MDA含量都低于玉金香。恢復生長7 d后,低溫處理下2個甜瓜品種幼苗根系MDA含量均下降,表明2個甜瓜品種幼苗根系都逐漸恢復生長,低溫處理對根系的傷害減弱。夜間低溫處理2個品種幼苗根系的MDA含量與對照無顯著差異,而晝夜低溫處理過的幼苗根系MDA含量仍然高于對照,且玉金香品種晝夜溫度處理與對照間差異顯著,伊麗莎白品種則與對照差異不顯著。
2.3 不同溫度處理對甜瓜幼苗根系中SOD活性的影響
武雁軍等[7]認為一定低溫和一定處理時間下,葉片中SOD、POD、CAT活性呈現上升水平。林多等[8]研究發現,低溫處理初期(l~3 d),番茄幼苗葉片中的POD、SOD活性均上升,而后SOD活性下降,POD活性則隨低溫處理時間延長而持續增強。劉芳等[9]認為SOD的活性總體上隨溫度降低而降低。
經過雙因素方差分析(P<0.05)發現,處理7 d后與恢復生長7 d后,不同溫度處理和品種間甜瓜幼苗根系中SOD活性差異都不顯著。
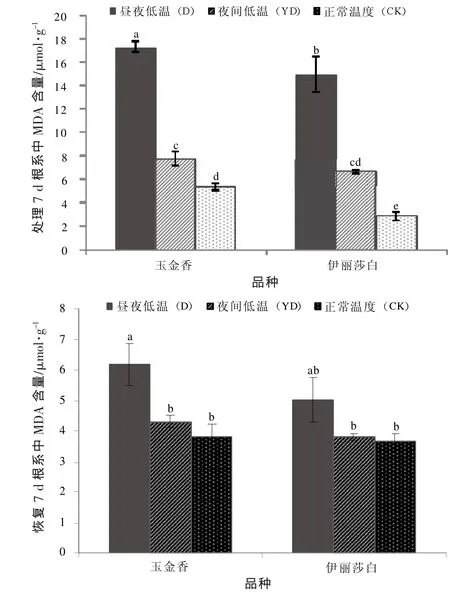
圖1不同溫度處理對甜瓜幼苗根系中MDA含量的影響

圖2 不同溫度處理對甜瓜幼苗根系中SOD活性的影響
如圖2所示,與對照溫度相比,晝夜低溫和夜間低溫使甜瓜幼苗和根系中SOD活性下降,但差異不顯著。SOD活性下降的原因在于隨著低溫脅迫時間延長,細胞膜保護能力逐漸減弱,使得自我保護調節能力逐漸降低,所以SOD活性在低溫脅迫時間較長時會呈現出下降趨勢。恢復處理7 d后,低溫處理過的幼苗根系中SOD活性與對照無顯著性差異。伊麗莎白與玉金香在不同溫度處理下表現的相似響應,但恢復7 d后,低溫處理的伊麗莎白幼苗根系SOD活性高于玉金香。

圖3 不同溫度處理對甜瓜幼苗根系中POD活性的影響

圖4 不同溫度處理對甜瓜幼苗根系中CAT活性的影響
2.4 不同溫度處理對甜瓜幼苗根系中POD活性的影響
經過雙因素方差分析(P<0.05)發現,處理7 d和恢復生長7 d后,不同溫度處理間甜瓜幼苗根系中POD活性差異顯著,品種間差異不顯著。
如圖3所示,與對照相比,低溫處理下甜瓜幼苗根系中POD活性均升高,且玉金香根系中POD活性顯著高于對照,同一甜瓜品種幼苗根系中晝夜低溫處理POD活性高于夜間低溫處理POD活性。恢復處理7 d后,各處理根系中POD活性均下降,晝夜低溫及夜間低溫處理的伊麗莎白根系中POD活性與對照差異不顯著,但晝夜低溫處理過的玉金香與對照差異顯著。
2.5 不同溫度處理對甜瓜幼苗根系中CAT活性的影響
沈征言等[10]研究發現,黃瓜苗夜晚在(6±0.5)℃條件下鍛煉12 h,連續6 d后,POD和CAT活性都有明顯提高。
雙因素方差分析(P<0.05)發現,處理7 d后,不同溫度處理間甜瓜幼苗根系中CAT活性差異顯著,品種間差異不顯著;恢復生長7 d后,不同溫度處理和不同品種間甜瓜幼苗根系中CAT活性差異都不顯著。
如圖4所示,處理7 d后,低溫處理的2個甜瓜品種幼苗根系中CAT活性比對照升高,且晝夜低溫時與對照有顯著性差異;恢復處理7 d后,低溫處理的2個甜瓜品種幼苗根系中CAT活性下降,且與對照無顯著性差異,表明2個甜瓜品種幼苗根系CAT活性恢復到對照水平。伊麗莎白與玉金香幼苗根系中CAT活性在不同溫度處理下表現的響應相似。
3 討論與結論
低溫脅迫通常會導致植物細胞中積累大量的活性氧和自由基,對細胞膜產生傷害,膜脂過氧化生成代謝產物MDA,它與蛋白質、核酸起反應修飾其特性,或抑制蛋白質的合成,它還可以與酶反應,使酶喪失活性,甚至成為一種催化錯誤代謝的分子[11],所以MDA含量的多少可以直接反映植物受傷害程度的高低,也可反映植物體內抗氧化系統的強弱。SOD、POD和CAT等抗氧化酶在清除由于環境脅迫產生的自由基方面起著重要作用。SOD是存在于植物細胞中最重要的抗氧化酶之一,其主要功能是清除O2-·,而POD、CAT具有分解H2O2的作用。3種保護酶協同作用可以清除體內一定數量的過剩O2-·,從而使膜系統減輕自由基引發的過氧化傷害,使植物的抗逆性提高[12]。本試驗中(圖1),晝夜低溫處理和夜間低溫處理7 d后,根系中MDA含量均顯著高于對照,晝夜低溫處理后根系MDA含量顯著高于夜間低溫處理,恢復生長7 d后根系的MDA含量亦是晝夜低溫處理最高,表明晝夜低溫處理對幼苗根系傷害的程度更深。恢復生長7 d后,晝夜低溫處理下的葉面積、根干質量、葉干質量均低于夜間低溫處理(表1),表明晝夜低溫處理后幼苗生長恢復速度慢于夜間低溫處理,進一步印證了晝夜低溫處理對甜瓜幼苗所帶來的低溫傷害程度比夜間低溫處理深,盡管晝夜低溫處理和夜間低溫處理對甜瓜幼苗生長抑制的效果相似。
本試驗的結果表明,晝夜低溫處理和夜間低溫處理7 d均顯著抑制了甜瓜幼苗的生長,2種低溫處理對甜瓜幼苗生長抑制的效果相似。在正常溫度下恢復生長7 d后,夜間低溫處理的甜瓜幼苗生長恢復速度快于晝夜低溫處理,這可能是由于晝夜低溫處理比夜間低溫處理對甜瓜幼苗傷害的程度更深,膜脂過氧化產物積累更多。此外本試驗發現,2個甜瓜品種在低溫處理下均表現出相似的響應特征,但玉金香可能比伊麗莎白對低溫更加敏感,低溫處理后玉金香生長恢復的程度要低于伊麗莎白。
由于夜間低溫處理也會嚴重抑制甜瓜幼苗的生長,因此在設施栽培中應尤其注意甜瓜幼苗的夜間防寒保溫工作,避免低溫對甜瓜幼苗的傷害。
[1]董玉梅,焦自高,王崇啟,等.低溫弱光脅迫對網紋甜瓜嫁接苗與自根苗某些物質含量的影響[J].山東農業大學學報:自然科學版,2005,36(1):67-69.
[2]李國強,齊明芳,李天來,等.夜間低溫后恢復期番茄幼苗光合作用和生長發育的變化[J].沈陽農業大學學報,2006,37(3):491-494.
[3]李合生.植物生理生化實驗原理與技術[M].北京:高等教育出版社,2000.
[4]鄒琦.植物生理學實驗指導[M].北京:中國農業出版社,2000.
[5]馬德華,盧育華,龐金安.低溫對黃瓜幼苗膜脂過氧化的影響[J].園藝學報,1998,25(l):6l-64.
[6]李天來,高曉倩,劉玉鳳.夜間低溫脅迫下鈣對番茄幼苗根系活力及活性氧代謝的調控作用[J].西北農業學報,2011,20(8):127-132.
[7]武雁軍,劉建輝.低溫脅迫對厚皮甜瓜幼苗抗寒性生理生化指標的影響[J].西北農林科技大學學報:自然科學版,2007,35(3):3-5.
[8]林多,楊延杰,范文麗,等.低溫對番茄幼苗葉片活性氧代謝的影響[J].遼寧農業科學,2001(5):l-4.
[9]劉芳,陳年來,李仲芳,等.低溫對白蘭瓜果實膜脂過氧化和滲透調節物質的影響[J].食品科學,2007,28(5):339.
[10]沈征言,簡令成.低溫鍛煉對黃瓜幼苗幾種酶活性的影響[J].植物學報,1991,33(8):627-632.
[11]王愛國,邵從本,羅廣華.丙二醛作為脂質過氧化指標的探討[J].植物生理學通訊,1986(2):55-57.
[12]Pandey S,Tiwari S B,Upadhyaya K C,et al.Calcium signaling:Linking environmental signals to cellular functions[J].Critical Reviews in Plant Sciences,2000,19:291-318.

