煤矸石-水泥二元膠凝材料水化動力學研究
李化建
中國鐵道科學研究院 鐵道建筑研究所,北京100081
中國是一個以煤炭為主要能源的發展中國家,在一次能源消耗中,煤炭占70%以上,所占比重高出世界平均水平的一倍以上,并且在今后相當長的一段時期內,中國的能源結構仍將以煤炭為主[1]。人類在享受著煤炭作為能源所帶來工業革新的同時,也遭受著煤矸石自燃、堆放等所帶來的空氣污染、水體污染以及占用耕地等問題。煤矸石是煤炭生產和加工過程中產生的固體廢棄物,每年的排放量相當于當年煤炭產量的10%左右,目前已累計堆存30多億噸,占地約1.2萬公頃,是目前我國排放量最大的工業固體廢棄物之一。煤矸石的綜合利用已經引起了國內外學者和政府的關注,國內外學者針對煤矸石在建材領域的應用開展了大量研究[2-4],但由于煤矸石化學組成的多樣性、礦物成分的復雜性以及堆放時間的不確定性給煤矸石的基礎研究和高附加值利用帶來了很大的技術瓶頸。基于煤矸石和膠凝材料在“化學組成”上都富含硅、鋁,在“量”上都具有大宗性,提出用煤矸石建材資源化來實現煤矸石的減量化、資源化和無害化,從而促進水泥工業的生態化[5,6]。膠凝材料發揮膠凝作用的原因是其水化作用,煤矸石及其激發劑的引入勢必會引起水泥水化過程的變化。胡曙光等從強度、反應程度、孔溶液堿度和強度等方面研究了煤矸石作為水泥輔助膠凝材料的水化情況,結果表面煤矸石發生火山灰反應時間比粉煤灰早,且發生火山灰反應所需的堿度值比粉煤灰低[7]。劉賢萍等比較研究了活化煤矸石與粉煤灰的活性,與粉煤灰相比,活化煤矸石較大的比表面積及其所含有的多孔或致密的惰性物質,使其對水泥熟料水化的早期稀釋效應有所削弱,也使其后期火山灰反應對水泥熟料和活化煤矸石混合材整體水化程度的提高幅度有所下降,并且活化煤矸石硅酸鹽水泥水化1a后其硬化漿體的毛細孔含量高于粉煤灰硅酸鹽水泥[8]。Liu Xianping的研究表明煤矸石的火山灰反應發生在7d到90d,表現為生成氫氧化鈣和結晶度較差的C—S—H凝膠[9]。熊少波等通過測定Ca(OH)2含量來探討煤矸石—Ca(OH)2—H2O體系反應動力學,研究表明,不同齡期的Ca(OH)2的消耗量可以很好地表征煤矸石的火山灰活性和火山灰反應程度。煤矸石—Ca(OH)2—H2O體系反應動力學模型與煤矸石的活性具有很好的相關性,可以表征煤矸石與Ca(OH)2反應的活性[10]。但目前還缺少針對煤矸石-水泥膠凝材料,尤其是在復合激發劑作用下的水化動力學研究。為揭示煤矸石-水泥膠凝材料水化作用機理,本文研究不同復合鹽作用下煤矸石-水泥二元膠凝的水化動力學。
1 試 驗
1.1 試驗原料及試樣配合比
煤矸石是800℃煅燒徐州煤矸石,化學組成如表1所示;熟料為北京興港熟料,熟料的化學組分及礦物成分如表2和表3;氯化鈣、硫酸鉀以及碳酸鈣為化學工業產品。試樣的編號及配合比如表4。

表1 原料的化學組成(wt%)
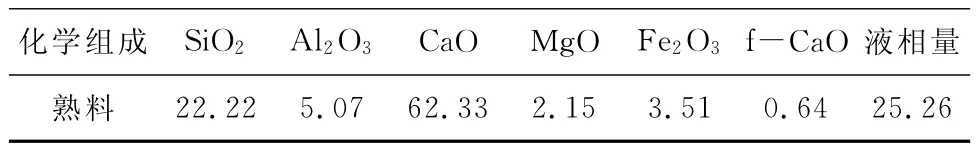
表2 熟料的化學組成(wt%)
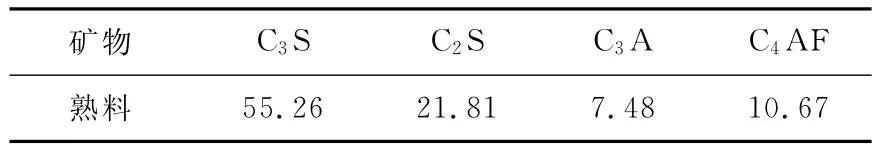
表3 熟料的礦物成分 (wt%)

表4 試樣配合比
1.2 試驗方法
采用等溫微量熱儀(TAM Air 08Isothermal Calorimeter,RETRAC,Sweden)測量原料水化放熱速率和水化放熱量。測定水化熱的條件:水膠比為0.5,水化溫度為20℃,一分鐘記錄一次數據,測試時間為48h。
2 結果與討論
2.1 煤矸石質硅鋁基膠凝材料水化熱
圖1是為煤矸石-水泥膠凝材料的水化熱曲線,其中圖1(a)為水化放熱率曲線,圖1(b)為水化放熱量曲線。
由圖1(a)可知,在水化開始幾分鐘出現的峰為水化初始期的放熱峰,這個放熱峰三個試樣都有。在沒有復合鹽作用的F0試樣中,誘導期很長,從水化0.53h開始到10.8h,水化加速期從10.8h開始到18.3h結束,并且水化放熱速率很低。在氯化鈣和硫酸鉀復合鹽的作用下(F1試樣),誘導期明顯縮短,水化1.9h就進入加速期,水化5.57h,加速期結束進入減速期。在碳酸鈣和硫酸鉀復合鹽的作用下(F2試樣),在誘導期前出現兩個放熱峰,這與Na2CO3激發礦渣水泥的水化放熱曲線相似[11]。水化0.95h出現一個小的放熱峰,這個小峰被稱為附加水化初始放熱峰。由于初始期的存在,導致水化過程誘導期縮短,水化2.93h進入水化加速期,9.52h進入減速期。
由圖1(b)可知,水化48h累積放熱量F2試樣為170.94J/g,F1試樣為151.27J/g,而 F0試樣放熱量最低,僅為91.92J/g。F0試樣水化誘導期長,水化放熱速率低,相對應的放熱量就小。復合鹽可以激發煤矸石-水泥膠凝材料的水化,大幅度提高其水化放熱量。

圖1 F0,F1,F2試樣和水泥的水化熱曲線(a)水化放熱速率 (b)水化放熱量
2.3 復合鹽作用下煤矸石質硅鋁基膠凝材料水化動力學
Knudson和Kondon[12]分別提出了水化動力學方程如式(1)和(2)。綜合兩個方程并作適當的變形可以計算出最大放熱量,水化程度,水化反應速率常數以及與水化機理有關的常數。由于煤矸石質硅鋁基膠凝材料的水化是一個復雜的、非均質的多相化學反應,因此,每一個水化階段將同時發生多個水化反應,但每個階段又將由反應最慢的水化反應來控制。
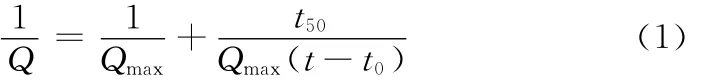
式中,Q 為水化放熱量,J/g;
Qmax為無窮大時間后的水化放熱總量,J/g;
t50為水化程度達50%時所需的反應時間(半衰期),h;
t-t0為從加速期開始時計算的水化時間;t0為加速期
開始的水化時間,h。

式中,α為水化程度;
K為水化反應速度常數;
N是與水機理有關的常數。當N<1,水化反應受成核
反應控制;當N=1時,水化反應由邊界反應控制水泥;
當N>1時,水化反應由擴散過程控制。
以F2試樣為例,說明水化動力學的計算過程。由于式(1)只適合衰減期,所以將F2水化熱曲線從加速期開始劃分,劃分成加速期AC,減速期CD和衰減期DE。由于在水化6.53h出現拐點,所以將加速期分為前減速期AB和后加速期BC,如圖2(a)所示。按公式1,用1/Q 與1/(t-t0),(Q為從t0到t時間內水化放熱總量),作圖得一直線,由截矩和斜率求出Qmax和t50,F2試樣Qmax為182.5J/g。由不同時刻放熱量和最大放熱量的比值求得水化程度α。將式2改寫成3,用ln[1-(1-α)1/3]與ln(t-t0)作圖可得一直線,如圖2(b),由斜率和截矩分別求N和K。從圖2(b)可知減速期CD段是曲線,不能滿足直線關系,按照文獻所提供的方法[13],將1-(1-α)1/3和ln(t-t0)作圖,得出近直線關系,對直線進行線性擬合,由斜率計算出K值。用類似的方法分別計算F0和F1試樣,所計算水化動力學常數見表5。
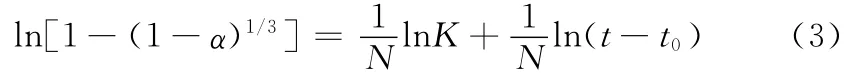
由水化動力學研究,可以得出以下結論:
1)從圖2(b)可知,在加速期(AC段)并不是一條直線,而是一條折線(AB和BC),原因是煤矸石-水泥膠凝材料中既含有低聚度的物料(硅酸鹽結構為島狀)又含有中聚度的物料(硅酸鹽結構為鏈狀或層狀),AB段為低聚度物料的加速期,BC段為中聚度物料的加速期。這與水化熱曲線一致,F2試樣在水化6.53h出現一個拐點,如圖(a)中B點,這個拐點和加速期的轉折點基本重合;

圖2 水化熱動力學計算曲線

表5 復合鹽作用下煤矸石-水泥膠凝材料水化動力學參數
2)在水化反應的加速期,N<1,水化反應受成核反應控制;衰減期,當N>1時,水化反應由擴散過程控制。在減速期,ln[1-(1-α)1/3]和ln(t-t0)不成直線關系,而1-(1-α)1/3和ln(t-t0)成直線關系,這個公式是從dh/dt=1/h×k(h為水化深度)推導出來的,該公式適合化學反應和擴散過程雙重控制的,因此,減速期是受雙重控制的階段,是成核反應階段向擴散控制的過渡階段。
(3)加速期的K值遠高于衰減期的K值,表明成核化學反應的速度大大超過了擴散速度。
2.3 復合鹽作用下煤矸石質硅鋁基膠凝材料水化熱力學探討
從熱力學探討不加復鹽和加不同復鹽水化熱曲線的變化原因。以煤矸石-水泥膠凝材料中可能形成的鋁酸鹽水化產物為例進行計算。在硫酸鹽和碳酸鹽存在的情況,反應Gibbs自由能的變化。

在硫酸鹽的作用下:

在碳酸鹽的作用下:

從3個反應式Gibbis自由能可以得出,在沒有復合鹽存在的條件下,F0試樣水化反應自發進行的趨勢小,所對應水化反應速率小,水化速度慢,放熱量小。復鹽的作用下水化反應自發進行的趨勢增大,水化反應容易進行,水化反應速率大。由于缺少氯型鈣礬石的熱力學數據,無法計算在氯化鹽的作用下反應的Gibbs自由能。在堿性環境中,CaCl2的存在能生成亞穩的氧氯化鈣使得Ca(OH)2溶解較快,促進水化的進行,加速鈣礬石的形成。另外,Cl-1具有較大的擴散速度,具有很強穿透能力,能夠穿透顆粒表面的水化產物層使反應向顆粒內部進行[14]。因此,對于CaCl2和K2SO4的復合,有利于水化反應的進行。在氯鹽的作用下,容易形成氯型鈣礬石,使體系水化速率加快,誘導期縮短,不會出現附加初期放熱峰。
3 結 論
煤矸石-水泥膠凝材料與純水泥的水化過程基本一致,表現為水化放熱曲線相似,加速期水化反應由成核反應控制,衰減期水化反應由擴散控制,減速期則由成核反應和擴散 反 應 的 雙 重 控 制;復 合 鹽 (CaCl2—K2SO4,CaCO3—K2SO4)能夠加速煤矸石-水泥膠凝材料的水化進程,縮短煤矸石-水泥膠凝材料水化誘導期,提高煤矸石-水泥的水化放熱量,體現在水化動力學方程中水化放熱速率常數不同;與CaCO3—K2SO4相比,CaCl2—K2SO4能夠充分激發煤矸石的膠凝活性,表現為加速期水化速率常數增加,水化放熱量大。
[1]崔民選.2006中國能源發展報告[M].北京:中國計量出版社,2006:85-86.
[2]GUO WEI,ZHU JIAN-PING,LI DONG-XU.Early hydration of composite cement with thermal activated coal gangue[J].Journal of Wuhan University of Technology-Mater.Sci.Ed.2010(1):162-166.
[3]ZHANG JI-XIU,SUN HENG-HU,SUN YIN-MING,et al.Corrosion behavior of steel rebar in coal gangue-based mortars[J].Journal of Zhejiang University Science-A,2010,11(5):382-388.
[4]ZHANG NA,LIU XIAO-MING,SUN HENG-HU,et al.Pozzolanic behaviour of compound-activated red mud-coal gangue mixture[J].Cement and Concrete Research,2011,41(3):270-278.
[5]LI CHAO,SUN HENG-HU,LI LONG-TU.Investigation on the activation of coal gangue by a new compound method[J].Journal of Hazardous Materials,2010,179(1):515-520.
[6]LI HUA-JIAN,SUN HENG-HU,XIAO XUE-JUN,et al.Microstructure and cementitious properties of calcinedcontaining gangue[J].International Journal of Minerals Metallurgy and Materials.2009,16(8):183-189.
[7]胡曙光,王曉,呂林女.煤矸石對硅酸鹽水泥水化歷程的影響[J].水泥,2005,(8):5-7.
[8]劉賢萍,王培銘.活化煤矸石/粉煤灰水泥水化過程及性能差異[J].建筑材料學報,2010,13(3):371-375.
[9]LIU XIAN-PING,WANG PEI-MING.The hydration process in Portland cement blended with activated coal gangue[J].J Zhejiang Univ-Sci A,2011(on line).
[10]熊少波,王培銘,顧炳偉.煤矸石-Ca(OH)2-H2O體系反應動力學初探[J].硅酸鹽通報,2006,(2):94-97.
[11]SHI CAI-JUN,DAY R L.A calorimetric study of early hydration of alkali-slag cements [J]. Cement Concrete Research,1995,25:1333-1346.
[12]ZHOU H H,WU X Q,XU Z Z,et al.Kinetic study on hydration of slag-activated slag[J].Cement Concrete Research,1993,23:1253-1258.
[13]Wu X Q,Roy D M,Langton C A.Hydratin of cement at early stage[J].Cement Concrete Research,1983,25:277-286.
[14]陸平.水泥材料科學導論[M].上海:同濟大學出版社,1991.130-132.

