回腸間置術對Ⅱ型糖尿病大鼠血糖影響的實驗研究
鄭 偉,武 波,白軍偉,尹 敏,王新杰,賀永剛,尹家俊
(大連大學附屬中山醫院,遼寧大連 116001)
胃旁路術(Roux-en-Y gastric bypass,GBP)和膽胰轉流術(biliopancreatic diversion,BPD)等胃腸道重建類減肥手術,在減輕患者體重的同時,對伴2型糖尿病的患者還具有明顯改善其糖耐量及胰島素抵抗的作用[1]。其他減肥手術未見明顯的降糖效果,這兩種手術最大的共同點是胃腸道重建,通過曠置十二指腸和近端空腸和(或)過早的刺激末段回腸,從而實現降血糖的作用,即“前腸假說”和“后腸假說”[2],但究竟是哪種機制起著更為關鍵的作用,目前尚不完全清楚,本研究利用一種新的手術方式-回腸間置術(Ilesl transposition IT)[3],將一定長度的末端回腸前移至上段空腸,以實現食物過早刺激末段回腸,從而觀察“后腸假說”對鏈脲佐菌素(STZ)誘導的非肥胖2型糖尿病大鼠的降糖效果,并初步探討其機制。
1 材料與方法
1.1 實驗動物和材料清潔級6周齡雄性SD大鼠35只,體重160-180 g/只,大連醫科大學動物實驗中心提供,飼養于大連大學附屬中山醫院中心實驗室。STZ(美國sigma公司)、拜安捷血糖儀(美國拜耳公司)、大鼠胰高血糖素肽-1(GLP-1)酶聯免疫分析ELISA試劑盒(瑞典Mercodia公司)。
1.2 Ⅱ型糖尿病大鼠模型的制備[4]取35只6周齡SD大鼠高糖高脂飼料喂養4周后,大鼠禁食12小時,按40 mg/kg體重腹腔注射1%的STZ溶液(PH4.2 0.1mol/l的檸檬酸鈉-檸檬酸緩沖液),48小時后用快速血糖儀測大鼠尾靜脈血糖≥16.7 mmol/l,穩定5天為造模成功,共有30只大鼠成模。
1.3 動物分組將30只成模SD大鼠隨機分為手術組(IT組)、假手術組(S-IT組)、對照組(C組),每組10只,術前各組大鼠體重、空腹血糖、GLP-1差異無統計學意義。
1.4 手術方式IT組行回腸間置術:大鼠禁食不禁水12 h,1%戊巴比妥鈉(50 mg/kg)腹腔內注射麻醉,上腹正中長約3 cm切開進腹,分離盲腸,距離回盲瓣5 cm和15 cm處分別橫斷回腸,取出一段長10 cm的末段回腸,保留其完整的神經及血管,將其保存于生理鹽水中,間斷縫合兩斷端;在距離十二指腸懸韌帶下5 cm處橫斷空腸,并將這段曠置的末段回腸按其腸管蠕動的方向分別行空腸-回腸、回腸-空腸端端吻合,均采用0/7號無創絲線間斷縫合,縫合系膜裂孔。S-IT組,用上述同樣的方法進行麻醉,采取與IT組相同部位切斷腸管,并做原位吻合,保證相同麻醉時間,術終均用慶大霉素(96萬U)2 ml沖洗腹腔后關腹,術后12小時后自由進水,24小時后自由進食,保證充足飲水。
1.5 實驗方法分別于術前、術后第1、2、4、8周5個時間點,測空腹與灌服葡萄糖30 min后的血糖、胰島素和GLP-1,術后2周每兩天,2周后每周測1次體重。大鼠禁食過夜,眶靜脈取血1 ml,灌服20%葡萄糖(1 g/kg體重)30 min后再取血1 ml,靜置30 min后4 000 r/m 離心10 min,分離血清,-70℃凍存;血糖由快速血糖儀測定,GLP-1應用大鼠酶聯免疫分析ELISA試劑盒測定。
1.6 統計學方法實驗數據以均數±標準差(ˉx±s)表示,各組間檢測值比較采用t檢驗和方差分析,P<0.05為差異有統計學意義。采用SPSS 13.0 for windows統計學軟件進行統計分析。
2 結果
各組大鼠術前體重、血糖和GLP-1差異均無統計學意義(表1)。

表1 術前各組大鼠體重、血糖及GLP-1
2.1 體重變化術后第1周與C組相比,IT組、S-IT組體重均有明顯下降(P<0.01),術后第2周期體重開始回升(P<0.05),術后第4周至實驗結束各組大鼠體重均無統計學意義(表2)。

表2 各組大鼠體重變化
2.2 血糖與術前相比,IT組大鼠術后第1周空腹及餐后血糖已開始下降,第2周空腹及餐后血糖由(18.96±1.13)、(31.82±2.33)mmol/L分別下降至(14.45±17.6)、(26.52±1.20)mmol/L,差異具有統計學意義(P<0.05),術后第8周空腹及餐后血糖分別下降至(6.73±1.78)、(12.46±2.54)mmol/L,差異性具有顯著的統計學意義(P<0.01),術后第4、8周 IT組血糖明顯低于同一時間點S-IT組和C組各大鼠血糖值,差異具有顯著統計學意義(P<0.01),整個實驗過程中S-IT組和C組大鼠血糖值無明顯差異(表3)。
表3 各組大鼠血糖值及變化(mmol/L,±s)
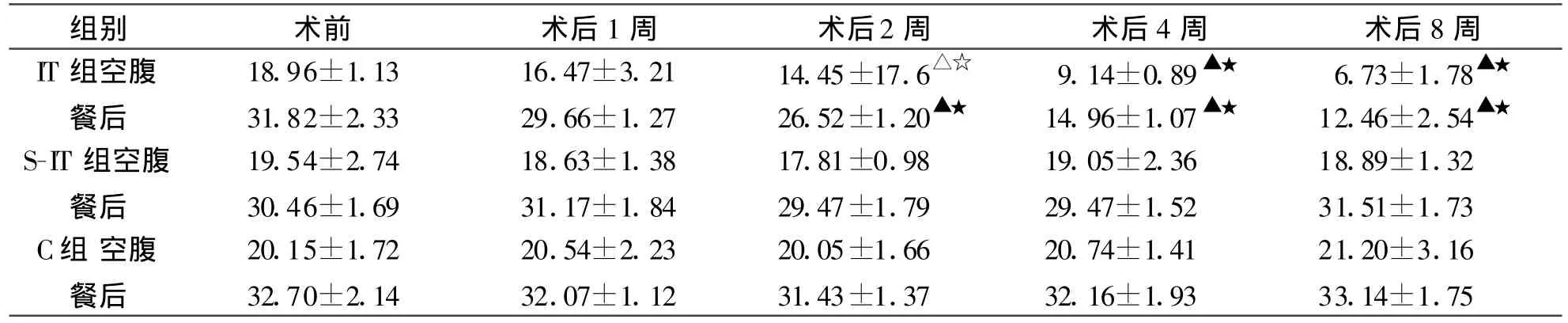
表3 各組大鼠血糖值及變化(mmol/L,±s)
注:同一時間點組間比較,△P<0.05,▲P<0.01,與術前比較,☆P<0.05,★P<0.01。
組別 術前 術后1周 術后2周 術后4周 術后8周IT組空腹 18.96±1.13 16.47±3.21 14.45±17.6△☆ 9.14±0.89▲★ 6.73±1.78▲★餐后 31.82±2.33 29.66±1.27 26.52±1.20▲★ 14.96±1.07▲★ 12.46±2.54▲★S-IT組空腹 19.54±2.74 18.63±1.38 17.81±0.98 19.05±2.36 18.89±1.32餐后 30.46±1.69 31.17±1.84 29.47±1.79 29.47±1.52 31.51±1.73 C組 空腹 20.15±1.72 20.54±2.23 20.05±1.66 20.74±1.41 21.20±3.16餐后 32.70±2.14 32.07±1.12 31.43±1.37 32.16±1.93 33.14±1.75
2.3 GLP-1IT組大鼠空腹GLP-1術后第1周開始上升,灌胃后30分鐘升高更為明顯,由術前的(21.50±1.68)pmol/L上升到(42.72±2.06)pmol/L差異有統計學意義(P<0.01),至術后第8周空腹及餐后GLP-1值分別上升到(24.23±1.75)、(89.74±2.96)pmol/L,差異有顯著的統計學意義(P<0.01),術后第2周至實驗結束,IT組GLP-1值均明顯高于相同時間點S-IT組和C組,差異均有顯著統計學意義(P<0.01,表4)。
表4 各組大鼠GLP-1值及比較(pmol/L±s)
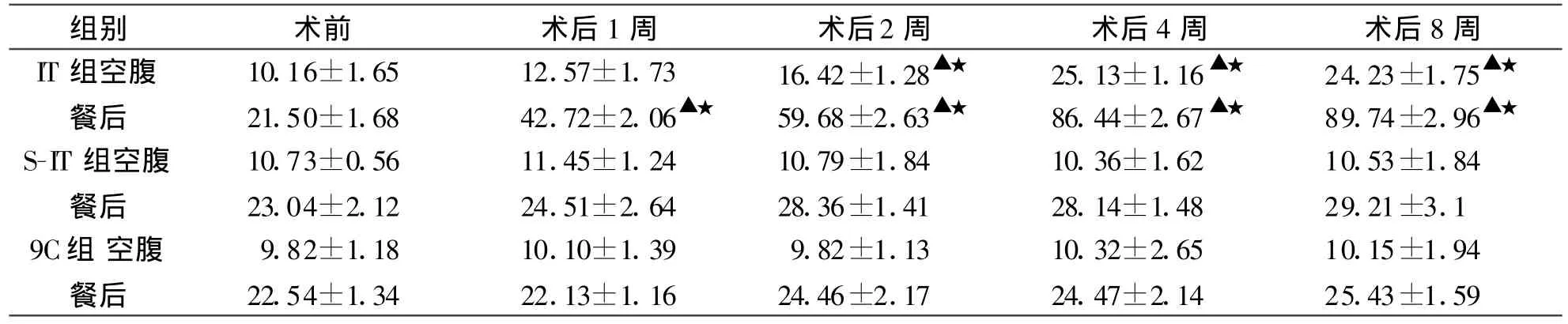
表4 各組大鼠GLP-1值及比較(pmol/L±s)
注:同一時間點組間比較,△P<0.05,▲P<0.01,與術前比較,☆P<0.05,★P<0.01。
組別 術前 術后1周 術后2周 術后4周 術后8周IT組空腹 10.16±1.65 12.57±1.73 16.42±1.28▲★ 25.13±1.16▲★ 24.23±1.75▲★餐后 21.50±1.68 42.72±2.06▲★ 59.68±2.63▲★ 86.44±2.67▲★ 89.74±2.96▲★S-IT組空腹 10.73±0.56 11.45±1.24 10.79±1.84 10.36±1.62 10.53±1.84餐后 23.04±2.12 24.51±2.64 28.36±1.41 28.14±1.48 29.21±3.1 9C組 空腹 9.82±1.18 10.10±1.39 9.82±1.13 10.32±2.65 10.15±1.94餐后 22.54±1.34 22.13±1.16 24.46±2.17 24.47±2.14 25.43±1.59
3 討論
1995年Pories[5]等對減肥手術的回顧性調查中意外的發現,手術在減輕患者體重的同時對伴有2型糖尿病患者的血糖也有顯著的改善作用,從而開啟了手術治療糖尿病的大門。并提出這可能跟手術改變胃腸道結構有關,通過避免食物對十二指腸和近段空腸的過度刺激,及食糜過早的刺激末段回腸,引起腸道激素分泌的改變,從而改善糖尿病患者的糖耐量及胰島素抵抗,但其機制目前尚不清楚。
經過近十年的臨床觀察和實驗性研究發現,最有效的治療肥胖癥和2型糖尿病的手術方式GBP和BPD術后血糖改善的同時,血清GLP-1也有顯著的升高。GLP-1(胰高血糖素樣肽-1)由末段回腸黏膜上皮L細胞分泌,能促進糖原合成及脂肪分解,抑制胃排空,抑制胰高血糖素分泌,增加胰島素的基因表達和胰島素前提的合成,促進β細胞增殖與抑制其凋亡[6]。另外,GLP-1還有降低食欲的作用,人體注射GLP-1可引起攝食減少[7]。目前認為GLP-1是腸-胰島軸中控制2型糖尿病最核心的介導因子[8]。術后GLP-1水平升高可能是未完全消化的食糜直接到達末段回腸刺激腸壁L細胞分泌所致,這種變化有助于降低糖尿病患者的血糖,改善胰島B細胞功能[9]。
本實驗利用一種“純”回腸刺激模型-回腸間置術(IT)[10],僅實驗食物對末段回腸過早的刺激,而未減少胃容積和十二指腸的曠置,從而觀察術后體重、血糖、GLP-1的變化。術后IT組大鼠血糖顯著降低的同時,體重也有略微的降低,但與S-IT組大鼠相比體重變化無顯著差異性,術后第4周起直至實驗結束各組大鼠體重均無明顯差異,顯示IT控制糖尿病血糖的作用與體重變化無關。術后IT組大鼠血糖降低的同時,血清GLP-1值也出現顯著的升高,餐后GLP-1升高的更為明顯,表明末段回腸及其黏膜上皮L細胞對于手術治療糖尿病起著至關重要的作用,并進一步驗證了“后腸假說”的可靠性。
[1]Buchwald H,Avidor Y,Braunwald E,et al.Bariatric surgery:a systematic review and meta-analysis[J].Jama,2004,292:1724.
[2]Mason E E.Ileal[correction of ilial]transposition and enteroglucagon/GLP-1 in obesity(and diabetic?)surgery[J].Obes Surg,1999,9(3):223.
[3]Koopmans HS,Ferri GL,Sarson DL,et al.The effects of ileal transposition and jejunoileal bypass on food intake and GI hormone levels in rats[J].Physiol Behav,1984,33:601.
[4]Mu SN,Gao Yun,Wang FS,et al.Rat model of type 2 diabetes induced by streptozotocin and high-carbonhydrate fat-Diet[J].Chin J Comp Med,2008,18(2):19.
[5]Pories WJ,Swanson MS,MacDonaldKG,et al.Who would have thought it?Anoperation proves to be the most effective therapy foradult-onset diabetes mellitus[J].Ann Surg,1995,222:339.
[6]Patriti A,Aisa MC,Annetti C,et al.How the hindgut can cure type 2 diabetes.Ileal transposition improves glucose metabolism and beta-cell function in Goto-kakizaki rats through an enhanced Proglucagon gene expression and L-cell number[J].Surgery,2007,142(1):74.
[7]Simon A.Gastrointestinal surgery and gut hormones[J].Current Opinion in Endocrinology&Diabetes,2005,12:89.
[8]Cummings DE,Overduin J,Foser-Schubert KE.Gastric bypass forobestity:Meganisms of weight loss and diabetes resolution[J].J ClinEndocri&Metab,2004,89(6):2608.
[9]John B,Dixon,Walter J,et al.Surgery as an Effective Early Intervention for Diabesity[J].Diabetes care,2005,28(2):472.
[10]Strader AD.Ileal transposition provides insight into the effectiveness of gastric bypass surgery[J].Physiol Behav,2006,88:277.

