變形鏈球菌誘導牙髓細胞MMP-8 mRNA的表達及意義
孫淑芬,張影杰,姜新朋,張穎麗
(1.吉林大學口腔醫院牙體牙髓病科,吉林長春 130021;2.吉林大學中日聯誼醫院手術室)
牙髓組織是一種特殊的疏松結締組織,當受到刺激時,會產生防御性炎癥反應。近年來的研究顯示基質金屬蛋白酶(matrixmetalloproteinases,MMPs)在牙髓病理過程中發揮著重要的作用,也受到學者們重視[1,5,15]。MMP-8導致細胞外基質(extracellular matrix,ECM))降解,對牙髓組織的損傷存在著復雜的調節機制,但目前對MMP-8在牙髓病中的作用機制尚不清楚,進一步研究,有助于了解牙髓損傷與修復的機制,為臨床治療提供新思路。
1 材料與方法
1.1 主要儀器設備
三級生物安全防護細胞培養實驗室(PⅢ),二氧化碳恒溫培養箱(Thermo,USA),生物安全柜(Heal force,上海力申),倒置相差顯微鏡(Olympus,Japan),酶聯檢測儀(DO32022,華東),96孔細胞培養板(Costor,USA)),濾器(PALL,USA)。Gene Amp PCR System9600擴增儀(PERKIN-ELMER,USA)。
1.2 主要試劑
高糖DMEM培養基(Gibco,USA),胎牛血清FBS(PAA,奧地利),胰蛋白酶(Gibco,USA),EDTA(Gibco,USA),二甲基亞砜DMSO(Sigma,USA),MTT(Sigma,USA),Tris(Sigma,USA),其它為國產分析純。
1.3 人牙髓細胞的體外培養
取因正畸或阻生拔除的健康牙齒(均無齲壞、根尖周炎及牙周炎),75%酒精消毒牙體,立即無菌條件下完整取出牙髓組織,棄根髓1/3,剪碎組織至0.5 mm3塊,以含20%FBS的 DMEM 培養液,37℃、5%CO2、飽和濕度條件的培養箱中孵育。用0.25%的胰蛋白酶、0.02%EDTA的混合消化液進行傳代,取4-7代細胞用于實驗。
1.4 純化變形鏈球菌菌株培養及其上清液提取
將變形鏈球菌JH1140劃線接種于M-S輕唾平板培養基上,立即放入清潔厭氧罐中,取產氣袋置于厭氧罐中按說明操作使厭氧罐內達到厭氧環境,37℃恒溫培養48 h,用接種環將細菌接種于液體M-S輕唾培養基中,培養方法同上,37℃恒溫培養24到48 h。觀察試管中細菌生長情況,約48 h后肉眼可見試管壁有淺黃色菌落附著,輕微搖晃菌落不脫落為佳。
在生長良好的變形鏈球菌試管中取2 ml培養液,加入2.5 ml離心管中,12 000 rpm,4℃離心10 min,吸取上清液1.5 ml,0.22 μ m濾器抽濾滅菌4℃保存。
1.5 變形鏈球菌刺激牙髓細胞
取過濾獲得的變鏈上清液按1∶50比例稀釋后,加入到10%FBS的DMEM培養液中,配置成變形鏈球菌刺激組細胞培養液。取生長良好的牙髓細胞(細胞爬滿培養瓶底壁80%以上)20瓶,加入刺激組細胞培養液,每4 d換液一次,連續培養8 d后用于實驗;正常牙髓細胞作為對照。
1.6 PCR檢測變形鏈球菌對牙髓細胞MMP-8 mRNA

表1 引物設計表
采用Oligo 6.0設計引物序列,由賽百盛公司合成。反應條件:預變性94℃,2 min;以下經過35個循環過程:變性 94℃,30 s,退火56℃,30 s,延伸72℃,60 s;再延伸 72℃,10 min,4℃保溫。取 5 μ l PCR產物加1 μ l 6×loading Buffer,移液器抽打混勻,在1%瓊脂糖凝膠上電泳120 V,25 min,凝膠成像系統照相觀察。
2 結果
2.1 RNA提取結果
牙髓細胞總RNA提取效果較好,呈清晰的28 S,18 S和5 S三條帶,其中28 S的亮度約為18 S的2倍,RNA無明顯降解、無明顯的DNA污染。
2.2 PCR產物
在退火溫度56℃時,正常組牙髓細胞mRNA逆轉錄PCR,產物電泳無明顯條帶,MMP-8 mRNA未見表達;變形鏈球菌刺激組牙髓細胞mRNA逆轉錄PCR后,產物電泳顯示在Marker標記540 bp附近處有一清晰條帶,與預期片段大小一致。符合MMP-8引物設計片段大小,MMP-8 mRNA表達量增強。
3 討論
3.1 細菌對牙髓細胞合成MMPs的影響
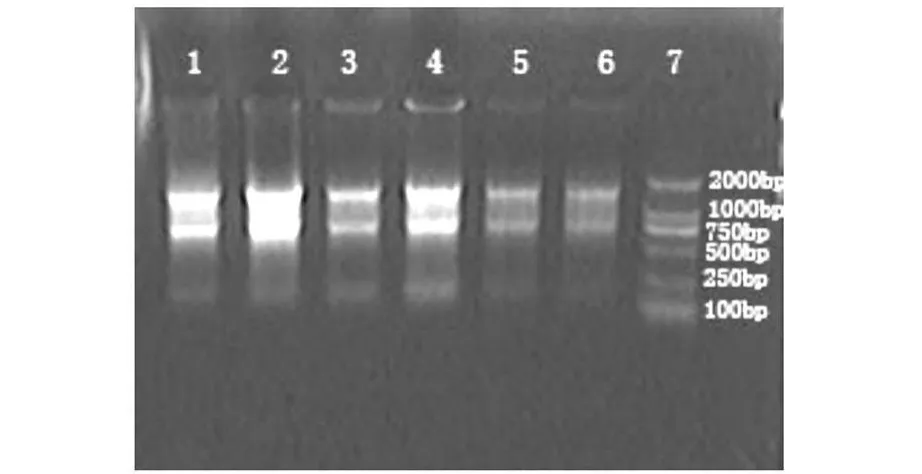
圖1 牙髓細胞總RNA提取結果
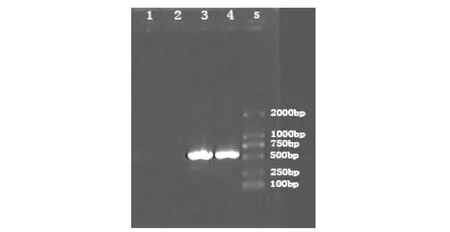
圖2 牙髓細胞mRNA MMP-8 RT-PCR結果
牙髓炎多由口腔混合細菌的混合毒力所致,厭氧菌是感染牙髓的優勢菌,細菌成分的增多,可刺激多種炎癥細胞產生細胞因子,進而促進牙髓細胞合成MMPs增加。Chang等在研究產黑色素類桿菌對人牙髓細胞合成MMPs的影響時,將牙齦卟啉單胞菌和牙髓卟啉單胞菌培養后經離心提取其上清液加入到人牙髓細胞培養液中,混合培養8天后,凝膠酶譜分析發現,牙髓細胞合成的MMP-2明顯增多[2]。Nakata等研究中間普氏菌,具核梭桿菌,牙髓卟啉單胞菌和牙髓卟啉單胞菌培對體外人牙髓細胞合成MMPs的影響時發現細菌超聲提取物可以促進牙髓細胞合成MMP-1、MMP-2增多[3]。Tjaderhane等研究認為細菌產酸可以激活MMPs[4]。由此可見,厭氧菌的侵入提高了牙髓細胞對ECM的降解活性,細菌導致牙髓病變可能開始于MMPs的作用。但由于早期牙髓炎細菌主要經齲壞后變薄的牙本質層中的牙本質小管侵入牙髓腔,而侵入牙本質小管中的主要菌種為致齲菌—變形鏈球菌,有研究顯示早期牙髓炎中檢測出的主要菌為變形鏈球菌[5,6]。因此本實驗借鑒上述學者方法,采用變形鏈球菌上清液與DMEM混合培養液培養牙髓細胞,以細菌代謝產物快速誘導體外培養人牙髓細胞,實驗性模擬牙髓細胞損傷狀態的方法,結果顯示細菌代謝產物刺激牙髓細胞8d,細胞形態未見明顯改變,開始出現散在脫壁現象。證實細菌成分在牙髓病發生發展中起一定作用,致病菌的定居除了通過釋放蛋白酶直接降解ECM外,還可以通過其他不同的途徑導致組織損傷,如MMPs途徑、纖溶酶原依賴性途徑、吞噬細胞途徑、PMN-絲氨酸蛋白酶途徑、破骨細胞吸收途徑。其中MMPs途徑是牙髓組織ECM降解的主要途徑。
3.2 牙髓細胞中MMP-8 mRNA的表達及意義
牙髓炎中MMPs的異常增多將導致細胞外的基質合成與代謝失衡,使得病變發展,成惡性循環,最終導致牙髓壞死及根尖周病變。在牙髓組織中,牙髓細胞、成牙本質細胞是MMPs的主要合成細胞,其中牙髓細胞可產生大部分MMPs,到目前為止所發現的 MMPs 有:MMP-2、MMP-3、MMP-8、MMP-9、MT1-MMP和MMP-20[8]。蛋白溶解酶的存在是細胞外基質降解的必備條件,這些酶根據靶分子的不同可分為三類:絲氨酸蛋白酶,半胱氨酸蛋白酶以及MMPs[9]。Creemers等研究酶在牙髓組織ECM降解中作用時發現,膠原的降解主要依賴于MMPs,其次為半胱氨酸蛋白酶[10]。生理條件下,MMPs的水平較低,其與TIMPs的平衡維持著牙髓組織的健康。彈性蛋白酶、膠原酶活性的增強是化膿性牙髓炎以及牙髓壞死的組織化學特點[11]。牙髓炎中MMPs異常增多將導致細胞外的基質合成與代謝平衡的打破[12、13、14],使得病變發展,呈惡性循環。ECM 是正常細胞維持生存運動和分化的適宜環境,它可影響細胞的形態、控制細胞的遷移、調控細胞的增殖和誘導細胞的分化[7,15]。ECM的及時降解對于胚胎發育、形態發生組織的吸收和改建是必不可少的。正常ECM的降解將導致組織失去供給而壞死。MMPs及金屬蛋白酶組織抑制劑(tissue inhibitor of metal-oproteinases,TIMPs)共同調控ECM,維持細胞的穩定性。調控機制的不平衡會使ECM過度降解導致一系列疾病,如腫瘤的侵入及擴散轉移、關節炎、牙周炎、牙髓炎等。本實驗結果顯示體外牙髓細胞經細菌上清液刺激8d后,正常組未見MMP-8 mRNA表達,刺激組表達明顯,表達的差異說明MMP-8是牙髓炎癥過程中重要的活動因子之一,進一步顯示MMP-8在牙髓炎中參與了牙髓組織ECM的降解。牙髓炎癥期,牙髓組織中ECM降解是組織發生不可逆性損傷的重要因素之一,是MMPs對細胞外基質降解的主要因素,MMP-8在牙髓組織細胞外基質代謝過程中,特別是在I型膠原的降解過程中發揮著關鍵性作用,而I型膠原蛋白又是牙髓細胞中主要的細胞外基質成份之一,所以對于MMP-8的研究為牙髓病的治療奠定了一定的基礎。基質金屬蛋白酶在牙髓組織細胞外基質代謝過程中發揮著關鍵性作用。因此,尋找有效的MMPs抑制劑可為攻克牙髓病開辟了一條新的途徑。
[1]Hannas A R,Pereira J C,Granjeiro J M,et al.The role of matrixmetalloproteinases in the oral environment[J].Acta Odontol Scand,2007,65(1):1.
[2]Chang YC,Lai CC,Yang SF,et al.Stimulation of matrix metalloproteinases by black-pigmented Bacteroides in human pulp and periodontal ligament cell cultures[J].J Endod,2002,28(2):90.
[3]Nakata K,Yamasaki M,Iwata T,et al.Anaerobic bacterial extracts influence production of matrix metalloproteinases and theirinhibitors by human dental pulp cells[J].J Endod,2000,26(7):410.
[4]TervahartialaT,PirilaE,CeponisA,et al.The in vivo expression of the collagenolytic matrix metalloproteinases(MMP-2,-8,-13,and 14)and matrilys in(MMP-7)in a dult and localized juvenile periodontitis[J].J Dent Res,2000,79(12):1969.
[5]G oncalves LD,Oliveira G,Hurtado PA,et al1 Expression of metalloproteinases and their tissue inhibitors in inflamed gingival biops ies[J].J Periodont Res,2008,43(5):570.
[6]樊明文主編.牙體牙髓病學[M].第3版.北京:人民衛生出版社,2008:149-158.
[7]Jie Bao G,Kari K,Tervahartiala T,et al.Proteolytic activities of oral bacteria on ProMMP-9 and the effect of synthetic proteinase inhibitors[J].Open Dent J,2008,2:96.
[8]Lin SK,Kuo MY,Wang JS,et al.Differential regulation of interleukin-6 and inducible cyclooxygenase gene expression by cytokines through prostaglandin-dependent and-independent mechanisms in human dental pulp fibroblasts[J].J Endod,2002,28(3):197.
[9]Dorothe Burggraf,Doxycycline inhibits MMPs via modulation of plasminogen activators in focal cerebral ischemia[J].Neurobiology of Disease,2007,25:506.
[10]Creemers LB,Jansen ID,Docherty AJ,et al.Gelatinase A(MMP-2)and cysteine proteinases are essential for the degradation of collagen in soft connective tissue[J].Mat rix Biol,1998,17(1):35.
[11]Morand MA,SchilderH,Blondin J,et al.Collagenolytic and elastinolytic activities from diseased human dental pulps[J].J Endod,1981,17(4):156.
[12]Gusman H,Santana RB,Zehnder M.Matrix metalloproteinase levels and gelatinolytic activity in clinically healthy and inflamed humandental pulp[J].Eur J Oral Sci,2002,110(5):353.
[13]lture method:The expression of collagen and matrix metalloproteinases(MMPs)[J].Adv Dent Res,2001,15(8):55.
[14]Shin SJ,Lee J I,Baek SH,et al.Tissue levels of matrix metalloproteinases in pulps and periapical lesions[J].J Endod,2002,28(4):313.
[15]Bildt MM,Bloemen M,Kuijpers-Jagtman AM,et al1 Matrix metal2loproteinase inhibitors reduce collagen gel contraction and alphasmooth muscle actin expression by periodontal ligament cells[J].J Periodontal Res,2009,44(2):266.

