數學史滲透數學教學的微思考
——以“有理數”單元為例
黃賢明 (江蘇省蘇州高新區景山實驗初級中學校 215129)
近年來,數學史與數學教育(HPM)的研究在國內受到廣泛關注,并從理論與實踐上證實了HPM的教育價值.正如“使面包和黃油更加可口的蜂蜜”,數學史使數學學習更具有吸引力.對學生而言,數學史既能促進他們對數學知識的理解,拓展相關的數學背景,還可以引發學習數學的共鳴,培養正確的價值觀.對教師而言,數學史能幫助預測學生在數學學習中的困難,進而指導教學,同時豐富了教學資源,提升課堂的文化底蘊[1].本文介紹了“有理數”單元中數學概念的歷史,并分析了不同版本教材中“有理數”單元的數學史,提出在“有理數”單元滲透數學史的思考與建議,敬請指正.
1 “有理數”單元中的數學概念的歷史
通過介紹“有理數”單元中負數、有理數和乘方的歷史,讓學生發現中國古代對于有理數及其運算的發展作出了巨大的貢獻,相比同時期的國外處于相對領先的地步.
1.1 負數的歷史
負數的歷史源遠流長,它的概念最早出現在《九章算術》中,書中的“方程”章主要講解了“方程術”,在方程組的加減消元中就出現了負數的情形.為處理該情形,書中給出了正負數運算法則——“正負術”.同時,書中也給出了許多正負數的例子,如“方程”章中將“賣”記為正、“買”記為負,“余錢”記為正、“不足錢”記為負.數學家劉徽對正負數給出“今兩算得失相反,要令正負以名之”的定義,更明確了正負數是用于表示相反意義的量,并用紅色(正放)算籌表示正、黑色(斜放)算籌表示負.
在國外,對負數的認識比中國要晚很多.歐洲數學家更多關注負數的合理性,他們認為0是最小的數,而比0小的數是不存在的,即負數是荒謬的.直到19世紀整數理論基礎建立,負數才逐漸被普遍認可.
1.2 有理數的歷史

1.3 有理數乘方的歷史
劉徽在《九章算術》中用“冪”表示矩形的面積,這是在數學著作中首次出現的“冪”.此后在《數書九章》《四元玉鑒》等數學文獻中,“冪”均表示一數的平方.1607年,徐光啟在《幾何原本》的譯本中重新使用“冪”字,并將其定義為“自乘之數”,這就相當于定義“冪”為an.指數的概念最早出現在我國古代的音樂理論中.《管子》中說:“先主一而三之,四開合九九.”其中“四開”表示連乘4次,這將指數的概念明顯地表達了出來,也就是1用3去乘,連乘4次,得到結果就是九九之數,即34=9×9=81[3].
在西方,乘方運算起源很早,但指數的概念形成較晚.在法國數學家韋達用字母表示數之后,相關冪的記法層出不窮,直到法國數學家笛卡爾創造了冪的新記號an,瑞士數學家歐拉補充給出了指數的概念,自此形成了教材中乘方、指數等概念的定義與冪的符號[4].
2 不同教材中“有理數”單元的數學史
教材是教學內容的重要載體,是教師教學的主要依據,教材中的數學史內容是教師進行HPM教學的首要參考.現行的許多教材都通過設置特定欄目、選擇數學史習題等方式呈現數學史,供學生課后閱讀拓展.數學史在數學教材中的呈現方式主要有:點綴式、附加式、復制式、順應式和重構式[5](表1).“有理數”單元中蘊含著豐富的數學史料,以國內人民教育出版社、江蘇鳳凰科學技術出版社、北京師范大學出版社和華東師范大學出版社(以下分別簡稱為人教版、蘇科版、北師大版、華師大版)的四本七年級上冊數學教材為例,分析不同教材中“有理數”單元的數學史(表2).
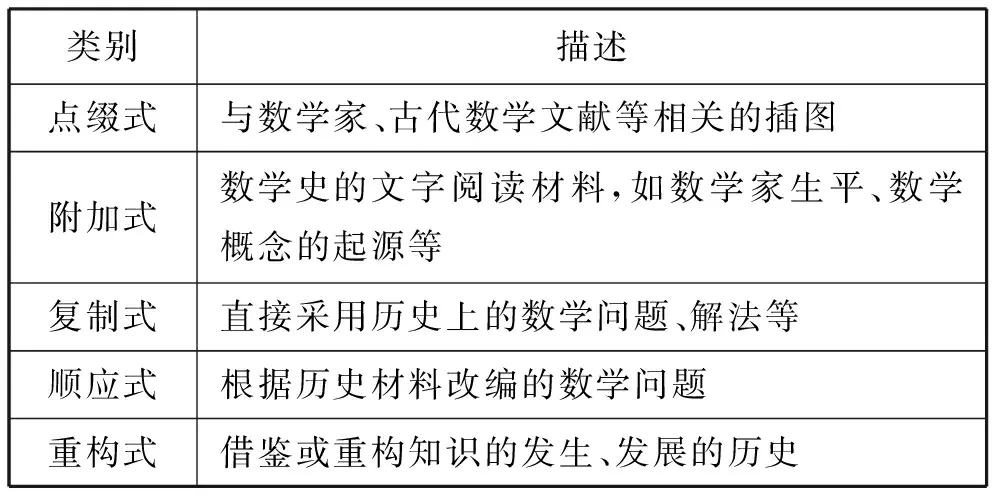
表1 數學教材中數學史的呈現方式
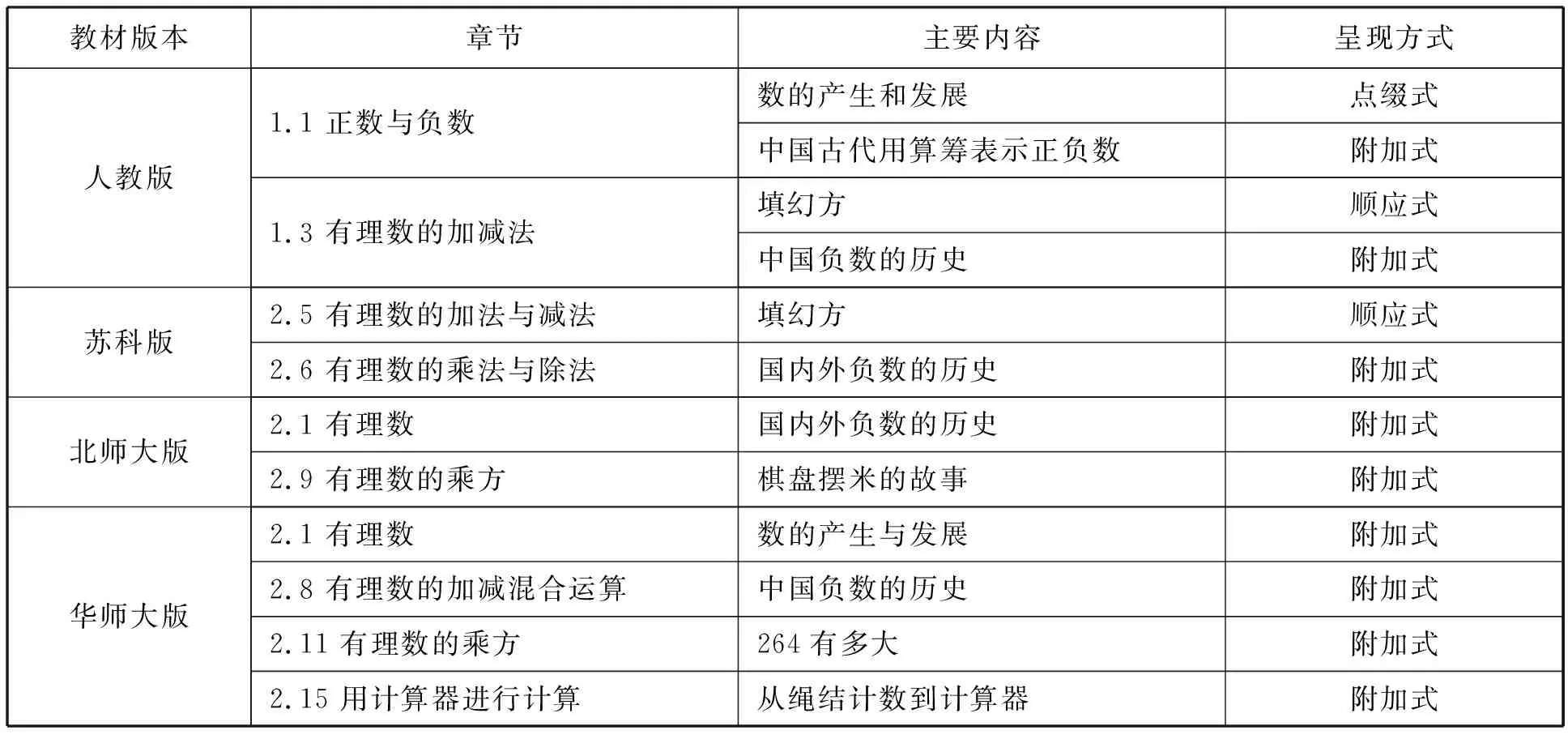
表2 不同版本教材“有理數”單元中的數學史
(1)編排數學史的章節.在四本教材中,數學史的呈現主要集中在有理數、有理數的運算和有理數的乘方這三個章節中.編排數學史的章節與“有理數”單元中數學概念歷史基本吻合.
(2)滲透數學史的內容.在四本教材中,“有理數”單元數學史的內容主要為數的發展、負數的歷史、棋盤擺米的故事和幻方.其中負數的歷史在四本教材中都專門設置了閱讀板塊呈現.在人教版和華師大版中主要圍繞《九章算術》講述了中國負數的歷史,并重點介紹了“正負術”.人教版給出了用紅黑算籌進行有理數加減運算的圖示,直觀地呈現了古代的運算方式,吸引力與可讀性更強;華師大版的材料中詳細介紹了《九章算術》和“正負術”,篇幅較大,且材料中出現“加減消元法”“韋達”等名詞,超越了學生的認知水平,難以引發學生的閱讀興趣和認知共鳴.蘇科版和北師大版都從國內外兩個方面介紹了負數的發展.蘇科版是史料的列舉,學生淺嘗輒止,只能體會到負數發展的漫長;北師大版從中國負數概念的歷史切入,并與國外負數概念建立的曲折對比,選取內容更利于學生形成對負數的文化性理解.
(3)數學史的呈現方式.在四本教材中,“有理數”單元的數學史呈現方式以附加式為主,順應式等其他方式為輔.附加式的內容均在課后閱讀欄目中呈現,作為學生課后補充閱讀的相關素材.順應式的數學史只聚焦于中國傳統游戲幻方.其他方式在四本教材的“有理數”單元中基本沒有體現.
3 思考與建議
3.1 有“米”而炊:融合不同版本教材
在HPM教學中,教師最大的煩惱就是缺乏數學史素材,而不同版本的教材就會從多種角度為教師提供數學史料.例如,在“正數與負數”一課中,教師可選取人教版“數的產生與發展”的圖片引入,揭示數的產生與發展離不開人類社會發展的需要,并提出“數0就表示‘沒有’嗎?”的問題,以數學史上西方對數0的困擾來導入對負數的探索,重構負數的歷史;在課后拓展環節,可選取北師大版的閱讀材料“負數小史”來介紹中外負數的歷史,促進學生文化性理解的形成,增強民族自豪感.教師在教學中有選擇地將不同教材中的史料融合,發揮它們的優勢與亮點,同時將數學史素材“問題化”[6],引導學生重走數學內容的產生與發展過程,形成對數學史的內在認同,真正發揮出數學史的育人價值.
3.2 多樣呈現:讓課堂浸潤數學史
就數學史在教材中的呈現方式而言,附加式偏多,其他方式相對較少.在實際教學中,教師應彌補教材的不足,以多樣化的方式呈現數學史,增添課堂的文化味.以蘇科版教材為例,在“有理數”單元,教材更關注有理數內容的生活化,淡化了有理數中蘊含的歷史價值.此時,教師可以在教學課件中以點綴式或附加式呈現相關史料,如《九章算術》中的“正負術”簡介、數學家劉徽的圖片、《九章算術》書影,等等.其次,可有目的地選取合適的課題組織重構知識發生的歷史.另外,教師也可設計數學史主題的導學案,將精選的史料以紙質形式呈現給學生,以此增強學生學習數學的興趣.
3.3 指向理解:數學史為知識學習服務
數學史料的選取要具備趣味性、科學性、可學性、有效性和人文性[7].這些數學史的選取以及在課堂教學中滲透的目的不僅是為了學生情感與價值觀的培養,更重要的是為學生理解數學知識、領會數學思想和掌握數學方法,做到數學史為數學學習而服務.例如,在有理數概念的教學中,教師可呈現有理數名稱由來的數學史料,但其目的是建立“理”與“比例”之間的聯系,消除學生從字面意思來理解有理數而產生的困惑,促進學生對有理數概念的理解.
總之,數學史并非教師的“作秀”工具,數學史的滲透有其深層次的價值與意義.作為一線的教育工作者,更要重視教材、教學內容背后的數學史,真正讓數學史落實到課堂中,真正讓數學史從“史學形態”走向“教育形態”[8].

