擬南芥Formin家族蛋白AFH14基因的克隆及功能結構域分析
李艷花
(山西大同大學腦科學研究所,山西大同 037009)
擬南芥Formin家族蛋白AFH14基因的克隆及功能結構域分析
李艷花
(山西大同大學腦科學研究所,山西大同 037009)
應用RT-PCR的方法從擬南芥cDNA中克隆了AFH14的全序列,并對其功能結構域進行分析。發現所克隆的目的基因編碼區全長3 102bp,與基因組序列比對發現該基因包含18個內含子和18個外顯子,編碼1 033個氨基酸殘基。通過與其它formin成員的序列比對分析,發現AFH14是一個典型的擬南芥II型formin,包括PTEN結構域。
AFH14;Formin;PTEN;FH1;FH2
Formin蛋白是一類高度保守的多結構域蛋白,在多個物種中都有較多的發現。而且,除了植物,幾乎現有的常用于細胞生物學研究的物種都有發現。formin是既和微絲互作也和微管互作[1-2]。植物formin根據結構域組成上的不同分為I型和II型兩大類,目前關于植物formin的研究大都集中在I型formin上[3],尚沒有關于高等植物II型formin的研究報道。AFH14屬于一個典型的II型formin,該基因的研究將拓展我們對植物formin蛋白家族成員的認識,有助于揭示它對微管微絲動態過程的調控機制。
1 材料與方法
1.1 材料與試劑
1.1.1 材料
供試材料為任海云實驗室保存的哥倫比亞0型野生擬南芥。種植條件:擬南芥種子在4℃冰箱中,冷處理3d,然后種植在Hoagland擬南芥培養基(含1.2%瓊脂,3%的蔗糖)上,光周期為光照16h,黑暗8h,溫度為22~24℃,生長至7d的小苗用來提取RNA。
1.1.2 試劑
RNA提取試劑盒購自奧萊博生物科技有限公司,DEPC水購自Sigma公司。反轉錄試劑盒:采用invitrogen的Superscript III,pfu DNA聚合酶,dNTP,DNA連接酶以及限制性內切酶均購自Takara公司,DL2000plus Marker來自全式金。引物合成和測序由英濰捷基(上海)貿易有限公司完成。其他試劑均為國產分析純。
1.2 方法
1.2.1 擬南芥小苗RNA的提取和cDNA的獲得
1)擬南芥小苗總RNA的提取按照RNA提取說明書(AutoLab生物技術)說明書完成,并使用核酸蛋白測定儀檢測RNA均一性。
2)反轉錄cDNA獲得
體系中包括5 μg RNA,0.5 μg Oligod T,補DEPC-ddH2O至13.3μL。之后70℃,5min,冰浴至少2min。在上述體系中加入以下物質:5 μL 5×M-MLV reaction buffer,5μL dNTP,0.7μL RNase Inhibitor,1μL M-MLV,補DEPC-ddH2O至25μL。42℃,60min溫育。
1.2.2 PCR擴增
應用Primer Premier 5軟件,根據已登錄TAIR數據庫中預測的AFH14的cDNA的序列和unigene中公布的EST序列設計引物:AFH14f:5'ATGTCTTTGTTAAGTAGATTCTTTTACA3′,AFH14r:5'TGTTCTATGTCTATGGATCTGCTG3′;使用TaKaRa的pfu系統,退火溫度為53℃,延伸3min,經過35輪退火延伸。
1.2.3 基因克隆與序列分析
擴增產生核酸產物經電泳檢測后用瓊脂糖凝膠回收試劑盒回收目的條帶,回收產物與線性克隆載體pGEMT-5Z進行平端化連接,轉化大腸桿菌DH5a的感受態細胞,經藍白斑篩選后挑取白色單克隆細胞進行擴大培養。選取經瓊脂糖電泳、PCR、酶切檢測陽性的質粒送英濰捷基公司測序,測序結果通過DNAman、Clustal W軟件進行序列拼接和比對分析。
2 結果
2.1 AFH14cDNA的克隆、鑒定及生物信息學分析
AFH14是一個典型的II型formin,NCBI上搜索,發現Genebank中含有AFH14的cDNA序列預測,而且基因組注釋中存在大量的關于該基因在植株中表達的microarray數據。因此本研究以AFH14為研究對象,擬采用RT-PCR方法擴增出該基因的CDS,從而為進一步研究該基因功能奠定基礎。
2.2 擬南芥AFH14cDNA的克隆、鑒定
2.2.1 總RNA及其質量鑒定
總RNA的質量好壞是反轉錄cDNA成敗的關鍵。本工作利用固體培養基培養7d的擬南芥幼苗為材料,提取總RNA。取5μL擬南芥總RNA,加入1μL的6×Loading buffer,經200V,5min瓊脂糖電泳,發現28S和18S條帶清晰,亮度比例大約2∶1,表明提取RNA質量較好,見圖1。另外,取1μLRNA和99μL DEPC處理水,用核酸蛋白測定儀測定OD260和0D280的值,多次測定取平均值。計算OD260/0D280=2.0,表示所提取的總RNA純度比較高,沒有蛋白質和基因組污染。

圖1 擬南芥總RNA瓊脂糖凝膠電泳
2.2.2 AFH14 CDS的擴增與鑒定
利用上述RNA為模板,經Superscript III逆轉錄酶產生cDNA,并以該cDNA為模板,以AFH14f和AFH14r為引物,按材料與方法中所述條件進行PCR。經1.0%瓊脂糖電泳檢測,在3 000bp左右有明顯條帶,見圖2(箭頭所示),膠回收后并連接至pGEM-5Z Vector中得到質粒pGEM-AFH14,克隆載體pGEM-AFH14經PCR、酶切鑒定正確后,進行測序分析。測序分析表明所克隆到的序列長3 102bp,與TAIR上所預測的序列不完全一致,克隆片段缺少預測片段中從1 510~2 101的序列。進一步重復實驗證明,該基因的CDS中確實是沒有這一片段。通過與基因組序列比對分析發現AFH14基因包括18個外顯子,18個內含子。
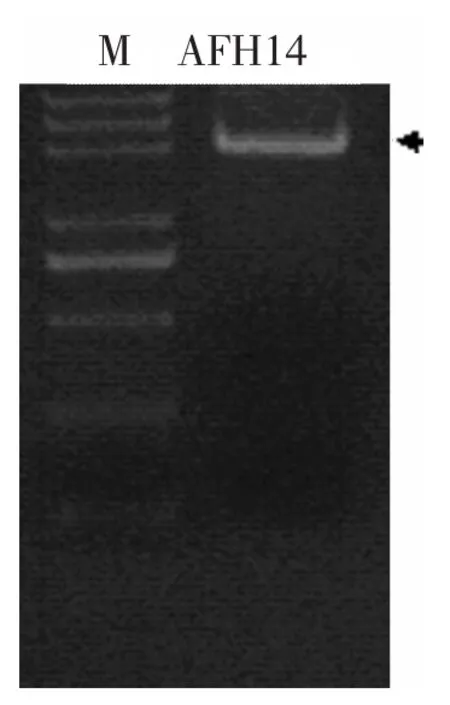
圖2 RT-PCR產物的電泳結果
2.3 AFH14全長蛋白結構域及同源性分析
使用DNAMAN軟件分析顯示,擴增得到的AFH14核苷酸序列編碼的蛋白全長1 033aa,預測該蛋白的等電點為6.34,分子量為116.3kDa。像formin家族的其它成員,AFH14也是一個多結構域蛋白,位于N-端是一個phosphatase tensin-related domain(PTEN)結構域,包括1~394aa;一個富含脯氨酸的FH1結構域位于489~594aa,脯氨酸含量高達48%。從595~1033aa是一個序列和功能都保守的FH2結構域。通過與formin家族其它成員FH2結構域序列比對,發現AFH14與AFH17、AFH18的FH2結構域的同源性較高,分別高達52.14%和59.17%。而AFH17和AFH18的同源性高達83.02%。另外與formin家族其它成員擁有較多保守的氨基酸,在FH2結構域存在保守的G-N-X-M-N motif,只是II型formin的M被L所替換。在這個motif周圍,也具備II型formin普遍存在的M-H-Y-L/Y-C-K motif。特別是與Bni1p的肌動蛋白結合和成核的K1 639、I 1431位點同源的氨基酸是保守的,K 1601僅被生化活性更強的R替換。這些保守序列暗示AFH14可能具有與Bni1p相似的微絲結合與成核能力3。
3 討論
晶體結構和序列比對結果顯示,所有的formin在C-端均有一個核心基序:M-H-Y-L/Y-C-K。在這個核心基序的附近II型formin包含一個G-NX-M-N基序[3],與formin蛋白的二聚化有關。通過與Bni1p的FH2結構域比對,發現相對于Bni1p的K 1601、K 1639、I 1431是保守的微絲成核、正端封端與結合的位點[3]。AFH14這些基序和堿基都是保守的。只是K 1601的堿基被生物化學性質相似的R所替換,這個可能并不影響formin蛋白的微絲成核活性。AFH14也包含有與FH2結構域相鄰的富含脯氨酸的FH1結構域,在TAIR的數據顯示,該結構域比實驗中所獲得的序列要長,在預測和擴增得到的內含子與外顯子交接處都存在5`GT和3`AG序列,推測可能是由于錯誤的評估了剪接位點的位置導致了CDS預測失誤。FH1結構域中有48%的脯氨酸,與formin的FH1結構域中脯氨酸含量平均值41%相似,所以認為該結構域也是一個典型的FH1結構域。在N-端有一個典型的II型formin特有的PTEN結構域。首先與其它相類似的formin的PTEN序列進行比對,發現有40%~60%的相似性,另外和擬南芥的PTEN蛋白有20%相似性。對于該結構域類型的formin實驗性研究很少,只有在moss的研究中發現與極性生長有關[4]。該類formin的報道大多是些生物信息學預測的知識。有文獻認為AFH14的PTEN結構域與人的PTEN蛋白相似,但是保守的磷酸化位點T383被K替換,所以認為AFH14可能沒有了磷酸化的功能,可能只在該蛋白定位中起作用,而與功能不相關。同時也有文獻認為PTEN可能介導II型formin與膜性結構相互作用的調控。在擬南芥有3個PTEN相關蛋白,其中AtPTEN1在花粉中表達,缺失該基因導致花粉死亡[5],AtPTEN2過表達導致雄性不育[6]。另也有文獻認為PTEN類似于tensin,可能通過黏連微絲與質膜在信號通路中起作用。但是在我們的研究中發現PTEN可能與膜性結構的關系并不密切,更可能是與細胞周期中微管、微絲相關的,作用方式有可能是直接的也有可能是間接的。通過序列分析我們可以清晰地發現,AFH14是一個序列非常保守的II型formin。
[1]Bartolini F,Moseley J,Schmoranzer J,et al.The formin mDia2 stabilizes microtubules independently of its actin nucleation activity [J].J Cell Biol,2008,181(3):523-536.
[2]Deeksm,Fendrychm,Smertenko A,et al.The plant formin AtFH4 interacts with both actin and microtubules,and contains a newly identified microtubule-binding domain[J].J Cell Sci,2010,123(8):1209-1215.
[3]Cvrcˇková F,Novotnym,Pícková D,et al.Formin homology 2 domains occur in multiple contexts in angiosperms[J].BMC Genom.,2004,5(44):44-61.
[4]Vidali L,Gisbergen P A C,Guérin C,et al.Rapid formin-mediated actin-filament elongation is essential for polarized plant cell growth[J].Proc Natl Acad Sci USA,2009,106(32):13341-13346.
[5]Gupta R,Ting J T L,Sokolov L N,et al.A tumor suppressor homolog,AtPTEN1,is essential for pollen development in Arabidopsis [J].Plant Cell,2002,14(10):2495-2507.
[6]Sormani R,Pribat A,Rousseaum,et al.Over expression of a plant homolog of the human tumor suppressor PTEN leads to flower sterility[C].20th international conference on Arabidopsis Research,2009,46.
〔編輯 楊德兵〕
Cloning and Sequence Analyzing of AFH14 Gene in Arabidopsis Thaliana
LI Yan-hua
(Institute of Brain Science,Shanxi Datong University,Datong Shanxi,037009)
The study of the function and properties of formins from plant cell is quite limited.In this study,Arabidopsis FH14(AFH14)has been cloned,analyzed.To obtain the full-length ORF,we performed RT-PCR to amplify a cDNA encoding the entire sequence of AFH14.The gene was found to encode 18 exons and 18 introns,and to encode a 3 102-nucleotide mRNA with a single open reading frame estimated to produce a 113.6-kD protein of 1 033-amino acid residues.The AFH14 protein consisted of three functionally distinct subdomains:an N-terminal PTEN(phosphatase tensin)-related domain,a prorich FH1 domain,and a highly conserved C-terminal FH2 domain.
AFH14;Formin;PTEN;FH1;FH2
X703.5
A
1674-0874(2011)03-0048-03
2011-01-08
李艷花(1977-),女,山西應縣人,博士,講師,研究方向:細胞生物學。

