EPO對全腦缺血后低氧誘導因子1α及存活素表達的調節
歐陽和中 江蘇省丹陽市人民醫院神經內科 丹陽 212300
李云 山東省濟南市中心醫院急診科 濟南 250013
EPO對全腦缺血后低氧誘導因子1α及存活素表達的調節
歐陽和中 江蘇省丹陽市人民醫院神經內科 丹陽 212300
李云 山東省濟南市中心醫院急診科 濟南 250013
[目的]研究促紅細胞生成素對全腦缺血再灌注大鼠缺氧誘導因子1α和凋亡相關蛋白存活素的調節,探討其抗凋亡的可能機制。[方法]將成年雄性SD大鼠75只按隨機數字表法分為全腦缺血組(n=35)和全腦缺血EPO干預組(n=35),然后按再灌注時間不同又分為6h、12h、24h、48h、72h、5d和7d七個亞組。采用改良的Pu劉lsineli 4-VO法制作全腦缺血大鼠模型。應用TUNEL染色檢測再灌注后不同時間點海馬CA1區的神經元凋亡水平,免疫組織化學方法檢測再灌注后不同時間點海馬CA1區缺氧誘導因子1α和存活素表達水平的變化。[結果]全腦缺血EPO干預組24h至7d亞組TUNEL陽性神經元計數分別為1.50±0.73、3.14±0.88、5.78±1.03、7.78±1.79、10.34±1.82.與全腦缺血組相應時間點亞組相比明顯減少,差異均有統計學意義(P<0.05)。全腦缺血EPO干預組48h至5d亞組HIF-1α表達陽性細胞計數分別為11.26±0.02、20.28±2.03、3.33±0.04,與全腦缺血組相應時間點亞組相比明顯減少,差異均有統計學意義(P<0.05).全腦缺血EPO干預組24h至5d亞組survivin蛋白表達陽性細胞計數分別為12.21±1.04、16.34±4.02、24.33±3.03、30.52±5.04,與全腦缺血組相應時間點亞組相比明顯增高,差異均有統計學意義(P<0.05)。[結論]在全腦缺血急性期,EPO抑制HIF-1α的表達而使存活素表達升高,具有一定的神經保護作用.
Global Cerebral Ischemia; hippocampus; Survivin;Erythropoietin; Hif-1α
促紅細胞生成素(EPO)基因是缺氧誘導因子-1(hypoxia inducible factor-1,HIF-1)的下游基因。EPO具有神經保護作用,是近年來人們對這個神經體液因子新的認識,但其機制尚未明了。存活素(Survivin)是最近新發現的一種凋亡蛋白抑制因子(inhibitor of apoptosis protein, IAP)家族成員。研究表明,在腫瘤的發生發展過程中,多種細胞因子如EGF等可通過HIF-1α途徑上調survivin基因表達來阻止細胞凋亡。本實驗大鼠對全腦缺血大鼠應用EPO,并檢測HIF-1α、Survivin在此干預措施下表達水平的變化以及該變化對缺血后神經細胞凋亡的影響,通過研究這些變化之間的相關性,來探討全腦缺血后EPO抗凋亡神經保護的可能機制。
1.材料和方法
1.1 材料 健康成年雄性SD大鼠75只,體重315±20g,由山東大學實驗動物中心提供;促紅細胞生成素(商品名:益比奧)購于沈陽三生制藥股份有限公司;Survivin 多克隆抗體(鼠抗) 購于Santa Cruz公司HIF-1α多克隆抗體(兔抗)購于武漢博士德公司;細胞凋亡檢測試劑盒(In Situ Cell Apoptosis Detection Kit Ⅰ, POD)、多聚賴氨酸、DAB顯色試劑盒由武漢博士德公司提供。SP通用型試劑盒(sp-9000)(試劑盒組成包括:3%H2O2去離子水、封閉用正常山羊血清工作液、生物素化二抗工作液、辣根酶標記鏈霉卵蛋白素工作液):購于北京中山金橋生物技術開發有限公司。powerlab多導電生理系統、Chart5分析軟件:ADInstruments,澳大利亞,由山東大學醫學院生物醫學工程教研室提供。
1.2 方法
1.2.1 動物分組 將成年雄性SD大鼠75只按隨機數字表法分為全腦缺血組(n=35)和全腦缺血EPO干預組(n=35),然后按再灌注時間不同又分為6h、12h、24h、48h、72h、5d和7d7個亞組。
1.2.2 動物模型制作 采用改良的Pulsinelli[1]四血管阻斷法制作大鼠全腦缺血再灌注模型。大鼠術前24h禁食,自由飲水。經10%的水合氯醛(300~350mL/kg)麻醉后,俯臥位固定,于頸后正中切長約2cm的切口,顯露第1頸椎雙側的翼孔,插入雙極電凝針,電凝雙側椎動脈使之完全閉合,縫合傷口,置籠喂養,自由飲食。24h后同法麻醉,仰臥位固定,頸前正中線切長約2cm切口,暴露雙側頸總動脈, 于頭皮下插入針狀電極,動態監測腦電變化,然后用微型無創動脈夾夾閉雙側頸總動脈,以出現靜息腦電波為判定大鼠全腦缺血的標準,10min后放開動脈夾,恢復血液供應,縫合傷口。假手術組動物僅灼燒雙側椎動脈,但不夾閉雙側頸總動脈,其余步驟同上。
1.2.3 給藥方法 GI+EPO組中,全腦缺血10分鐘取下動脈夾后,立即給予EPO腹腔注射(4000U/kg/day),其中6h、12h和1d亞組只在缺血后給予一次EPO治療,2d亞組第二天再給予一次同樣劑量的EPO治療,3d、5d和7d亞組第二天和第三天分別再給予一次同樣劑量的EPO治療。全腦缺血組每天給予等劑量生理鹽水腹腔注射。假手術組不給予干預措施。
1.2.4 標本獲取 將大鼠在相應的時間點用10%水合氯醛麻醉后,沿正中線剪開胸腔,將連接著灌注管的粗針頭從心尖部插入左心室,再入升主動脈,用大止血鉗固定針頭,先用4℃肝素化0.1M的PBS溶液200ml迅速沖凈腦內血液,再用4℃0.1M的PBS-4%多聚甲醛溶液400ml灌注固定30分鐘,大剪刀斷頭,放于冰盒上,迅速分離腦組織(注意保持腦組織完整性)置于0.1M的PBS -4%多聚甲醛溶液中后固定24小時,然后放入30%蔗糖溶液中脫水直至腦組織沉至瓶底。 冰凍切片機(-20℃)自視交叉后2.2mm處向后連續冠狀切片,染色。
1.2.5 TUNEL染色標記凋亡細胞 用計算機圖像儀軟件Image Pro Plus處理TUNEL染色片,計算海馬CA1區TUNEL陽性神經細胞(核)數。
1.2.6 免疫組織化學(SP法)檢測海馬CA1區HIF-1、survivin陽性細胞計數 用SP法進行CA1區HIF-1α、survivin免疫組化,切片在400倍視野下進行海馬CA1區CA1區HIF-1α與survivin陽性細胞計數。每張切片海馬CA1 區任選5個視野,對CA1區HIF-1 α與survivin陽性細胞計數,計算出該切片的平均CA1區HIF-1α與survivin陽性細胞數。
2.結 果
(一)、TUNEL染色
GI組再灌注后24小時后TUNEL陽性細胞明顯增加,24小時、48小時、72小時、5天、7天亞組與Sham組相比有統計學差異(p<0.05);
GI+EPO組再灌注48小時后,TUNEL陽性細胞才有明顯增加。48小時、72小時、5天、7天亞組細胞數與Sham組相比有顯著差異(p<0.05)。
配對t檢驗
在相應的24小時、48小時、72小時、5天、7天的時間點亞組,GI+EPO組的TUNEL細胞數目比GI組的明顯少,具有統計學意義(p<0.05)(表1)。

表1 各組大鼠海馬CA1區TUNEL陽性細胞數( x±s, 個) (40×10)P=0.0001
(二)、缺氧誘導因子1α的表達(表2)
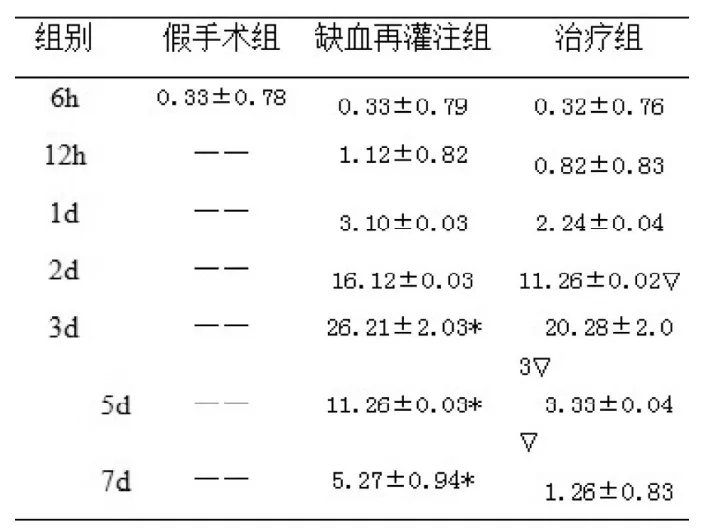
表2 各組大鼠海馬CA1區HIF-1α陽性細胞數(個, x±s)Tab2 Expression of HIF-1α protein(number of positive cells) in the CA1 area of hippocampus from sham group、GI group and GI+EPO group
GI組再灌注12 h后在海馬CA1區中可見HIF-1α表達增加, 3 d 達高峰,后逐漸下降;與Sham組比較GI組24 h、3 d、5 d、7 d亞組的HIF-1α的表達均明顯升高,具有統計學意義( P<0.05)(圖1)。
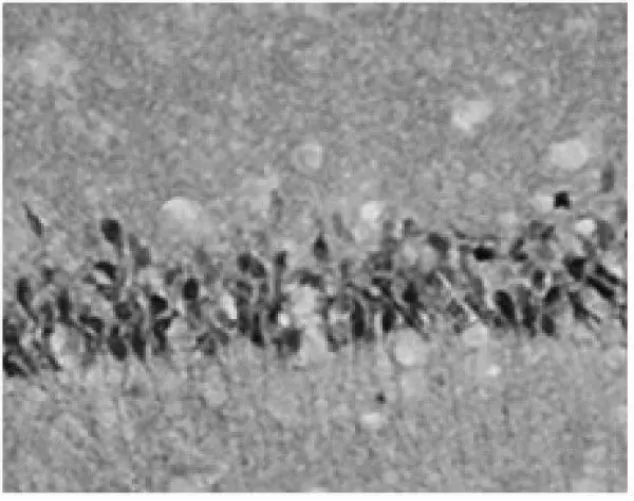
圖1.缺血再灌注3d HIF-1α表達達高峰(×400)Fig.1 the expression of HIF-1α peaked at 72h in ischemia/reperfusion group(×400)
GI+EPO組再灌注后12h也可見HIF-1α的表達開始增加, 也在 3 d時達高峰,5 d、7 d明顯下降。與GI組相比, 24 h、2 d、3 d、5 d 亞組HIF-1α的表達顯著降低,具有統計學意義( P<0.05),12 h亞組HIF-1α的表達水平稍低于GI組,計算無統計學意義(P>0.05)(圖2)。

圖2 治療組3d亞組HIF-1α表達明顯低于缺血再灌注(×400)Fig.2 the expression of HIF-1α was obviously lower in 3d subgroups of treatment group than that in model group(×400)
存活素的表達(表3)
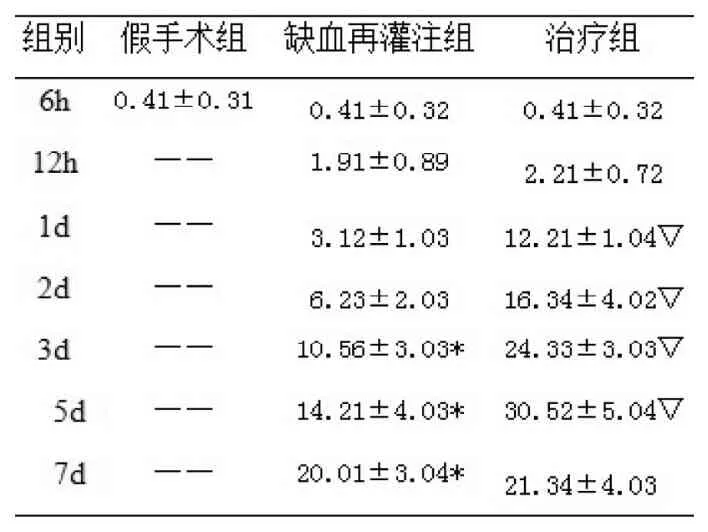
表3 免疫組織化學染色顯示各組大鼠海馬CA1區Survivin表達陽性細胞數(個, x±s)Tab3:Expression of Survivin protein(number of positive cells) in the CA1 area of hippocampus from sham group、GI group and GI+EPO group
在假手術組大鼠海馬CA1區中極少見陽性表達。
GI組在再灌注6h~48h極少見到陽性表達,72h后在海馬CA1區中可見Survivin少量表達, 7 d 達高峰, 與Sham組比較GI組72 h、5 d、7 d亞組的Survivin的表達均明顯升高,具有統計學意義(P<0.05) ;

圖3 缺血再灌注7d survivin表達達高峰(×400)Fig.3 the expression of survivin peaked at 7d in ischemia/reperfusion group(×400)
GI+EPO組再灌注后6 h、12 h極少見到陽性表達,24h即見Survivin的高表達,之后隨時間延長,其表達明顯增加,5d 時達高峰,7d時稍下降。與GI組相比, 再灌注后24 h、48 h、72 h、5 d 時Survivin的表達顯著升高,具有統計學意義( P<0.05),且表達時間及高峰提前。7d亞組survivin表達水平稍高于GI組,計算無統計學意義(P>0.05)。
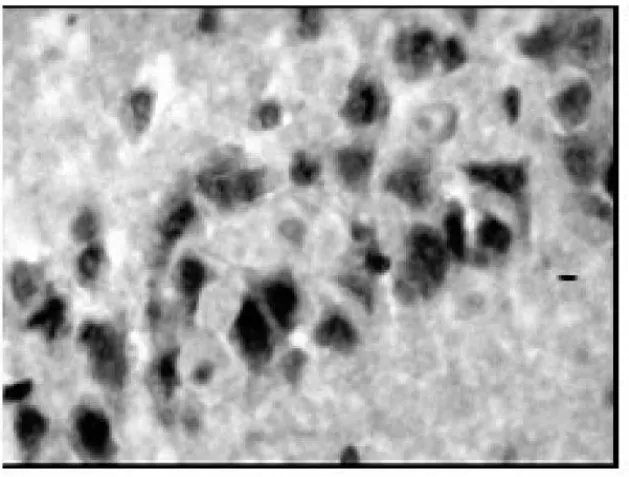
圖4 缺血再灌注5d survivin表達達高峰(×400)Fig.4 the expression of survivin peaked at 5d in ischemia/reperfusion group(×400)
3.討 論
全腦缺血缺氧常發生在臨床常見的各種休克、心臟驟停、哮喘持續狀態、CO中毒等之中,由于腦細胞的能量供應主要來源于糖有氧代謝,幾乎沒有能量儲備,因此腦組織對缺血缺氧十分敏感,尤其是大腦皮質(第3、4層)和海馬神經元。新近有實驗研究表明,大鼠全腦缺血12分鐘再灌注3天時,海馬CA1區的神經元有92%發生凋亡[2]。
細胞凋亡[3]由基因表達調控,其過程紛繁復雜。目前已發現了眾多促凋亡基因如p53、p21、caspase、bcl-2等;同時也相應存在一些抗凋亡基因[4],如促紅細胞生成基因、EPO編碼基因、血管內皮生長因子(VEGF)及血管內皮生長因子受體-1(VEGFR-1,Flt-1)的編碼基因等。而以上基因均由缺氧誘導因子-1(hypoxia inducible factor-1,HIF-1)調控表達。研究表明,嚴重腦缺血缺氧后HIF-1的活化形式HIF-1α的過量表達的促神經細胞凋亡作用遠大于其神經保護作用。
Survivin作為IAP家族成員之一,能夠通過促進組織微血管生成[5、6、7]、抑制天冬氨酸特異性的半胱氨酸酶(cysteine proteinases with specificity for aspartic acid residues, caspase)的表達[8、9、10]而發揮強大的抗凋亡作用。如何降低缺血性腦血管病腦組織中Hif-1α及其下游促凋亡基因的過度表達、提高survivin等抗凋亡因子的表達而起到腦保護作用,是目前研究的熱點之一,如日本學者Okazaki等嘗試了給予大腦中動脈梗死的小鼠模型注射骨髓基質細胞來提高survivin的表達,結果顯示有一定效果[11]。而有研究發現,全腦缺血后應用EPO干預處理可降低HIF-1的下游促凋亡基因rtp-801等的表達。
HIF-1α與survivin在缺血缺氧環境下的表達具有相關性,目前在惡性腫瘤的研究中已得到大量的驗證。Hongzhen Zhang等在對人食道鱗狀上皮細胞癌的研究中發現HIF-1α與survivin協同表達,在腫瘤的惡性程度、臨床分期及遠端轉移等起到重要作用[12]。
Edward M.Conway[13]等研究觀察到缺氧相關的存活素mRNA表達水平的增加在HIF-1α基因敲除的胚胎干細胞低氧培養中更加顯著。這個結果通過對幾組相同環境下的ES細胞克隆進行實驗而確認,提示HIF-1α在缺氧條件下可能直接也可能間接地抑制了存活素的表達。
因此本研究應用EPO治療干預全腦缺血模型,檢測HIF-1α與survivin表達的變化,表明應用EPO可顯著延遲并較少全腦缺氧再灌注后海馬神經元的凋亡;與之相對應的,應用EPO后,24 h、2 d、3d、5 d 亞組HIF-1α的表達顯著降低,而24h、48h、72h、5 d時Survivin的表達顯著升高,表明HIF-1α與Survivin的表達具有相關性,并能夠被EPO所調控。
由此推論,EPO可能通過反饋抑制嚴重腦缺氧后HIF-1α的過度表達而解除了對survivin表達的抑制來發揮抗凋亡作用。
[1]Pulsinelli W A, Brierley J B, Plum F.Temporal profile of neuronal damage in a model of transient forebrain ischemia[J].Ann Neurol,1982,11(5): 491-498
[2]Zhang F,Signore A P,Zhou Z,et al.Erythropoietin protects CA1 neurons against global cerebral ischemia in rat: potential signaling mechanisms[J].J Neurosci Res,2006,83(7):1241-1251
[3]Peter Lipton.Ischemic Cell Death in Brain Neurons[J].Physiological Reviews,1999,79(4):1431-1568
[4]形成明.缺血性腦血管病[M].北京:人民衛生出版社.2003:156-159
[5].Conway EM, Zwerts F, Eygen VV, et al.Survivin-dependent angiogenesis in ischemic brain, molecular mechanisms of hypoxia-induced up-regulation[J].Am J Pathol, 2003, 163(3): 935 - 946
[6]O'ConnorDS, Schechner JS, A dida C, et al.Control of apoptosis during angiogenesis by survivin expression in endothelial cells [J].American Journal of Pathology,2000,156(2):393-398
[7]Papapetropoulos A, Fulton D, Mahboubi K, et al.Angiopoietin-1 inhibits Endothelial cell apoptosis via the Akt/Survivin pathway [J].J Biol Chem,2000, 275(13):9102-9105
[8]Chakravarti A, Noll E, Black PM, et al.Quantitatively determined survivin expression levels are of prognostic value in human gliomas[J].J Clin Oncol, 2002, 20(4):1063-1068
[9]Borriello A, Boberto B, DellaBagione F, et al.Proliferation and survive: cell division cycle and apoptosis in human neuroblastoma[J].Haematologica,2002,87(2): 196-214
[10]MesriM, Wall NR, Li J, et al.Cancer gene therapy using a survivin mutant adenovirus[J].J Clin Invest, 2001, 108(7): 981-990
[11]Okazaki, Magaki,et al.Intravenous administration of bone marrow stromal cells increases survivin and Bcl-2 protein expression and improves sensorimotor function following ischemia in rats[J].Neuroscience letters,2008 Jan 10,430(2):109-114
[12]Hongzhen Zhang, Yazhen Wang, et al.Expression and clinical significance of HIF-1α,VEGF and Survivin in esophageal squamous cell carcinoma[J].Chinese-German Journal of Clinical Oncology,2007,6(4):339–344
[13]Edward M.Conway, Femke Zwerts,et al.Survivin-Dependent Angiogenesis in Ischemic Brain[J].American Journal of Pathology, 2003 Sep,163(3):935-946
EFFECT OF ERYTHROPOIETIN ON HIF-1α、SURVIVIN FOLLOWING GLOBAL CEREBRAL ISCHEMIA IN RATS
Ouyang He Zhong(Department of neurology,Danyang people’s Hospital of Jiangsu province,Danyang 212300 ,Jiangsu,China)
Objective
To observe the effects of EPO on the Hif-1α、survivin expression after global cerebral ischemiareperfusion in rats,exploring its antiapoptosis mechanisms.
Methods
The experimental GI model was established by 4-vessel occlusion method and confirmed successfully by an electroencephalogram (EEG).Seventy-nine adult male Sprague–Dawley rats were randomly divided into sham group (n=5), global cerebral ischemia group(GI, n=35) and global cerebral ischemia + EPO treatment group (GI+EPO, n=35),and the two latter groups to seven subsets each with 5 rats.
EPO were administered to rats in GI+EPO group by abdominal cavity injection (4000u/ kg /day)one time a day with the same dosage in the first 3 days.
The cerebral hippocampus tissues were obtained 3 days after sham operation in sham group and 6、12 hours、1、2、3、5 and 7 days after reperfusion in the GI and GI +EPO groups for determining apoptosis of cells by TUNEL and the expressions of Hif-1α、survivin proteins by Immunohistochemistry staining method.
All the data in this study were expressed as mean±standard deviation (SD).A value of P<0.05 was considered statistically significant.
Results
TUNEL staining
Compared to the sham group, the number of apoptotic cells in subset 1、2、3、5、7d of GI group and subset 2、3、5、7d of GI+EPO group were significantly increased.
The number of apoptotic cells in subset 1、2、3、5、7d of GI+EPO group were significantly less than of GI group.
Immunohistochemistry staining
Expression of Hif-1α
Compared to the sham group Hif-1αimmunopositive cells were significantly increased in the injured hippocampus in 1、2、3、5、7 d subsets of GI group(P<0.01) and GI+EPO group.
Compared to the corresponding subsets of GI group,expression level of survivin in subsets 1、2、3、5d of GI+EPO were significantly higher.Expression of survivin
Compared to the sham group survivin immunopositive cells were significantly increased in the injured hippocampus in 3、5、7 d subsets of GI group(P<0.01) and in 1、2、3、5、7d subsets of GI+EPO group.
Compared to the corresponding subsets of GI group,expression level of survivin in subsets 1、2、3、5d of GI+EPO were significantly higher.EPO significantly decreased the expression of Hif-1αand increased the expression of survivin(P<0.05), and decreased significantly the number of apoptotic cells compared to GI group(P<0.05).Conclusion
Rivalry to the overexpression of Hif-1αby EPO can induce overexpression of survivin, which might be one of the mechanisms in inhibiting neuronal apoptosis by EPO in the hippocampus after GBI.
10.3969/j.issn.1001-8972.2011.04.075
全腦缺血再灌注 ;海馬;存活素;促紅細胞生成素;缺氧誘導因子-1α

