微生物發(fā)酵產(chǎn)大豆異黃酮苷元的連續(xù)超聲波提取工藝及其定量分析研究
張曉玲,惠蕓華,楊 橋*
(中國水產(chǎn)科學(xué)研究院東海水產(chǎn)研究所,農(nóng)業(yè)部水產(chǎn)品質(zhì)量監(jiān)督檢驗(yàn)測(cè)試中心,上海 200090)
微生物發(fā)酵產(chǎn)大豆異黃酮苷元的連續(xù)超聲波提取工藝及其定量分析研究
張曉玲,惠蕓華,楊 橋*
(中國水產(chǎn)科學(xué)研究院東海水產(chǎn)研究所,農(nóng)業(yè)部水產(chǎn)品質(zhì)量監(jiān)督檢驗(yàn)測(cè)試中心,上海 200090)
選取淺玫瑰鏈霉菌、紅色糖多孢菌及黑曲霉為發(fā)酵菌種,采用Plackett-Burman設(shè)計(jì)及正交試驗(yàn),對(duì)影響微生物發(fā)酵法產(chǎn)大豆異黃酮苷元(染料木黃酮、黃豆苷元、黃豆黃素)的連續(xù)超聲波提取工藝的主要試驗(yàn)因素進(jìn)行系統(tǒng)優(yōu)化。以淺玫瑰鏈霉菌為發(fā)酵菌種的實(shí)驗(yàn)結(jié)果表明:各主要試驗(yàn)因素對(duì)3種異黃酮苷元提取率影響程度大小為:抽提溶劑組分、超聲波時(shí)間、淋洗液體積。而溫度、溶劑流速兩個(gè)因素與提取效率負(fù)相關(guān)。連續(xù)超聲波作用時(shí)間及抽提溶劑組分為影響異黃酮苷元提取工藝的兩個(gè)主要影響因素。當(dāng)兩因素的最優(yōu)值分別為7min及70%時(shí),總異黃酮苷元提取率為(98.7±1.23)%。通過固相萃取(SPE)可有效去除發(fā)酵提取液中雜質(zhì)對(duì)HPLC定量分析的干擾,并使3種異黃酮苷元含量濃縮10倍以上,從而使HPLC方法的檢測(cè)限達(dá)到10-3μg/mL,樣品總分析時(shí)間小于10min,樣品回收率為96.2%~103.4%,RSD值小于2.34%。上述結(jié)果表明,該方法可滿足微生物發(fā)酵法產(chǎn)大豆異黃酮苷元的高效提取純化及快速定量分析。
大豆異黃酮苷元;連續(xù)超聲波提取;固相萃取;微生物發(fā)酵
大豆異黃酮(isoflavones)具有弱雌激素活性、抗氧化、抗衰老,預(yù)防癌癥、老年癡呆癥及心血管疾病、改善骨質(zhì)疏松及婦女更年期綜合癥等多重功效,已在食品、保健品、醫(yī)藥等行業(yè)得到廣泛應(yīng)用[1-4]。而游離型苷元(aglycon)是大豆異黃酮中生物活性及人體生物利用度最高、疾病預(yù)防及治療功效的最有效形式(圖1)。目前,豆科植物仍是提取大豆異黃酮的主要材料來源。但其中的苷元異黃酮含量低(僅占總含量的1%~2%),不能滿足當(dāng)前日益增長的巨大市場(chǎng)需求[5]。與化學(xué)合成法及提取法相比,通過微生物發(fā)酵法生產(chǎn)苷元異黃酮,可顯著降低生產(chǎn)成本、大幅度提高產(chǎn)量的同時(shí),實(shí)現(xiàn)苷元異黃酮的直接生產(chǎn)[5-6],并可通過高產(chǎn)菌株的選育及發(fā)酵調(diào)控技術(shù)進(jìn)一步提高產(chǎn)量,并可通過基因工程實(shí)現(xiàn)苷元異黃酮的異源高表達(dá)。上述優(yōu)點(diǎn)使微生物發(fā)酵法展現(xiàn)出了廣闊的工業(yè)應(yīng)用前景[6-8]。
目前,發(fā)酵產(chǎn)異黃酮苷元的微生物菌株主要包括:淺玫瑰鏈霉菌、紅色糖多孢菌、黑曲霉、根霉、乳酸桿菌等[5-11],而目前國內(nèi)外鮮有微生物發(fā)酵法產(chǎn)異黃酮苷元高效快速提取及定量分析方面的報(bào)道。本實(shí)驗(yàn)優(yōu)化了異黃酮苷元的連續(xù)超聲波提取工藝條件,并應(yīng)用于3種常用的異黃酮苷元產(chǎn)生菌株發(fā)酵,使用固相萃取技術(shù)(solid phase extraction,SPE),在高效富集目的產(chǎn)物的同時(shí),有效消除了微生物發(fā)酵提取液中雜質(zhì)對(duì)異黃酮苷元HPLC定量分析的干擾。該方法準(zhǔn)確、高效且易于實(shí)現(xiàn)自動(dòng)化。可為異黃酮苷元工業(yè)化微生物發(fā)酵生產(chǎn)的高效提取及分析提供有益參考。
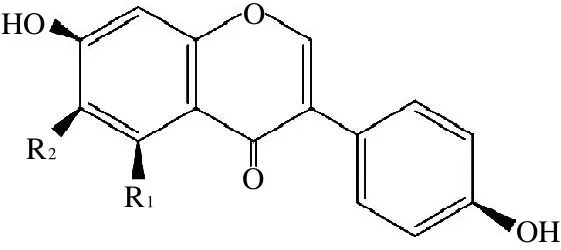
圖1 3種大豆異黃酮苷元的化學(xué)結(jié)構(gòu)示意圖Fig.1 Chemical structures of three isoflavone aglycones
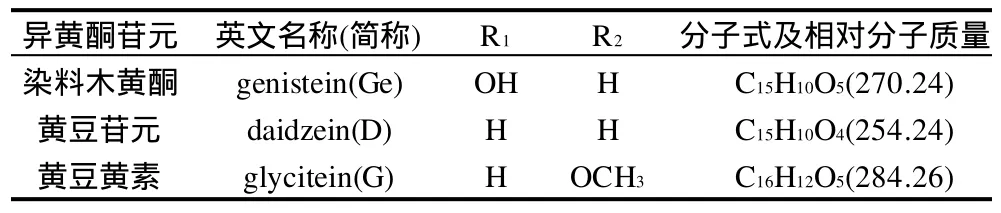
表1 異黃酮苷元標(biāo)準(zhǔn)品的分子式及相對(duì)分子質(zhì)量Table 1 Formula and relative molecular weights of three isoflavone aglycones
1 材料與方法
1.1 材料與試劑
異黃酮苷元標(biāo)準(zhǔn)品:染料木黃酮(genistein,Ge)、黃豆苷元(daidzein,D)及黃豆黃素(glycitein,G)(純度>99%) 美國Sigma公司。
乙腈、乙醇(色譜純) 美國Fisher公司;醋酸(分析純) 國藥集團(tuán)(上海)化學(xué)試劑公司;純水由美國Milli-Q純化系統(tǒng)制備;ODS RP-C18固相萃取(SPE)小柱(100mm×1.0mm) 美國Alltech公司。
1.2 微生物菌株及培養(yǎng)基
異黃酮苷元微生物發(fā)酵菌株:淺玫瑰鏈霉菌(Streptomyces roseolus ATCC 31047)及紅色糖多孢菌(Saccharopolyspora erythraea ATCC 11635)均購自美國典型培養(yǎng)物保藏中心(ATCC),黑曲霉(Asperillus niger NRRL-3122)購自美國農(nóng)業(yè)研究菌種保藏中心(NRRL)。
發(fā)酵培養(yǎng)基:胰蛋白胨大豆肉湯培養(yǎng)基(TSB)購自美國Difco公司,其他培養(yǎng)基購自英國Oxide公司。
1.3 儀器與設(shè)備
Agilent 1100高效液相色譜儀購于美國Agilent公司,配置以下組件:高壓四元梯度泵、真空在線脫氣機(jī)、定量進(jìn)樣六通閥(20μL)、二極管陣列紫外-可見檢測(cè)器(DAD)。由工作站ChemStation軟件(Version 10.0.2)控制各組件的運(yùn)行及進(jìn)行數(shù)據(jù)分析。
1.4 方法
1.4.1 菌株培養(yǎng)與發(fā)酵
淺玫瑰鏈霉菌(ATCC 31047)的固態(tài)發(fā)酵培養(yǎng)參照文獻(xiàn)[12]進(jìn)行。黑曲霉(NRRL-3122)的固態(tài)發(fā)酵培養(yǎng)參照文獻(xiàn)[10,13]進(jìn)行。紅色糖多孢菌(ATCC 11635)的搖瓶發(fā)酵培養(yǎng)參照文獻(xiàn)[14]進(jìn)行。
1.4.2 連續(xù)超聲波提取及SPE除雜濃縮
取適量發(fā)酵基質(zhì)或發(fā)酵液,置于超聲波提取腔內(nèi)。按體積比1:5或固液比1:6(m/V)加入70%乙醇溶液,關(guān)閉工作回路后開啟超聲波系統(tǒng)。參數(shù)設(shè)定如下:超聲波功率:500W,提取溶劑循環(huán)速度:5.0mL/min,提取時(shí)間7min,溫度50℃,超聲波探針頂端距提取溶劑液面1.0mm。溶劑流向每8s改變一次。
超聲波探針連續(xù)提取完成后,由PPP蠕動(dòng)泵驅(qū)動(dòng),吸取500μL提取物,經(jīng)0.45μm過濾器過濾后,以4.0mL/min 速度注入SPE小柱(柱徑1.0mm)內(nèi)后,加入100μL 75%乙醇溶液進(jìn)行洗提,淋洗液使用1.5mL EP管收集。取20μL進(jìn)樣進(jìn)行HPLC分析。
1.4.3 標(biāo)準(zhǔn)曲線的構(gòu)建
準(zhǔn)確稱取各標(biāo)準(zhǔn)品5.0mg,用10mL甲醇溶解后轉(zhuǎn)移到50mL容量瓶中,加水定容至50mL,即得到0.1mg/mL標(biāo)準(zhǔn)溶液。分別準(zhǔn)確吸取該標(biāo)準(zhǔn)液使用甲醇進(jìn)行稀釋,配制不同濃度的標(biāo)準(zhǔn)工作溶液。以空白溶劑作對(duì)照。取20μL進(jìn)樣,進(jìn)行HPLC定量分析。以峰面積(y)及異黃酮苷元濃度(x)進(jìn)行線性回歸分析。染料木黃酮(Ge):y=18524x+22356.2(R2=0.9996),線性范圍為0.17~2.38μg/mL;黃豆苷元(D):y=33254x+42558.4(R2=0.9998),線性范圍為0.14~1.58μg/mL;黃豆黃素(G):y=38544x+33251.8(R2= 0.9995),線性范圍為0.11~3.56μg/mL。
1.4.4 HPLC定量分析條件
美國Agilent 1100高效液相色譜儀。色譜柱:Agilent XDB ODS RP-C18(250mm×4.6mm,5μm)分析柱;流動(dòng)相A:水;流動(dòng)相B:含0.05%醋酸的乙腈;洗脫梯度:0~10min:流動(dòng)相B體積分?jǐn)?shù)從10%上升到50%;流速:1.0mL/min;柱溫:30℃;檢測(cè)波長:254nm。進(jìn)樣量:20μL。使用Agilent ChemStation 3D色譜工作站(Version 10.0.07)進(jìn)行儀器控制和數(shù)據(jù)分析。HPLC定量分析根據(jù)標(biāo)準(zhǔn)品保留時(shí)間(tm)及DAD檢測(cè)器收集的被分析物質(zhì)的紫外-可見(UV-Vis)吸收光譜數(shù)據(jù)確定樣品中的組分,以峰面積定量。以回收率計(jì)算總異黃酮苷元的提取率。
1.5 實(shí)驗(yàn)設(shè)計(jì)及數(shù)據(jù)分析
實(shí)驗(yàn)設(shè)計(jì)、數(shù)據(jù)分析及模型建立均使用Design-Expert 7.0軟件完成。
2 結(jié)果與分析
以淺玫瑰鏈霉菌為發(fā)酵菌種,對(duì)其發(fā)酵產(chǎn)大豆異黃酮苷元的連續(xù)超聲波提取工藝進(jìn)行系統(tǒng)研究。
2.1 確定樣品除雜及色譜分析條件

圖2 微生物發(fā)酵提取物的HPLC檢測(cè)圖譜(254nm)Fig.2 Representative HPLC chromatograms of genistein, daidzein and glycitein in ethanol extract with and without SPE pretreatment (254nm)
微生物發(fā)酵液中含有多種雜質(zhì),干擾HPLC對(duì)目的分析物質(zhì)的色譜分離及定量分析。因此,要實(shí)現(xiàn)目的分析物質(zhì)的快速分析,必須對(duì)發(fā)酵提取液進(jìn)行除雜處理,同時(shí)對(duì)影響HPLC分離條件的因素進(jìn)行優(yōu)化。首先對(duì)影響SPE及HPLC諸因素進(jìn)行系統(tǒng)優(yōu)化。結(jié)果表明,固定色譜分析柱類型,在乙腈中加入體積分?jǐn)?shù)0.05%乙酸調(diào)節(jié)流動(dòng)相的pH值后進(jìn)行梯度洗脫,發(fā)酵提取物樣品在10min內(nèi)即可達(dá)到基線分離且峰形較好。樣品前處理中使用ODS RP-C18SPE小柱可有效去除大多數(shù)干擾物質(zhì),且對(duì)染料木黃酮、黃豆苷元及黃豆黃素的濃縮倍數(shù)分別為13.7倍、11.5倍及10.8倍(圖2)。使HPLC方法的檢測(cè)限達(dá)到10-3μg/mL水平。樣品回收率為96.2%~103.4%,RSD值小于2.34%。
2.2 通過Plackett-Burman(PB)設(shè)計(jì)篩選顯著影響因素
根據(jù)預(yù)實(shí)驗(yàn)結(jié)果,影響連續(xù)超聲波提取主要因素有5個(gè),分別為抽提溶劑組分、抽提溶劑流速、連續(xù)超聲波時(shí)間、溫度、淋洗液體積。5個(gè)變量的高低取值及優(yōu)化值見表2。本實(shí)驗(yàn)采用五因素三水平正交試驗(yàn)PB設(shè)計(jì),研究上述5個(gè)因素對(duì)總異黃酮苷元提取率的影響。根據(jù)其統(tǒng)計(jì)結(jié)果,生成標(biāo)準(zhǔn)Pareto表(圖3)。各因素對(duì)3種異黃酮苷元提取效率的影響程度由大到小順序?yàn)椋撼樘崛軇w積分?jǐn)?shù)、超聲波時(shí)間、淋洗液體積。而溫度、溶劑流速兩個(gè)因素與提取率負(fù)相關(guān)。5個(gè)試驗(yàn)因素水平中,超聲波作用時(shí)間及抽提溶劑體積分?jǐn)?shù)兩個(gè)因素超過統(tǒng)計(jì)學(xué)顯著性的95%,為統(tǒng)計(jì)學(xué)顯著變量。

表2 Plackett-Burman設(shè)計(jì)的各因素Table 2 Factor and levels of Plackett-Burman design

圖3 PB設(shè)計(jì)中影響連續(xù)超聲波提取各因素的標(biāo)準(zhǔn)Pareto表Fig.3 Standard Pareto chart for Plackett-Burman design
2.3 通過最佳爬坡試驗(yàn)接近重要因子的最優(yōu)水平
根據(jù)2.2節(jié)結(jié)果,以連續(xù)超聲波作用時(shí)間及抽提溶劑體積分?jǐn)?shù)為重要因素設(shè)計(jì)最佳爬坡試驗(yàn),試驗(yàn)設(shè)計(jì)及結(jié)果如表3所示。根據(jù)試驗(yàn)因素初篩結(jié)果,超聲波提取時(shí)間及提取溶劑體積分?jǐn)?shù)對(duì)于總異黃酮苷元提取率均呈正向作用,即提取率的高低隨超聲波作用時(shí)間及抽提溶劑體積分?jǐn)?shù)的增高而提高。從表3可以看出,第4組試驗(yàn)的總異黃酮苷元提取率最高,其后提取率呈下降趨勢(shì),表示最優(yōu)點(diǎn)在第4組附近。

表3 最陡爬坡試驗(yàn)設(shè)計(jì)及結(jié)果Table 3 Scheme and results of steepest ascent design
2.4 應(yīng)用Box-Bohnken中心組合試驗(yàn)確定重要因素的最優(yōu)水平
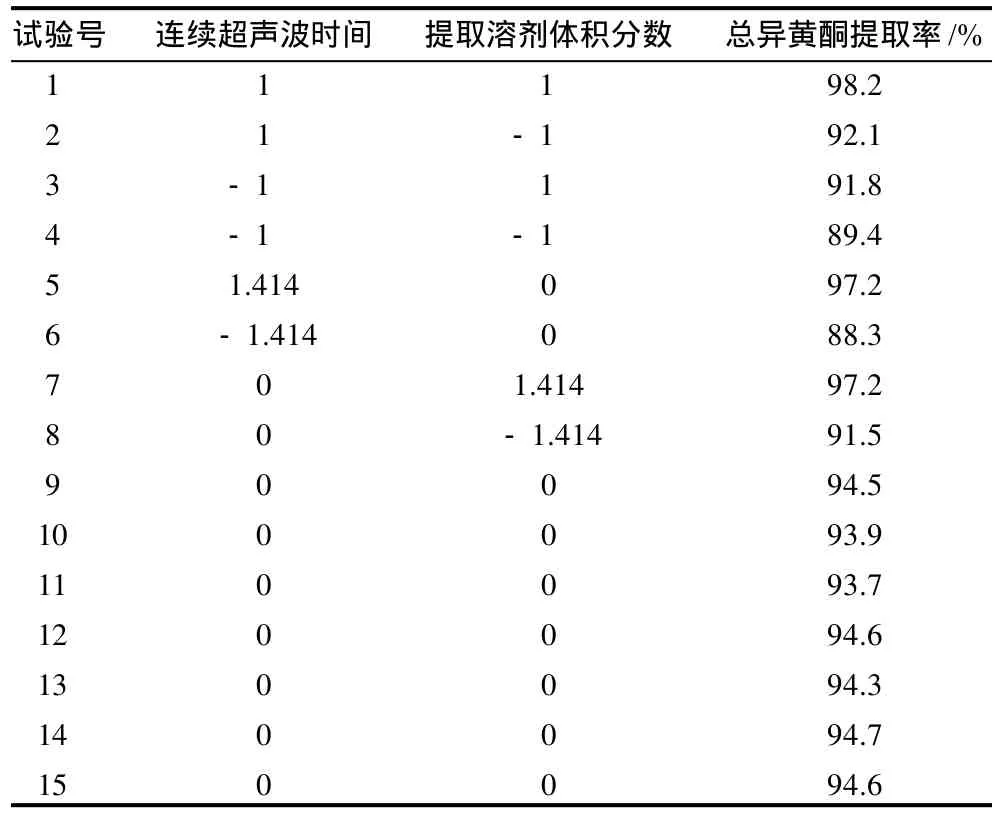
表4 中心組合設(shè)計(jì)試驗(yàn)及結(jié)果Table 4 Scheme and results of central composite design
以最佳爬坡試驗(yàn)的最優(yōu)組第4組為中心,采用二次回歸中心組合設(shè)計(jì),進(jìn)一步考察連續(xù)超聲波作用時(shí)間及抽提溶劑體積分?jǐn)?shù)兩個(gè)因素對(duì)總異黃酮苷元提取率的響應(yīng)。試驗(yàn)設(shè)計(jì)及結(jié)果如表4所示。
利用Design- Expert 6.0軟件對(duì)Plackett Burman試驗(yàn)結(jié)果進(jìn)行分析,擬合的二次方程模型為:Y=12.22-1.83X1-0.98X2+ 2.34X1X2-1.236X12-1.098X22。回歸模型使用F檢驗(yàn)結(jié)果見表5。回歸方程系數(shù)顯著性檢驗(yàn)結(jié)果見表6。由二次方程方差分析得F=32.68,決定系數(shù)R2值為0.9678,R2Adj值為0.9925。說明該模型在α=0.01水平上具有顯著性,且96.78%的總異黃酮苷元回收率可使用此模型解釋。且實(shí)測(cè)值和預(yù)測(cè)值之間也具有很好的相關(guān)性。

表5 二次多項(xiàng)式回歸方程模型變量分析表Table 5 Variance analysis for the developed quadratic polynomial regression model
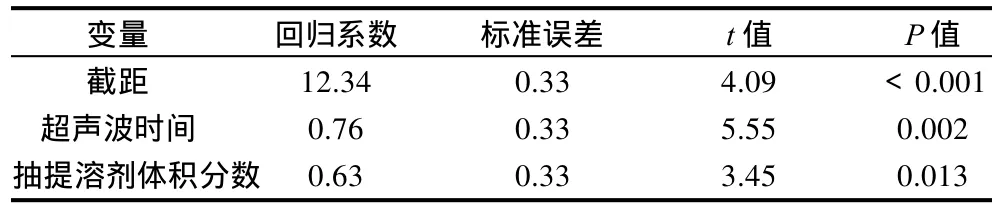
表6 回歸方程系數(shù)顯著性檢驗(yàn)表Table 6 Partial regression coefficients of the developed regression model and their significance
2.5 模型的驗(yàn)證
為確定所建立的實(shí)驗(yàn)?zāi)P团c實(shí)際結(jié)果的相符性,通過進(jìn)一步實(shí)驗(yàn)對(duì)模型可靠性進(jìn)行了驗(yàn)證。對(duì)擬合的二次方程求導(dǎo)得到該模型的極值點(diǎn),即連續(xù)超聲波作用時(shí)間為7.2min,抽提溶劑為72.3%乙醇溶液時(shí),預(yù)測(cè)的最高總異黃酮苷元提取率為98.1%。為實(shí)驗(yàn)方便起見,在驗(yàn)證實(shí)驗(yàn)中取連續(xù)超聲波作用時(shí)間為7min,抽提溶劑為70%乙醇溶液。使用該組優(yōu)化值進(jìn)行3次平行重復(fù)實(shí)驗(yàn),得到總異黃酮苷元平均提取率為(98.7±1.23)%。該值與預(yù)測(cè)值98.1%之間呈現(xiàn)良好擬合性,證實(shí)了該模型的有效性。
把該方法應(yīng)用于紅色糖多孢菌及黑曲霉發(fā)酵產(chǎn)大豆異黃酮苷元的提取及定量分析中。結(jié)果表明,對(duì)于紅色糖多孢菌及黑曲霉,擬合的二次方程模型分別為:Y=4.34-2.66X1-1.13X2+3.22X1X2-2.124X12-0.7787X22和Y = 4.87+2.12X1-2.45X2-0.23X1X2-1.652X12-1.0981X22。根據(jù)試驗(yàn)?zāi)P退每偖慄S酮苷元提取率的預(yù)測(cè)值分別為95.3%及98.7%。選取同樣的超聲波時(shí)間及抽提溶劑組分條件,進(jìn)行3次平行重復(fù)實(shí)驗(yàn),得其總異黃酮苷元提取率分別為(96.3±2.32)%和(98.7±2.17)%,與各自預(yù)測(cè)值之間均呈現(xiàn)良好擬合性。本方法為利用微生物發(fā)酵產(chǎn)異黃酮苷元的高效提取及分析提供了一個(gè)較適宜的實(shí)驗(yàn)?zāi)P汀?/p>
3 結(jié) 論
連續(xù)超聲波作用時(shí)間及抽提溶劑體積分?jǐn)?shù)為影響微生物發(fā)酵產(chǎn)異黃酮苷元連續(xù)超聲波提取工藝的兩個(gè)主要影響因素。兩因素的優(yōu)化值分別為7min及70%乙醇溶液時(shí),實(shí)驗(yàn)所得的總異黃酮苷元提取率為(98.7±1.23)%。
在樣品前處理過程中使用固相萃取SPE小柱,可有效去除發(fā)酵提取液中雜質(zhì)對(duì)異黃酮苷元HPLC定量分析干擾,并使3種異黃酮苷元含量濃縮10倍以上。
[1] MESSINA M. A brief historical overview of the past two decades of soy and isoflavone research[J]. J Nutr, 2010, 140(7): 1350S-1354S.
[2] GILBERT E R, LIU D. Flavonoids influence epigenetic-modifying enzyme activity: structure-function relationships and the therapeutic potential for cancer[J]. Curr Med Chem, 2010, 17(17): 1756-1768.
[3] LARKIN T, PRICE W E, ASTHEIMER L. The key importance of soy isoflavone bioavailability to understanding health benefits[J]. Crit Rev Food Sci Nutr, 2008, 48(6): 538-552.
[4] PHAM T T, SHAH N P. Skim milk powder supplementation affects lactose utilization, microbial survival and biotransformation of isoflavone glycosides to isoflavone aglycones in soymilk by Lactobacillus[J]. Food Microbiol, 2008, 25(5): 653-661.
[5] 井樂剛, 張永忠. 微生物發(fā)酵制備大豆異黃酮的研究進(jìn)展[J]. 微生物學(xué)通報(bào), 2003, 30(2): 86-88.
[6] 張靜, 田平芳, 葛喜珍, 等. 淡豆豉、黃大豆及黑大豆中異黃酮苷元的提取與含量比較[J]. 食品科學(xué), 2008, 29(4): 214-217.
[7] PHAM T T, SHAH N P. Effects of lactulose supplementation on the growth of bifidobacteria and biotransformation of isoflavone glycosides to isoflavone aglycones in soymilk[J]. J Agric Food Chem, 2008, 56(12): 4703-4709.
[8] PHAM TT, SHAH N P. Effect of lactulose on biotransformation of isoflavone glycosides to aglycones in soymilk by lactobacilli[J]. J Food Sci, 2008, 73(3): M158-M165.
[9] 蔣大海, 田娟娟, 白志明. 固態(tài)發(fā)酵法制備大豆異黃酮苷元[J]. 食品科學(xué), 2008, 29(4): 163-166.
[10] 毛跟年, 李彥軍, 張俊濤, 等. 黑曲霉發(fā)酵法制備大豆異黃酮苷元工藝初探[J]. 食品工業(yè)科技, 2006, 27(11): 129-131.
[11] 齊斌, 劉賢金. 產(chǎn)大豆異黃酮β-葡萄糖苷酶菌株的篩選及酶學(xué)性質(zhì)研究[J]. 食品科學(xué), 2007, 28(8): 290-293.
[12] WEBER J M, CONSTANTINOU A I, HESSLER P E. A Process of preparing genistein: US, 5554519[P]. 1996-09-10.
[13] UMEZAWA H, TOBE H, SHIBAMOTO N, et al. Isolation of isoflavones inhibiting dopa decarboxylase from fungi and streptomyces[J]. J Antibiotics, 1975, 28(12): 947-952.
[14] HESSLER P E, LARSEN P E, CONSTANTINOU A I. Isolation of isoflavones from soy-based fermentations of the erythromycin-producing bacterium Saccharopolyspora erythraea[J]. Appl Microbiol Biotechnol,1997, 47(4): 398-404.
Continuous Ultrasonic Extraction and Quantitative Analysis of Isoflavone Aglycones Produced by Microbial Fermentation
ZHANG Xiao-ling,HUI Yun-hua,YANG Qiao*
(Supervision and Test Center for Aquatic Products of Ministry of Agriculture, East China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences, Shanghai 200090, China)
The aim of the present study was to optimize the continuous ultrasonic extraction process for isoflavone aglycones including genistein, daidzein and glycitein produced by Streptomyces roseolus (ATCC 31047) based on Plackett-Burman design and orthogonal array design. Results indicated that the order of three positive factors affecting extraction efficiency from strong to weak was solvent composition (ethanol aqueous solution), ultrasonic treatment time and eluent volume. However,extraction temperature and eluent flow rate exhibited a negative impact on extraction efficiency. Ultrasonic treatment time of 7 min and solvent composition of 70% ethanol concentration were found optimal, and the extraction rate of total isoflavone aglycones reached up to (98.7 ± 1.23)% under the optimal conditions. The application of solid-phase extraction (SPE) could effectively reduce the interference of impurity substances during the quantitative analysis of the above three isoflavone aglycones so that the detection limit of the developed SPE-HPLC method could reach 10-3μg/mL. The detection procedure was less than 10 min and the recovery rate was between 96.2% and 103.4% with a RSD of less than 2.34%. Therefore, this method can meet the requirements for high-efficiency extraction and rapid quantitative analysis of isoflavone aglycones produced by microbial fermentation.
isoflavone aglycones;continuous ultrasonic extraction;solid-phase extraction;microbial fermentation
TS201.2
A
1002-6630(2011)05-0239-05
2010-09-25
中央公益性科研院所基本科研業(yè)務(wù)費(fèi)專項(xiàng)資金資助項(xiàng)目(2008M17);上海市自然科學(xué)基金項(xiàng)目(11ZR1450000)
張曉玲(1978—),女,助理研究員,博士,主要從事食品安全控制研究。E-mail:nyyqxl@126.com
*通信作者:楊橋(1979—),男,副研究員,博士,主要從事微生物天然產(chǎn)物與藥物研究。E-mail:qyang@mail.whu.edu.cn
- 食品科學(xué)的其它文章
- Effects of Acrylamide Inhibition by Asparaginase and Sugar Substitution on Cookie Dough Rheology and Baking Attributes
- 家蠶蛹油對(duì)大鼠肝臟脂質(zhì)代謝及相關(guān)酶活性的影響
- 重慶產(chǎn)木菠菜的營養(yǎng)成分及營養(yǎng)價(jià)值評(píng)價(jià)
- 雞CAPN1基因多態(tài)性及其與肉質(zhì)性狀的關(guān)聯(lián)分析
- 棉稈稀酸水解及微生物共發(fā)酵生產(chǎn)單細(xì)胞蛋白工藝優(yōu)化研究
- 蜂膠和鐵補(bǔ)充對(duì)運(yùn)動(dòng)大鼠血液鐵狀態(tài)的影響及蜂膠的抗氧化保護(hù)作用

