DNA染料結(jié)合環(huán)介導(dǎo)等溫?cái)U(kuò)增技術(shù)檢測(cè)志賀氏菌死活細(xì)胞
李 月,王 麗,孫遠(yuǎn)明,鐘青萍
(華南農(nóng)業(yè)大學(xué)食品學(xué)院,廣東廣州 510640)
DNA染料結(jié)合環(huán)介導(dǎo)等溫?cái)U(kuò)增技術(shù)檢測(cè)志賀氏菌死活細(xì)胞
李 月,王 麗,孫遠(yuǎn)明,鐘青萍*
(華南農(nóng)業(yè)大學(xué)食品學(xué)院,廣東廣州 510640)
建立了一種DNA染料(EMA)結(jié)合環(huán)介導(dǎo)等溫?cái)U(kuò)增技術(shù)(Loop-mediated isothermal amplification,LAMP)的分析方法(EMA-LAMP),用于有效檢測(cè)區(qū)分病原微生物志賀氏菌的死活細(xì)胞。基于志賀氏菌ipaH基因的六個(gè)區(qū)域設(shè)計(jì)特異性的引物,檢測(cè)志賀氏菌的死活細(xì)胞。結(jié)果表明:濃度為40μg/mL的EMA能夠有效抑制109CFU/mL的死細(xì)胞擴(kuò)增,而對(duì)相同濃度的活菌擴(kuò)增沒有影響。分析表明,該方法可以有效區(qū)分細(xì)菌的死活細(xì)胞,克服了傳統(tǒng)PCR無法區(qū)分死活細(xì)胞的弊端,同時(shí)EMA-LAMP檢測(cè)方法耗時(shí)短,檢測(cè)靈敏度高,是一種能夠有效鑒別病原菌死活細(xì)胞的新方法。
ethidium monoazide,環(huán)介導(dǎo)等溫?cái)U(kuò)增技術(shù)(LAMP),Shigella,死活細(xì)胞
志賀氏菌(Shigella)是引起細(xì)菌性痢疾最為常見的致病菌,食源性志賀氏菌中毒的最主要原因是從事食品加工行業(yè)的人員患痢疾或帶菌者污染食品,食品接觸人員個(gè)人衛(wèi)生差,存放已污染的食品,儲(chǔ)存條件不當(dāng)?shù)龋?]。志賀氏菌屬在我國感染性腹瀉病原菌中居首位,人類對(duì)志賀氏菌有很高的易感性,103~104CFU/m L細(xì)菌可致病,在幼兒中可引起急性中毒性菌痢,死亡率很高[2]。目前國內(nèi)外對(duì)于志賀氏菌的檢測(cè)方法主要采用傳統(tǒng)的分離鑒定方法,分子生物學(xué)方法如PCR以及免疫學(xué)方法等。傳統(tǒng)的微生物培養(yǎng)方法不僅耗時(shí)長,而且檢測(cè)的靈敏度不高;自聚合酶鏈?zhǔn)椒磻?yīng)(PCR)技術(shù)問世以來,PCR技術(shù)在檢測(cè)食源性致病菌方面得到了廣泛的應(yīng)用。PCR技術(shù)結(jié)合其他技術(shù)又衍生出許多PCR改良技術(shù),如熒光定量PCR、即時(shí)PCR等,這些技術(shù)在檢測(cè)食源性致病菌方面,不僅耗時(shí)短,而且檢測(cè)的靈敏度高[3-4]。環(huán)介導(dǎo)等溫?cái)U(kuò)增技術(shù)(Loop-mediated isothermal amp lification,簡稱LAMP)是一種新的核酸擴(kuò)增方法,其特點(diǎn)是在恒溫條件下保溫十幾分鐘,即可完成核酸擴(kuò)增反應(yīng),能夠在1h之內(nèi),將目的DNA片段擴(kuò)增109~ 1010倍[5]。Ethidium monozaide(EMA) 是 一 種DNA結(jié)合染料,能夠滲透到細(xì)胞壁(膜)不完整的菌體內(nèi),在光激活的條件下,易形成氮賓化合物與DNA或其他分子共價(jià)結(jié)合[6-7],從而抑制死細(xì)胞DNA的擴(kuò)增,而對(duì)活細(xì)胞的DNA不起作用。本實(shí)驗(yàn)通過EMA的選擇滲透性與LAMP檢測(cè)技術(shù)相結(jié)合(EMALAMP),檢測(cè)志賀氏菌活細(xì)胞基因ipaH,有效區(qū)分志賀氏菌的死/活細(xì)胞。

表1 EMA-LAMP反應(yīng)引物序列
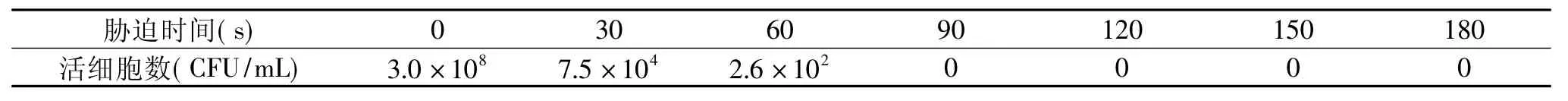
表2 脅迫條件對(duì)志賀氏菌的影響
1 材料與方法
1.1 實(shí)驗(yàn)材料
實(shí)驗(yàn)菌株 購自中國普通微生物菌種保藏中心,菌株編號(hào)為1.1869;引物 上海英俊生物技術(shù)公司合成;Ethidium Monoazide,Betaine 美國 Sigma公司;Bst DNA聚合酶 BioLabs公司。
1.2 實(shí)驗(yàn)方法
1.2.1 志賀氏菌的培養(yǎng)條件 接種志賀氏菌到滅菌Luria-Bertani(LB)肉湯培養(yǎng)基中(1%胰蛋白胨、0.5%酵母粉、1%NaCl,pH7.5),搖床培養(yǎng)過夜(37℃,120 r/m in),使用涂布平板法檢測(cè)志賀氏菌可培養(yǎng)數(shù)為1.0×109CFU/m L。
1.2.2 脅迫條件 取1m L上述菌懸液于1.5m L的離心管中,按每隔15s放入3個(gè)管,分別置于95℃水浴鍋加熱處理,涂布營養(yǎng)瓊脂平板,37℃培養(yǎng)24h后觀察計(jì)數(shù)[8]。
1.2.3 EMA處理志賀氏菌活/死細(xì)胞 取志賀氏菌活/死細(xì)胞各1m L(1.0×109CFU/m L)置于無菌離心管中,分別加入不同濃度的EMA,并置于黑暗中常溫放置5min,然后將離心管放置在冰上,用650W鹵素?zé)羝毓?10m in[9]。
1.2.4 志賀氏菌DNA制備 取細(xì)菌培養(yǎng)物1m L于12000r/min離心5min,棄上清并收集菌體,加入1m L細(xì)胞裂解液(2%Triton X-100,2.5mg/m L疊氮化鈉,溶解在0.1mol/L Tris-HCl中,pH8.0),將沉淀充分混勻后,于100℃沸水浴10min,冰上放置5min,12000r/min離心5m in,上清即為 DNA模板,-20℃保存?zhèn)溆茫?0],實(shí)驗(yàn)中陰性對(duì)照采用滅菌的去離子水代替上清作為EMA-LAMP反應(yīng)的模板。
1.2.5 EMA-LAMP反應(yīng)體系 LAMP反應(yīng)需要四條引物,包括兩條外引物(F3和B3)和兩條內(nèi)引物(FIP和BIP)。它們能夠特異結(jié)合靶序列上的6個(gè)區(qū)域,選取GenBank發(fā)布的志賀氏菌攜帶的ipaH基因序列,在序列1075~1268bp設(shè)計(jì)LAMP反應(yīng)的引物,見表1。EMA-LAMP反應(yīng)體系為 10×Thermopol reaction buffer,1.6mmol/L dNTP,5mol/L betaine,6mmol/L MgSO4,Bst DNA聚合酶及內(nèi)外引物,反應(yīng)體系的體積為25μL。反應(yīng)條件為65℃ 45min,80℃2m in,終止反應(yīng)。反應(yīng)結(jié)果通過2%的凝膠電泳檢測(cè),電壓75V,電泳時(shí)間45m in,如果為陽性反應(yīng),則產(chǎn)生典型的階梯狀條帶,如果為陰性反應(yīng),則無條帶產(chǎn)生[11-12]。
1.2.6 不同EMA濃度處理志賀氏菌活/死細(xì)胞 取不同濃度的志賀氏菌活/死細(xì)胞各 1m L(1.0×109CFU/m L)置于無菌離心管中,分別加入不同濃度的EMA并置于黑暗中常溫放置5min,然后將離心管放置在冰上,用650W鹵素?zé)羝毓?0m in,按照1.2.4方法提取菌體DNA,作為LAMP反應(yīng)的DNA模板進(jìn)行 LAMP擴(kuò)增和電泳分析[13]。
1.2.7 EMA處理不同活細(xì)胞比例志賀氏菌菌懸液
將上述菌懸液配制含有一定比例活細(xì)胞菌懸液混合體系,配制完成后,使體系中活細(xì)胞的數(shù)量分別為:1.0 ×106、1.0 × 105、1.0 × 104、1.0 × 103、1.0 × 102、1.0×101、1.0CFU/m L,向體系中加入40μg/m L(終濃度)EMA,置于黑暗中常溫放置5min,然后將離心管放置在冰上,用650W鹵素?zé)羝毓?0min,按照1.2.4方法提取菌體DNA,作為LAMP反應(yīng)的DNA模板進(jìn)行LAMP 擴(kuò)增和電泳分析[12]。
1.2.8 優(yōu)化曝光時(shí)間 取志賀氏菌活細(xì)胞菌懸液和死細(xì)胞菌懸液各1m L(1.0×107CFU/m L)置于無菌離心管中,加入40μg/m L(終濃度)EMA并置于黑暗中常溫放置5m in,然后將離心管放置在冰上,用650W鹵素?zé)羝毓猓x取曝光時(shí)間為1、5、10、15m in。提取菌體DNA,作為LAMP反應(yīng)的DNA模板進(jìn)行LAMP擴(kuò)增和電泳分析[13]。
2 結(jié)果與討論
2.1 脅迫條件對(duì)志賀氏菌的影響
對(duì)菌懸液熱處理的結(jié)果見表2。從表中可以看出,在95℃的條件下,熱處理時(shí)間為90s時(shí),平板菌落數(shù)為零,實(shí)驗(yàn)過程中,為了確保細(xì)菌致死率為100%,實(shí)驗(yàn)選擇脅迫條件為95℃,3m in。
2.2 不同濃度EMA對(duì)志賀氏菌活細(xì)胞菌懸液的影響
將菌液濃度為1.0×109CFU/m L的活細(xì)胞菌懸液使用EMA處理,取細(xì)胞裂解液進(jìn)行LAMP擴(kuò)增,產(chǎn)物于2%的瓊脂糖凝膠電泳分析(見圖1)。結(jié)果表明,1.0×109CFU/m L的副溶血弧菌經(jīng)過不同濃度的EMA處理后,仍然能夠擴(kuò)增出特異性的階梯狀條帶,當(dāng)EMA的濃度高達(dá)100μL/m L時(shí),擴(kuò)增出的條帶仍然比較清晰明亮,表明EMA對(duì)活菌細(xì)胞沒有影響或者影響不大。
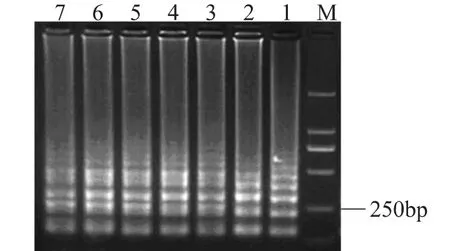
圖1 不同濃度EMA對(duì)活菌(1.0×109 CFU/mL)的影響
2.3 不同濃度EMA對(duì)志賀氏菌死細(xì)胞菌懸液的影響
將菌液濃度為1.0×109CFU/m L的活細(xì)胞菌懸液進(jìn)行熱處理(95℃,3m in),熱處理后的菌懸液使用EMA處理后,取細(xì)胞裂解液進(jìn)行LAMP擴(kuò)增,產(chǎn)物于2%的瓊脂糖凝膠電泳分析(見圖2)。從圖中可以看出,1.0×109CFU/m L熱處理的菌懸液在不使用EMA處理的情況下,能夠擴(kuò)增出特異性的階梯狀的條帶,但是隨著EMA濃度的增加,其擴(kuò)增產(chǎn)物的電泳條帶亮度逐漸減弱,當(dāng)EMA的濃度達(dá)到40μg/m L或者更高濃度時(shí),無擴(kuò)增產(chǎn)物出現(xiàn),40μg/m L EMA可以抑制1.0×109CFU/m L死細(xì)胞菌懸液DNA擴(kuò)增。
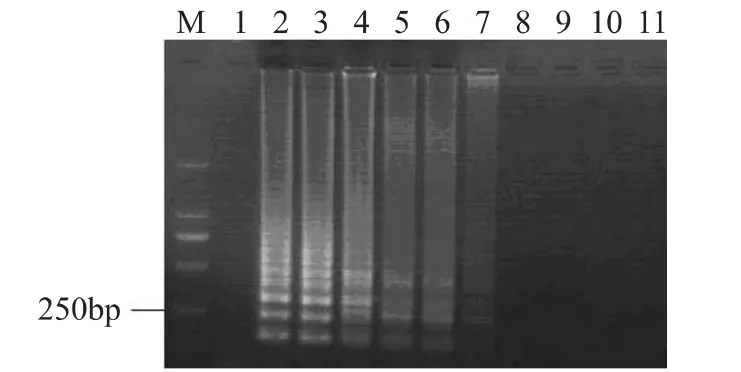
圖2 不同濃度的EMA對(duì)死菌(1.0×109 CFU/mL)的影響
2.4 EMA溶液對(duì)不同活細(xì)胞比例志賀氏菌菌懸液的影響
將含不同比例的活細(xì)胞菌懸液進(jìn)行熱處理(95℃,3m in),熱處理后的菌懸液使用EMA處理,取細(xì)胞裂解液進(jìn)行LAMP擴(kuò)增,產(chǎn)物于2%的瓊脂糖凝膠電泳分析(見圖3),從圖中可以看出,隨著活細(xì)胞數(shù)目的降低,其擴(kuò)增產(chǎn)物的電泳條帶亮度逐漸減弱,當(dāng)活細(xì)胞數(shù)目降低到10CFU/m L時(shí),EMA-LAMP沒有擴(kuò)增條帶,說明當(dāng)體系中活菌數(shù)目低于100CFU/mL,混合體系中死細(xì)胞的DNA就能夠被抑制,從而可以說明EMA-LAMP檢測(cè)細(xì)菌活/死細(xì)胞的靈敏度為100CFU/m L。
2.5 曝光時(shí)間對(duì)EMA-LAMP反應(yīng)的影響
濃度為1.0×109CFU/m L的活細(xì)胞懸液使用40μg/m L的EMA進(jìn)行處理,分別選擇曝光時(shí)間為1、5、10、15m in,EMA 處理后,用裂解法對(duì)細(xì)菌懸液細(xì)胞進(jìn)行裂解,使用裂解液作為模板進(jìn)行LAMP反應(yīng),結(jié)果如圖4所示,曝光時(shí)間從1~15m in均能擴(kuò)增出特異性的階梯狀條帶。
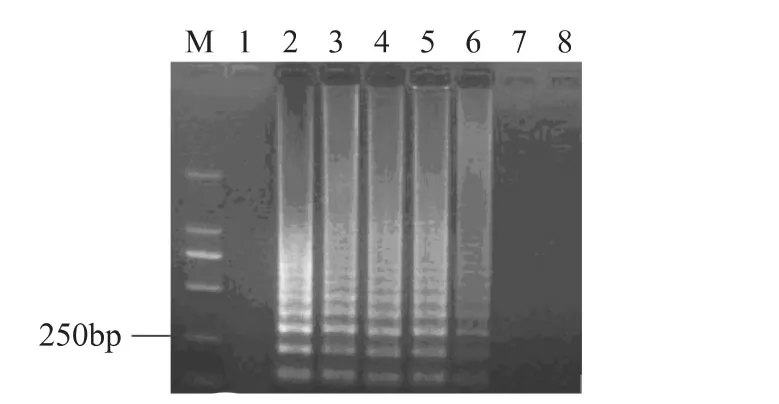
圖3 40μg/mL的EMA對(duì)不同濃度比例活細(xì)胞菌懸液的影響
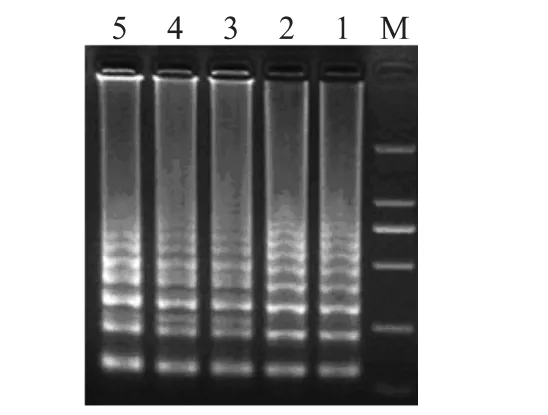
圖4 曝光時(shí)間對(duì)活菌的影響
將濃度為1.0×109CFU/m L的活菌細(xì)胞懸液使用熱處理的方法進(jìn)行滅活后,使用40μg/m L的EMA進(jìn)行處理,分別選擇曝光時(shí)間為 1、5、10、15m in,EMA處理后,用裂解法對(duì)細(xì)菌懸液細(xì)胞進(jìn)行裂解,使用裂解液作為模板進(jìn)行LAMP反應(yīng),結(jié)果如圖5所示,經(jīng)過1m in曝光處理后,可抑制1.0×109CFU/m L的死細(xì)胞DNA的擴(kuò)增。此結(jié)果與其他文獻(xiàn)報(bào)道的結(jié)果一致。綜合以上兩種結(jié)果,本實(shí)驗(yàn)選擇的曝光時(shí)間為10m in,以確保多余的EMA能夠全部被光分解,從而不影響LAMP擴(kuò)增的效果,同時(shí)花費(fèi)的時(shí)間不是太長,能夠有效地控制檢測(cè)所需要的時(shí)間。
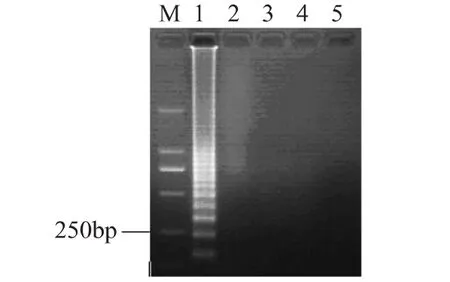
圖5 曝光時(shí)間對(duì)活菌的影響
3 討論
在國際上每年都有關(guān)于由志賀氏菌引起的食物中毒事件發(fā)生,給人類的身體健康、公共衛(wèi)生等監(jiān)控帶來了極大的挑戰(zhàn)。分子生物學(xué)方法能夠有效地檢測(cè)志賀氏菌,傳統(tǒng)的PCR技術(shù)可用于檢測(cè)包含活細(xì)胞和死細(xì)胞,因?yàn)楸M管微生物細(xì)胞失去活力,其DNA仍然存在于環(huán)境中。因此,利用PCR選擇性擴(kuò)增細(xì)菌活細(xì)胞DNA面臨著巨大挑戰(zhàn)。通過研究發(fā)現(xiàn),可以將DNA染料與PCR方法結(jié)合,進(jìn)行區(qū)分致病菌死活細(xì)胞,但是PCR方法依賴精密的溫度循環(huán)裝置,而且必須要在實(shí)驗(yàn)室進(jìn)行,因此一定程度上限制了其應(yīng)用。
LAMP方法是一種新型的DNA擴(kuò)增方法,該方法在恒溫條件下即可完成反應(yīng),沒有核酸的變復(fù)性過程,因此不需要特殊的儀器,只需要水浴鍋即可完成反應(yīng),比較適合在實(shí)驗(yàn)室之外的地點(diǎn)進(jìn)行檢測(cè),因此LAMP應(yīng)用更加廣泛。
EMA能夠滲透到細(xì)胞壁(膜)不完整的菌體內(nèi),在光激活的條件下,易形成氮賓化合物與DNA或其他分子共價(jià)結(jié)合,從而抑制死細(xì)胞DNA的擴(kuò)增,而對(duì)活細(xì)胞的DNA不起作用。利用EMA與LAMP檢測(cè)技術(shù)結(jié)合,不僅可以有效區(qū)分病原菌的活死細(xì)胞,而且可以使反應(yīng)迅速完成,反應(yīng)的靈敏度也很高,可以達(dá)到100CFU/m L。本文采用EMA-LAMP檢測(cè)方法,有效區(qū)分志賀氏菌活死細(xì)胞,實(shí)驗(yàn)證明,40μg/m L EMA足以抑制1.0×109CFU/m L死細(xì)胞菌懸液擴(kuò)增,而對(duì)活細(xì)胞菌懸液的擴(kuò)增則沒有影響,考慮到實(shí)際的病原菌的檢測(cè)中,109CFU/m L的菌液濃度已經(jīng)是非常高的含菌量,所以實(shí)驗(yàn)最終確定40μg/m L的EMA為最佳的檢測(cè)濃度。
[1]黃寶華,陳慶森,龐廣昌.志賀氏菌研究及其快速檢測(cè)技術(shù)發(fā)展現(xiàn)狀[J].食品科學(xué),2004,25(11):333-336.
[2]侯君.一起宋內(nèi)氏志賀氏菌引起的食物中毒調(diào)查[J].預(yù)防醫(yī)學(xué)文獻(xiàn)信息,2003,9(6):707.
[3]蔡亦紅.PCR快速檢測(cè)食品中志賀氏菌方法的建立[J].中國人獸共患病學(xué)報(bào),2008,24(2):150-153.
[4]胡建華,李潔莉.牛奶樣品中志賀氏菌的快速PCR檢測(cè)技術(shù)研究[J].食品科學(xué),2007,28(8):433-437.
[5]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,2000,28(12):63-70.
[6]Nocker A,Ching-Ying C,Camper A K.Comparison of propidium monoazide with ethidium monoazide for differentiation of live vs.dead bacteria by selective removal of DNA from dead cells[J].Journal of Microbiological Methods,2006,67:310-320.
[7]Walters C,Bolkan H,Luo LX,et al.Quantification of viable cells of clavibacter michiganesis subsp.Michiganensis using a DNA binging dye and a real-time PCR assy[J].Plant Pathology,2008,57:332-337.
[8]馮建軍,金志娟,劉西莉,等.一種DNA染料結(jié)合聚合酶鏈反應(yīng)檢測(cè)鑒別植物病原細(xì)菌死活細(xì)胞[J].高等學(xué)校化學(xué)學(xué)報(bào),2008,29(5):944-948.
[9]Jung-Lim L,Robert EL.Use of ethidium bromidemonoazide quantification of viable and dead mixed bacterial flora from fish fillets by polymerase chain reaction[J].Journal of Microbiological Methods,2006,67:456-462.
[10]Abolmatty A,Oliver JD,Levin RE.Development of a new lysis solution for releasing genomic DNA from bacterial cells for DNA amplification by polymerase chain reaction[J].Microbios,2000,101:181-189.
[11]Hisatoshi K,Tomohiro I,Koki A,et al.Sensitive and Rapid Detection of Herpes Simples Virus and Varicella-Zoster Virus DNA by Loop-mediated Isothermal Amplification[J].Journal of Clinical Microbiology,2005,43:3290-3296.
[12]Hayashi N,Arai R,Tada S,et al.Detection and identification of Brettanomyces/Dekkera ap.yeasts with a loop-mediated isothermal amplification method[J].Food Microbiology,2007,24(7-8):780-785.
[13]Jung-Lim L,Robert EL.Quantification of total viable bacteria on fish fillets by using ethidium bromidemonoazide realtime polymerase chain reaction[J].International Journal of Food Microbiology,2007,118:312-317.
Differentiation of the viable and dead cells of Shigella by Loop-mediated isothermal amplificaiton with a DNA binding dye
LIYue,WANG Li,SUN Yuan-ming,ZHONG Qing-ping*
(College of Food Science,South China Agricultural University,Guangzhou 510640,China)
Conventional DNA-based detection methods can be used to detect both live and dead cells.Since dead cells do not cause disease,which bring a problem in medicalor biological studies.The Loop-mediated isothermal amplification(LAMP)method combined with the ethidium monoazide(EMA)treatment was applified with viable,but not dead Shigella cells.LAMP method em ploys a DNA polymerase and a set of specially designed primers that recognize a total of six distinct sequences on the target ipaH gene conserved in Shigella.The results showed that the concentration of EMA was 40μg/m L,DNA amplification was inhibited derived from dead cellsuspensions(1.0 ×109CFU/m L),but not inhibit viable cells.These results showed that EMA-LAMP method had a potential for specific detection of viable cells,one hand,EMA had the ability to penetrate selectively through the damaged cytoplasmic membrane of dead cells and to intercalate into DNA,the gene of the dead cells could not be amplified.On the other hand,EMA-LAMP had high sensitivity and specificity.
ethidium monoazide;loop-mediated isothermal amplification;Shigella;viable-dead cell
Q789
A
1002-0306(2011)08-0216-04
2010-07-08 *通訊聯(lián)系人
李月(1982-),女,碩士研究生,主要從事分子生物學(xué)方面的研究。
廣東省農(nóng)業(yè)攻關(guān)重點(diǎn)專項(xiàng)(2009A020101004);國家自然科學(xué)基金(31000781)。

