花椒水溶性多糖的提取及其體外抗氧化活性研究
李谷才,袁立華,張 儒,李立軍
(1.湖南工程學院化學化工系,湖南湘潭 411104;
2.湖南工程學院醫院,湖南湘潭 411104;
3.湖南省益陽市赫山區婦幼保健醫院,湖南益陽 413002)
花椒水溶性多糖的提取及其體外抗氧化活性研究
李谷才1,袁立華2,張 儒1,李立軍3
(1.湖南工程學院化學化工系,湖南湘潭 411104;
2.湖南工程學院醫院,湖南湘潭 411104;
3.湖南省益陽市赫山區婦幼保健醫院,湖南益陽 413002)
通過正交實驗,對水提法提取花椒多糖工藝進行了優化。實驗結果表明,在選定的工藝條件下,各因素對花椒多糖提取率的影響順序為提取時間>提取溫度>料液比,最佳提取條件為料液比1∶20、提取溫度95℃、提取時間4h,在最佳工藝條件下測得花椒粗多糖提取率為3.49%。體外抗氧化活性實驗表明,花椒多糖能有效地清除體外Fenton反應產生的·OH,當花椒多糖濃度在2.0mg/mL以上時,對羥自由基的清除率在50%以上。
花椒,多糖,提取,抗氧化活性
花椒(Zanthoxylum Bungeagum Maxim)為蕓香科植物,原產于我國,是一種傳統的藥食兩用植物,在春秋時期就開始利用花椒的果實和嫩葉作調味品。花椒果實味辛、性溫,歸脾、胃、腎經,是一種重要的調味品;花椒果皮是香料和香精原料,種籽是優良的木本油料[1-2]。現代研究表明:花椒的化學成分主要有揮發油、生物堿、木脂素、香豆素、脂肪酸、蛋白質、氨基酸、黃酮等[3-7],對心血管系統、消化系統、免疫系統、凝血功能、鎮痛、鎮靜、抗菌抑菌等均具有較強的藥理作用[8-12]。多糖是自然界中廣泛存在于有機體中的生物聚合物。研究表明,多糖具有提高免疫力、抗腫瘤、抗病毒、抗衰老、抗感染、抗潰瘍等多種生物活性功能。多糖作為生命物質的組成成分之一,廣泛參與了細胞的生命活動以及生理過程的調節,如免疫細胞間信息的傳遞與感受、細胞的轉化、分裂及再生等活動。近年來,大量藥理及臨床研究表明,多糖類化合物具有免疫調節作用,它能激活免疫受體,提高機體的免疫功能[13]。到目前為止,已從天然產物中分離出300多種多糖類化合物,其中從植物,尤其是從中藥材中提取的多糖尤為重要[14]。目前,對花椒的研究大部分集中于種植、加工、風味物質、化學成分、藥理作用等方面,對其多糖的研究鮮有報道。本實驗采用浸泡提取法提取花椒中的多糖,同時對提取工藝進行優化,并對花椒多糖的體外抗氧化活性進行研究,為花椒多糖的開發利用提供科學依據。
1 材料與方法
1.1 材料與儀器
花椒 購于湖南湘潭市雙舟大藥房,產地為四川;濃硫酸、蒽酮、無水乙醇、水楊酸、丙酮、三氯乙酸、葡萄糖、硫酸亞鐵、過氧化氫 分析純。
WND-200型高速中藥粉粹機 浙江蘭溪市偉能達電器有限公司;標準篩 杭州市藍天化驗儀器廠;BS323S電子天平 北京賽多利斯儀器系統有限公司;85-2集熱式恒溫加熱磁力攪拌器 常州澳森電器有限公司;NH-4數顯恒溫水浴鍋 國華電器有限公司;RE-52A旋轉蒸發器 鞏義市英峪予華儀器廠;UV-2102PCS型紫外-可見分光光度計 尤尼柯(上海)儀器有限公司;TDZ5-WS多管架自動平衡離心機 賽特湘儀離心機儀器有限公司;其它實驗室常用玻璃儀器。
1.2 實驗方法
1.2.1 樣品預處理 將花椒于60℃恒溫箱中恒溫干燥24h,稱重,粉碎后回流脫脂,回流2次,每次3h,除去溶劑,殘渣進行脫色處理后干燥,置于試劑瓶中密封備用。
1.2.2 花椒中多糖的提取與蛋白質的去除 稱取適量花椒粉置于圓底燒瓶中,按一定的料液比、提取溫度、提取時間浸提三次,冷卻后過濾,合并濾液,用脫脂棉過濾后將濾液減壓濃縮至適當體積,離心(3000 r/m in,30m in),收集上清液。
向上清液中加入10%三氯乙酸,調節pH至3,在冰箱中放置過夜,離心(3000 r/m in,30min),棄去沉淀,得脫蛋白多糖溶液。
1.2.3 多糖沉淀 向去除蛋白的多糖溶液中加入三倍量的95%乙醇,置于-4℃冰箱中,醇沉24h,離心(3000 r/m in,30m in),收集固態物,依次用無水乙醇、丙酮、乙醚洗滌后于60℃干燥24h,得粗多糖固體。
1.2.4 多糖含量的測定 蒽酮-硫酸試劑的配制:準確稱取200.0mg蒽酮,溶于80%硫酸中,用80%硫酸定容于100m L容量瓶中,配成2mg/m L的蒽酮-硫酸試劑備用。
葡萄糖標準曲線的制作:準確稱取105℃干燥至恒重的葡萄糖100.0mg,用蒸餾水溶解定容于100m L容量瓶中,準確從中移取 1.0、2.0、3.0、4.0、5.0、6.0m L分別置于100m L容量瓶中,用蒸餾水定容。從6個梯度溶液中各移取1.0m L標準溶液加到6支具塞試管中,另一支具塞試管中加入1.0m L蒸餾水,然后向這7支試管中分別加入4.0m L上述蒽酮-硫酸試液,加入后立即置于冰水浴中冷卻5m in,然后將7支試管同時浸入沸水浴中加熱15min后取出,在自來水中冷卻后,于620nm波長處用分光光度計測定其吸光度。得標準曲線方程為 A=0.01399c-0.00179,R2=0.999,符合線性關系。
1.2.5 多糖提取率的測定 稱取適量粗多糖樣品,定容于100m L容量瓶中,取1m L,按1.2.4方法測定其吸光度,根據標準曲線,算出多糖含量與質量。
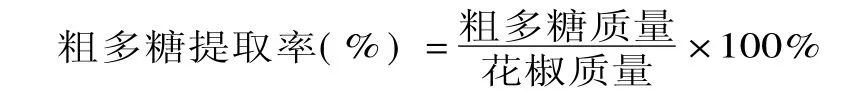
1.2.6 正交實驗 提取過程中,對提取效果影響較大的因素主要有料液比、提取溫度、提取時間、提取次數等,其中提取次數以2~3次為宜。因此本實驗固定提取次數為3次,以料液比、提取溫度、提取時間為變量,花椒中多糖提取率為評價指標,通過L9(33)正交實驗(見表1),考察多糖最佳提取工藝。

表1 花椒中多糖提取因素水平表
1.2.7 體外清除羥基自由基活性實驗 利用Fe2+與H2O2發生Fenton反應,產生羥基自由基,在體系內加入水楊酸捕捉羥基自由基,并產生有色物質,該物質在510nm處有最大吸收。本實驗按照文獻[15]的方法,在10m L離心管中依次加入0.5m L 9.0mmol/m L FeSO4溶液和0.5m L 30%H2O2溶液,混合后加入1m L 9.0mmol/m L水楊酸溶液和1m L蒸餾水。在37℃恒溫水浴中反應30m in后流水冷卻,2000 r/m in離心10m in,在510nm波長處測定其吸光度,將該吸光度值記為A0;分別用1m L樣品溶液代替蒸餾水、1m L蒸餾水代替水楊酸,測定吸光度,并記為 A1、A2,則:
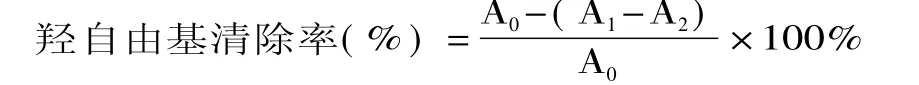
其中,A0為對照的吸光度,A1為樣品的吸光度,A2為空白的吸光度。
2 結果與討論
2.1 多糖提取與含量測定
正交實驗結果及分析見表2。由表2可知,在選定的條件下,從花椒中提取多糖的最佳組合是A2B3C3,即料液比1∶20、提取溫度95℃、提取時間4h;極差越大,因素的影響越大,在選定的工藝條件內,上述各因素的影響次序為:提取時間>提取溫度>料液比。稱取一定量花椒粉,在最佳工藝條件下提取三次,測得粗多糖提取率為3.49%。
2.2 花椒粗多糖體外抗氧化活性
羥自由基是活性氧中最活潑的自由基,也是毒性最大的自由基,它幾乎能與活細胞中任何分子發生反應,且反應速度極快。花椒多糖對羥基自由基的清除效果見圖1。由圖1可知,花椒多糖對Fenton反應產生的·OH有清除作用。當反應體系中花椒多糖的濃度增大時,對·OH的清除作用明顯增大,表明清除自由基能力與花椒多糖濃度之間有比較明顯的量效關系。實驗結果表明,花椒多糖能有效地清除體外Fenton反應產生的·OH,當花椒多糖濃度在2.0mg/m L以上時,對羥自由基的清除效率在50%以上。
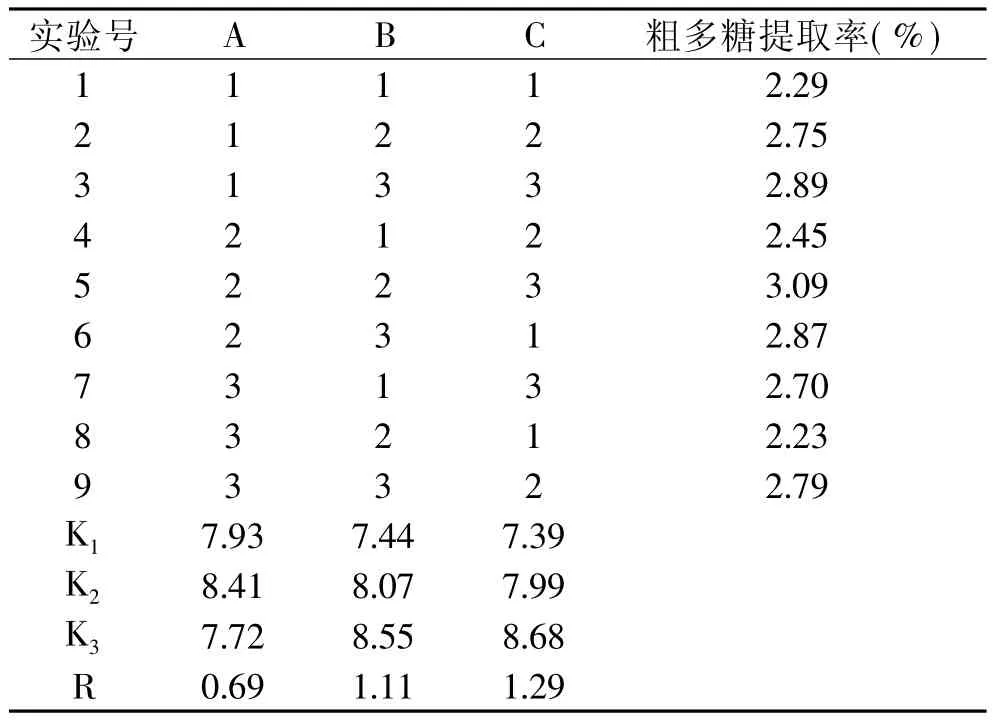
表2 正交實驗結果表
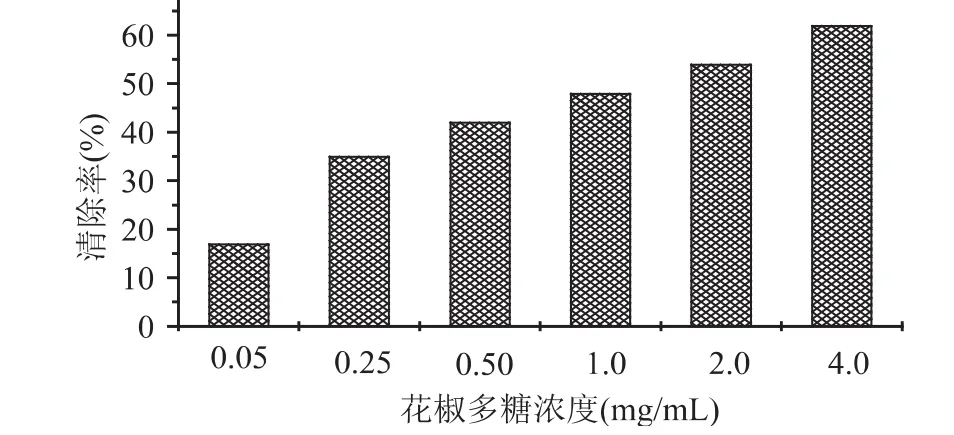
圖1 花椒多糖對羥基自由基的清除作用
3 結論
影響花椒水溶性多糖提取的因素主要有提取時間、提取溫度和料液比。在選定的工藝條件下,通過正交實驗,確定水提法提取花椒多糖的最佳條件為料液比1∶20、提取溫度95℃、提取時間4h。在此最佳條件下,提取三次,花椒多糖提取率為3.49%。在體外抗氧化活性實驗中,花椒多糖能有效地清除Fenton反應產生的·OH;當花椒多糖濃度在2.0mg/m L以上時,對羥自由基的清除效率在50%以上,這表明花椒多糖體外抗氧化活性較強。花椒水溶性多糖的提取及其體外抗氧化活性結果表明,花椒可作為一種有效的自由基清除劑,具有較好的應用前景。
[1]崔俊,李孟樓.花椒開發利用研究[J].林業科技開發,2008,22(2):9-14.
[2]劉雄,闞建全,陳宗道,等.花椒風味成分的提取[J].食品與發酵工業,2003,29(12):62-66.
[3]賈利蓉,趙志峰,雷紹榮,等.漢源青花椒揮發油的成分分析[J].食品與機械,2008,24(3):105-108.
[4]祝詩平,王剛,楊飛,等.基于近紅外光譜的花椒麻味物質快速檢測方法[J].紅外與毫米波學報,2008,27(2):129-132.[5]賀紅早,陳訓,李葦潔.頂壇花椒花粉活力及其對Zn的響應研究[J].安徽農業科學,2007,35(27):8432-8434.
[6]祝詩平,王剛,楊飛,等.粉末樣品顆粒大小對花椒揮發油近紅外光譜定量預測的影響[J].光譜學與光譜分析,2008,28(4):775-779.
[7]Eiji Yamazaki,Osamu Kurita.Extraction and characterization of the pectic substances from Japanese pepper(Zanthoxylum piperitum DC.)fruit[J].International Journal of Food Properties,2007,10(3):505-513.
[8]Eiji Yamazaki,Takayuki Fujiwara,Osamu Kurita,et al.Comparison of pectins from the alcohol-insoluble residue of Japanese pepper(Zanthoxylum piperitum DC.)fruit,a major byproduct of antioxidant extraction[J].Food Science and Technology Research,2008,14(1):18-24.
[9]William N Setzer,Joseph A Noletto,Robert O Lawton,et al.Leaf essential oil composition of five Zanthoxylum species from Monteverde,Costa Rica[J].Molecular Diversity,2005(9):3-13.
[10]Etsuko Sugai,Yasujiro Morimitsu,Kikue Kubota.Quantitative analysis of Sanschool compounds in Japanese pepper(Xanthoxylum piperitum DC.)and their pungent characteristics[J].Bioscience Biotechnology and Biochemistry,2005,69(10):1958-1962.
[11]趙曉俠.花椒的生物活性成分及其應用研究[J].長春大學學報,2008,18(1):108-110.
[12]Yang X G.Aroma constitutes and alkylamides of red and green Huajiao(Zanthoxylum bungeanum and Zanthoxylum schinifolium) [J].Journal of Agricultural and Food Chemistry,2008,56(5):1689-1696.
[13]李正鵬,吳萍,吳蘇青.樹舌胞內多糖抗氧化活性的研究[J].食品工業科技,2010,31(6):108-110.
[14]Qiong Wu,Cheng Zheng,Zheng-Xiang Ning,et al.Modification of Low Molecular Weight Polysaccharides from Tremella Fuciformis and Their Antioxidant Activity in Vitro[J].International Journal of Molecular Sciences,2007(8):670-679.
[15]賈之慎,鄔建敏.比色法測定Fenton反應產生的羥自由基[J].生物化學與生物物理進展,1996,23(2):184-186.
Extraction and antioxidation activity in vitro of Zanthoxylum Bungeagum Maxim polysaccharides
LIGu-cai1,YUAN Li-hua2,ZHANG Ru1,LILi-jun3
(1.Department of Chemistry and Chemical Engineering,Hunan Institute of Engineering,Xiangtan 411104,China;
2.Hospital of Hunan Institute of Engineering,Xiangtan 411104,China;
3.Women and Children’s Healthcare Hospital of Heshan District,Yiyang 413002,China)
The water extraction of polysaccharides from Zanthoxylum Bungeagum Maxim was optimized by orthogonal experiments and in vitro antioxidation activity of the polysaccharides was evaluated by hydroxyl radicals scavenging method.The experimental results showed that the order of different factors affecting extraction rate was extraction time,extraction temperature and ratio of material to water.The optimal experimental parameters were 1∶30 ratio of material to water,95℃ extraction temperature,4h extraction time.Under the optimum extraction conditions,the extraction rate was 3.49%.In vitro antioxidation activity test indicated that the Zanthoxylum Bungeagum Maxim polysaccharide had powerful scavenging efficiency to hydroxyl radicals.When the content of Zanthoxylum Bungeagum Maxim polysaccharides was above 2.0m g/m L,its scavenging efficiency to hydroxyl radicals was more than 50%.
Zanthoxylum Bungeagum Maxim;polysaccharide;extraction;antioxidation activity
TS201.2+3
B
1002-0306(2011)08-0258-03
2010-07-23
李谷才(1969-),男,博士,主要從事藥物及天然產物開發研究。
湖南省自然科學基金資助項目(07JJ6014);2008年度湖南工程學院科研啟動基金項目(0847)。

