吸附-涂層法固定化磷脂酶Lecitase?Ultra的研究
付 敏,趙謀明,*,劉 寧,汪 勇
(1.華南理工大學輕工與食品學院,廣東廣州510641;2.暨南大學食品科學與工程系,廣東廣州510632)
吸附-涂層法固定化磷脂酶Lecitase?Ultra的研究
付 敏1,趙謀明1,*,劉 寧1,汪 勇2
(1.華南理工大學輕工與食品學院,廣東廣州510641;2.暨南大學食品科學與工程系,廣東廣州510632)
比較了7種大孔吸附樹脂對磷脂酶Lecitase?Ultra的固定化效果,對固定化條件進行了研究。結果表明,極性樹脂DA201為該酶的最適固定化載體,在室溫下,以pH 7.0,0.01mol/L的Tris-HCl緩沖液為媒介,加酶量30mg/g樹脂,采用正硅酸乙酯對經真空干燥的固定化酶進行涂層處理,通過電鏡掃描發現其涂層效果較好。在最適條件下得到的固定化酶活力為1250~1300U/g,連續操作5次后酶活保存率為55%。與游離酶比較,固定化磷脂酶Lecitase?Ultra的熱穩定性、pH穩定性均有一定程度的提高。
磷脂酶Lecitase?Ultra,大孔吸附樹脂,涂層,固定化,穩定性
Lecitase?Ultra是諾維信公司推出的一種微生物來源的磷脂酶,該酶是一種羧酸酯水解酶,同時具有脂肪酶活性和磷脂酶活性。在一定反應體系中,它會優先表現出其中一種特定的酶活[1],比如脂肪酶活性。和同類脂肪酶相比,該酶類的脂肪酶活力高,價格便宜,具有很好的應用前景[2]。但由于游離磷脂酶Lecitase?Ultra催化反應時不易回收,條件苛刻,其應用受到了很大的限制。與游離酶相比,固定化酶在保持其高效、專一及溫和的酶催化反應特性的同時,還具有貯存穩定性高、分離回收容易、可多次重復使用、操作連續可控、工藝簡便等優點,因此成為酶工程領域的熱點研究之一[3]。樹脂吸附法[4]是上世紀80年代逐漸發展起來的一項新技術,它可通過氫鍵和疏水作用力與酶分子結合,對酶分子結構影響較小,同時可以維持脂肪酶在非水體系中發揮活性的微環境,大大提高其催化活性,非常適用于脂肪酶類的固定化[5]。磷脂酶Lecitase?Ultra同時具有脂肪酶和磷脂酶活力,其脂肪酶活力方面有著巨大的開發應用前景[6]。本實驗著重研究了基于其脂肪酶方面活力的固定化條件,選用大孔吸附樹脂進行固定化,對固定化工藝條件進行了研究,并探討了固定化酶的穩定性,以期為其在生物催化方面的深入應用提供理論依據和技術支持。
1 材料與方法
1.1 材料與儀器
磷脂酶Lecitase?Ultra 脂肪酶活力3326U/g(測定方法見1.2.4),丹麥諾維信公司;大孔吸附樹脂 天津海光化工有限公司;三丁酸甘油酯 東京化成工業株式會社;氫氧化鉀、鹽酸等試劑 均為分析純。
754型分光光度計 上海第三分析儀器廠;S20 pH計 瑞士梅特勒-托利多公司;DZF-6000型真空干燥箱 上海益恒實驗儀器有限公司;S-3700N掃描電子顯微鏡 日本日立公司。
1.2 實驗方法
1.2.1 載體樹脂的預處理 參考文獻[7]的方法進行。
1.2.2 磷脂酶Lecitase?Ultra的固定化 稱取一定量的游離磷脂酶Lecitase?Ultra、Tris-HCl緩沖液和大孔吸附樹脂,置于磁力攪拌器上恒溫吸附4h,過濾分離載體和上清液,將載體真空干燥至恒重后存于-4℃中待用,上清液留待吸附率測定。
1.2.3 載體樹脂的蛋白吸附量測定 蛋白質含量采用Folin-酚法測定。吸附量和吸附率的公式分別為:
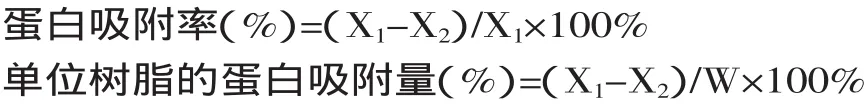
式中:X1:吸附前酶液的蛋白含量(mg);X2:吸附后酶液的蛋白含量(mg);W:加入樹脂的量(g)。
1.2.4 固定化磷脂酶Lecitase?Ultra活力的測定 磷脂酶Lecitase?Ultra的脂肪酶活力采用水解三丁酸甘油酯pH-stat法[8]測定。酶活定義為,在一定條件下,1min水解三丁酸甘油酯產生1μmol丁酸所需的酶量,即為一個酶活力單位(U)。
1.2.5 掃描電鏡 對固定化酶顆粒噴金后,進行電鏡掃描,加速電壓為10kV,放大倍率為5000倍。
2 結果與討論
2.1 固定化載體的選擇
選取7種不同特性的樹脂作為磷脂酶Lecitase? Ultra的固定化載體。固定化條件為:pH7.0的0.01mol/L Tris-HCl緩沖液,加酶量30mg/g樹脂,室溫振蕩吸附12h,經真空干燥后,測定各樹脂的吸附率及固定化酶活力,結果如表1所示。
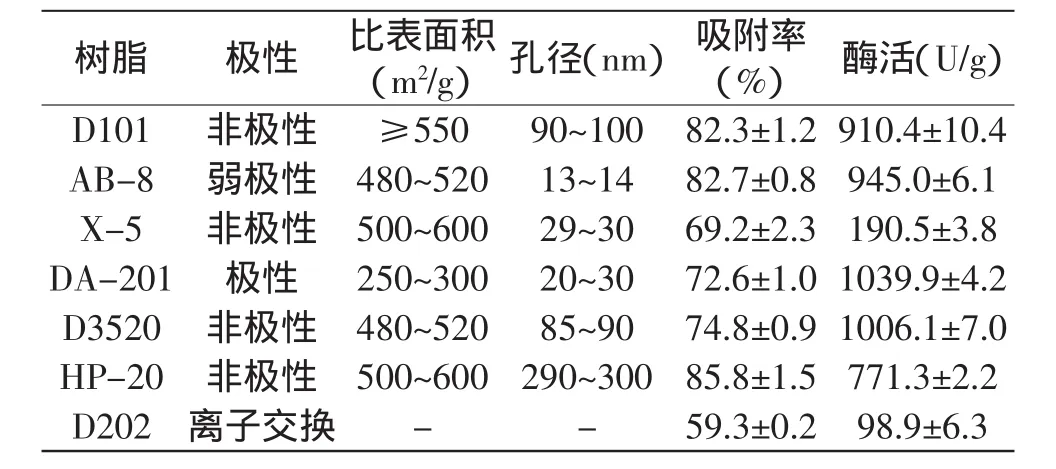
表1 不同樹脂對磷脂酶Lecitase?Ultra的固定化效果
大孔樹脂可以借助氫鍵、范德華力或者功能基團將酶分子固定化,樹脂的物理化學性質是影響固定化能力和催化效率的重要因素[5]。由表1可看出,極性樹脂DA201的吸附率及吸附固定化所得酶的酶活相對較高。該極性樹脂的固定化效果明顯優于其他非極性和弱極性樹脂的固定化效果,它的比表面積和孔徑適中,顆粒均勻,利于固定化和樹脂的回收利用。綜合考慮,選用DA201樹脂作為磷脂酶Lecitase? Ultra的固定化載體。
2.2 磷脂酶Lecitase?Ultra的固定化條件研究
2.2.1 最適固定化pH的研究 在特定的pH下,酶分子上的活性基團才能處于最佳的解離狀態,呈現較好的催化活力。本實驗研究了不同pH的0.01mol/L Tris-HCl緩沖液對固定化酶的酶活及吸附率的影響,結果如圖1所示。可以看出,隨著pH不斷上升,酶活及吸附率先緩慢升高,在pH為7.0時,達到最高,隨后隨著pH上升又緩慢下降。因此最終選擇pH7.0作為酶固定化的最適pH。
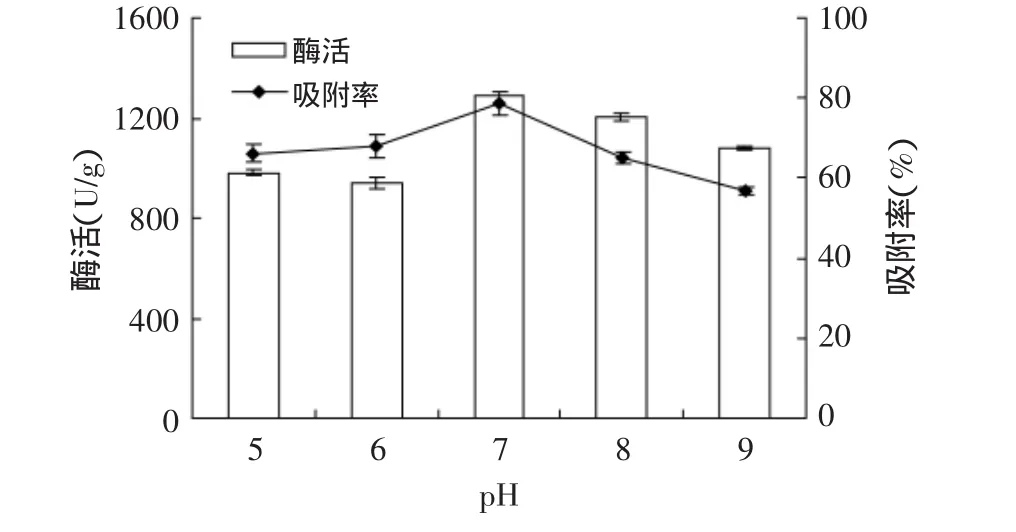
圖1 不同pH對酶活和吸附率的影響
2.2.2 最適加酶量的研究 實驗研究了加酶量對固定化磷脂酶Lecitase?Ultra活力及吸附率的影響,結果如圖2所示。隨著加酶量的增加,吸附率呈上升的趨勢,當加酶量達到30mg/g樹脂時吸附率最高,隨著加酶量的繼續增加,吸附率下降。而酶活在30mg/g樹脂時同時達到最高,隨后逐漸趨于恒定。可能原因是加酶量較少時,吸附酶量較低,則酶活力低;當被吸附酶液濃度升高,酶分子吸附較多,固定化酶活也變大;隨著加酶量進一步增加,樹脂孔道被“堵塞”,產生了空間位阻,固定化酶活也就趨于恒定[9]。綜合考慮,選取30mg/g樹脂為最適加酶量。
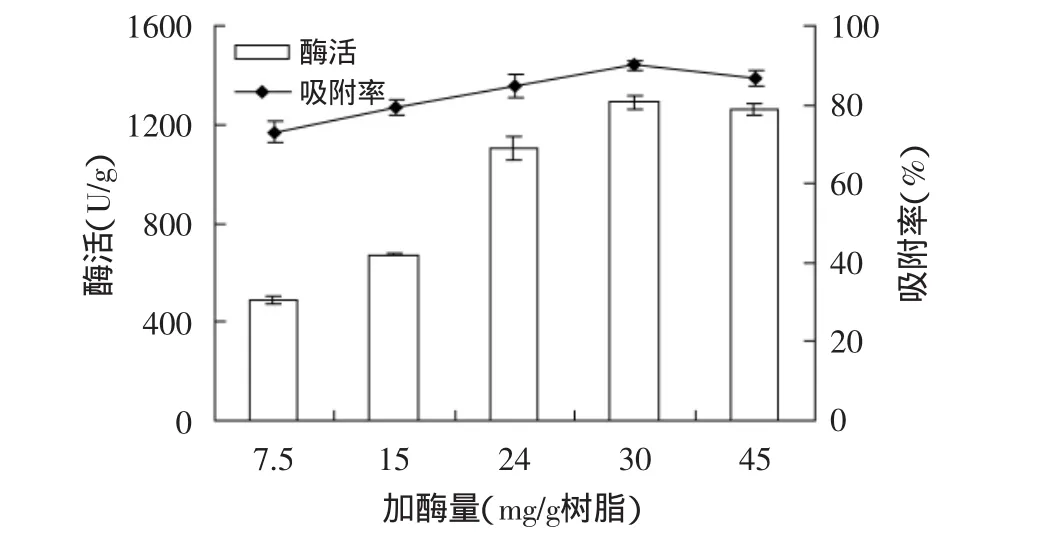
圖2 不同加酶量對酶活和吸附率的影響
2.2.3 固定化酶的交聯或涂層處理研究 本實驗分別采用戊二醛、正硅酸乙酯對經真空干燥的固定化酶進行交聯或涂層處理,以提高其操作穩定性。其中戊二醛和正硅酸乙酯的濃度分別為0.1%和30%[10]。經上述處理后,固定化酶真空干燥,再對其進行電鏡掃描,結果如圖3所示。由圖可知,較對照組而言,交聯或涂層處理對固定化酶的表面改性均較明顯。通過酶活測定發現,經交聯或涂層后固定化酶的酶活分別降低了18%和10%左右,這可能是外加處理損失了一定的酶活。相對交聯法而言,涂層法對酶有一定的包裹保護作用,酶活損失較小一些。

圖3 不同處理方式下固定化酶的掃描電鏡圖
2.3 固定化酶的穩定性研究
2.3.1 不同處理方式下固定化酶操作穩定性的研究以對照組的固定化酶活為100%,測定連續使用5次后的相對酶活,結果如圖4所示。可以發現,在重復使用過程中,經戊二醛交聯處理或正硅酸乙酯涂層處理的固定化酶的操作穩定性明顯優于對照組。正硅酸乙酯涂層處理的效果更好,重復使用5次之后,仍然保有55%左右的酶活,而戊二醛交聯和對照組只有初始酶活的25%。主要原因是,經正硅酸乙酯涂層處理,吸附在樹脂孔隙中的酶被包裹在正硅酸乙酯所形成的涂層里(見圖3-C),使用過程中不易脫落下來[10],從而具備較好的操作穩定性。因此,最終確定吸附-涂層法對磷脂酶Lecitase?Ultra進行固定化處理。經測定,此法得到的固定化磷脂酶Lecitase? Ultra的酶活為1250~1300U/g。
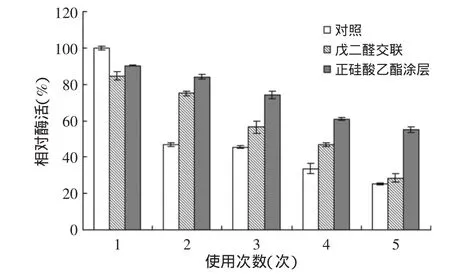
圖4 不同處理方法對固定化酶操作穩定性的影響
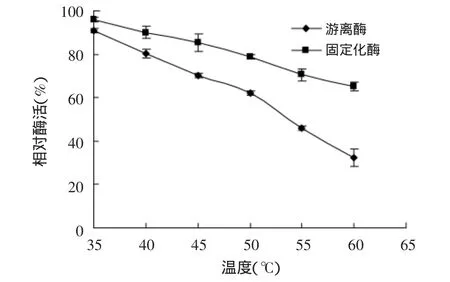
圖5 固定化酶和游離酶的熱穩定性
2.3.2 固定化酶的熱穩定性研究 分別將游離酶和固定化酶在不同溫度下處理1h,定義未經熱處理的酶活為100%,各相對酶活變化如圖5所示。由圖可知,固定化之后,酶的耐熱性能更好,在55℃下處理1h仍能保持60%左右的酶活,從而可使一些需要在相對較高溫的環境中反應的實驗得以進行。在低于45℃對游離酶和固定化酶進行保溫處理,酶活力損失較少;高于45℃對游離酶和固定化酶進行保溫處理,酶活力則呈明顯下降趨勢,游離酶活力下降十分迅速。這主要是由于固定化穩定了酶分子構象,從而減少了熱導致構象變化的可能性[11],大孔吸附樹脂的保護作用也在一定程度上屏蔽了高溫對磷脂酶Lecitase?Ultra的影響,提高了酶分子的抗熱失活能力。2.3.3 固定化酶的pH穩定性研究 在相同條件下分別將游離酶和固定化酶在不同pH下處理2h,定義未經處理的酶活為100%,各相對酶活變化如圖6所示。由圖可知,固定化之后酶的pH穩定性提高,耐酸堿范圍變寬。游離酶在高于pH6.5體系處理后,酶活急劇下降;而固定化酶在高于pH7.5環境處理后,依然保持較高的酶活。整體看來,固定化酶的pH穩定性優于游離酶,且能耐受稍堿性的環境。這是因為,酶在固定化以后,酶活性中心氨基酸帶電情況發生了變化,從而影響了酶的活性[12],因此利于某些特定條件下的使用,擴大了其實際應用范圍。
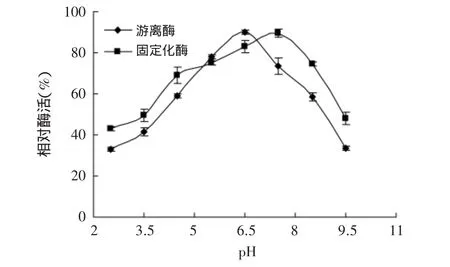
圖6 固定化酶和游離酶的pH穩定性
3 結論
以大孔吸附樹脂DA201為載體,對磷脂酶Lecitase? Ultra進行吸附法固定化,具體方法為:室溫下,以pH7.0 0.01mol/L的Tris-HCl緩沖液為媒介,加酶量30mg/g樹脂,吸附時間4h。真空干燥后,用正硅酸乙酯涂層處理,可得到固定化酶的酶活為1250~1300U/g。重復使用5次后,酶活回收率可達55%。固定化酶較游離酶具有更廣泛的應用條件,熱穩定性增強,適用pH范圍增大,從而擴大了磷脂酶Lecitase?Ultra的使用效率和應用范圍。
[1]Fernandez-Lorente G,Filice M,Terreni M,et al.Lecitase? Ultraasregioselectivebiocatalystinthehydrolysisoffullyprotected carbohydrates strong modulation by using different immobilization protocols[J].Journal of Molecular Catalysis B:Enzymatic,2008,51:110-117.
[2]劉冬梅,李理,楊曉泉,等.用牛津杯法測定益生菌的抑菌活力[J].食品研究與開發,2006,27(3):110-111.
[3]陳陶聲,居乃琥,陳石根.固定化酶理論與應用[M].北京:輕工業出版社,1987.
[4]張軍,徐家立.固定化假絲酵母1619脂肪酶催化油酸油醇酯的合成[J].生物工程學報,1995,11(4):325-331.
[5]陳志鋒,吳虹,宗敏華,等.固定化脂肪酶催化高酸廢油脂脂交換生產生物柴油[J].催化學報,2006,27(2):146-150.
[6]Yong Wang,Mouming Zhao,Keke S,et al.Partial hydrolysis of soybean oil by phospholipase A1(Lecitase?Ultra)[J].Food Chemistry,2010,121:1066-1072.
[7]朱珊珊,邵佩霞,王永華.Lipozyme TL 100L脂肪酶的固定化及其性質研究[J].食品工業科技,2010,31(5):97-100.
[8]Mithilesh KM,Thenkrishnan K,Gurrala S,et al.Lipase activity of Lecitase?Ultra:characterization and applications in enantioselective reactions[J].Tetrahedron:Asymmetry,2009,20: 2854-2860.
[9]周曉云.酶學原理與酶工程[M].北京:中國輕工業出版社,2005.
[10]Benjamas C,Prawit J,Aran H-K.Optimizing an alginate immobilized lipase formonoacylglycerolproduction bythe glycerolysis reaction [J].Journal of Molecular Catalysis B:Enzymatic,2009,59:206-211.
[11]Leonowicz A,Sarkar J M,Bollag J M.Improvement in stability of an immobilized fungallaccase [J].Appl Microbiol Biotechnol,1988,12:129-135.
[12]Andrei S,Maria Norberta de P,Maria do RF,et al.New method for the crovalent immobilization of a xylanase by radical grafting of acrylamide on cellulose acetate membranes[J]. Enzyme and Microbial Technology,2006,39(1):125-130.
Immobilization of Lecitase?Ultra by adsorption-coating method and its properties
FU Min1,ZHAO Mou-ming1,*,LIU Ning1,WANG Yong2
(1.College of Light Industry and Food Science,South China University of Technology,Guangzhou 510641,China;2.Department of Food Science and Engineering,Jinan University,Guangzhou 510632,China)
Seven kinds of macroporous resin were employed to immobilize phospholipase Lecitase?Ultra,and the immobilization conditions were studied.The results indicated that DA201 was the best carrier.The optimum operation conditions were:under room temperature,pH 7.0 Tris-HCl(0.01mol/L),enzyme dosage 30mg/g resin.Tetraethyl orthosilicate was then used as the coating reagent for immobilized enzyme by the vacuum drying,which showed an effective coating effect through scanning electron microscope.Under optimized conditions,the immobilized Lecitase?Ultra with enzyme activity of 1250~1300U/g could be obtained,and it could remain 55%enzyme activity after continuous operation for 5 times.Compared with free Lecitase?Ultra,there was a certain extent improvement for the thermal stability and pH stability of immobilized Lecitase?Ultra. Key words:Lecitase?Ultra;macroporous adsorption resin;coating;immobilization;stability
TS201.2+5
B
1002-0306(2011)10-0277-04
2010-11-19 *通訊聯系人
付敏(1989-),女,碩士研究生,研究方向:食品生物技術。
國家863計劃項目(2010AA101505);國家自然科學基金(31000793)。

