瘤內注射重組溶瘤病毒聯合吉西他濱化療治療中晚期胰腺癌19例療效觀察
肖斌 金震東 李兆申 杜奕奇 吳仁培 周靜
·論著·
瘤內注射重組溶瘤病毒聯合吉西他濱化療治療中晚期胰腺癌19例療效觀察
肖斌 金震東 李兆申 杜奕奇 吳仁培 周靜
目的探討內鏡超聲引導下瘤體內注射重組溶瘤病毒(H101)聯合吉西他濱化療治療中晚期胰腺癌的療效及安全性。方法選擇無手術指證的未行抗腫瘤治療的中晚期胰腺癌患者共19例,于內鏡超聲引導下行H101瘤體內注射,并于注射后第3、10、17 d行吉西他濱靜脈化療(1000 mg/m2),共2個療程。記錄注射前后腫瘤體積,評定療效;記錄患者疼痛及Karnofsky評分變化、不良反應及并發癥發生率、生存期。結果12例腫瘤體積縮小5.3%~69.7%,但治療前后的平均體積差異無統計學意義(P=0.275)。19例患者均完成2周期聯合治療。3例(15.8%)部分緩解;10例(52.6%)穩定;無治愈患者。治療后平均疼痛評分明顯低于治療前(3.1±1.7比3.9±1.6,P=0.004)。治療后Karnofsky評分明顯提高[(68.4±12.1)%比(61.1±9.9)%,P=0.003)]。未發生與操作相關的并發癥,與治療相關的不良反應主要為發熱與腹瀉。19例患者生存期為2.5~10個月,隨訪截止時9例患者仍存活。結論內鏡超聲引導下瘤體內注射重組溶瘤病毒聯合吉西他濱化療治療中晚期胰腺癌的方法是安全、有效的,能改善患者生存質量、降低疼痛評分。
胰腺腫瘤; 內鏡超聲檢查; 溶瘤病毒; 超聲檢查,介入性; 藥物療法
溶瘤病毒能利用抑癌基因失活或缺陷特異性地在腫瘤細胞中不斷復制,進而導致靶細胞溶解死亡,細胞破裂釋放出的病毒又可向周圍癌細胞擴散,反復循環,從而有效抑制腫瘤生長[1]。其中基因重組的5型腺病毒在頭頸部腫瘤、乳腺癌、肺癌、肝癌、腦膠質瘤、婦科腫瘤等的實驗和臨床研究中表現出有效的抗癌效應[2]。本研究應用內鏡超聲(EUS)引導下瘤體內注射基因重組溶瘤病毒治療中晚期胰腺癌取得了一定療效,現報道如下。
資料和方法
一、病例資料
收集2009年2月至2011年1月收治的19例胰腺癌患者,其中男14例,女5例;年齡49~81歲,平均69歲。納入標準:(1)經組織學或細胞學明確診斷為胰腺癌且失去手術切除機會者(ⅡA期以上);(2)年齡18歲以上;(3)心肺功能能耐受麻醉下EUS穿刺治療;(4)Karnofsky評分≥50%;(5)未合并感染;(6)未應用免疫抑制劑或糖皮質激素治療;(7)預期壽命≥2個月;(8)近4周未接受其他抗腫瘤治療;(9)患者或其法定代理人愿意簽署知情同意書。排除標準:(1)由于腫瘤性狹窄或解剖結構原因不適宜行EUS者;(2)妊娠或哺乳期婦女;(3)有大量腹水者;(4)自身免疫性疾病,HIV陽性,或有器官移植史患者。
19例患者TNM分期ⅡA期2例,ⅡB期11例,Ⅲ期5例,Ⅳ期1例;中上腹或腰背痛12例,腹痛伴黃疸6例,均有不同程度的乏力、納差癥狀;體檢發現胰腺占位及淋巴結腫大后經EUS引導下細針抽吸活檢確診胰腺癌1例;腫瘤位于胰頭部13例,胰體部2例,胰尾部2例,多個病灶2例。治療前腫瘤體積(a×b2/2,a:最長徑,b:與a垂直的最長徑)11.56~213.56 cm3,平均50.96 cm3;Karnofsky評分50%~90%,平均61%;術前疼痛評分(線性模擬視覺法)0~7分,平均3.7分。
二、治療方法
采用Olympus GF-UCT2000-OL5穿刺專用鏡、GF-UC240P-AL5穿刺專用鏡,Olympus Aloka ProSound SSD-α 5彩色超聲波診斷儀及Wilson-cook22G超聲內鏡專用穿刺針。基因重組溶瘤腺病毒(H101)由上海三維生物技術有限公司生產,規格為5×1011vp/0.5ml(國藥準字S20060027)。吉西他濱由美國禮來公司生產(H20050172)。
在EUS引導下找到并測量病灶,避開血管行細針穿刺至瘤體中央(圖1),長徑在4 cm以上者注射病毒1.5×1012vp(3支稀釋至3 ml),長徑<4 cm則注射1.0×1012vp(2支稀釋至2 ml)。注射后2 d內常規行抗感染、抑酶及支持治療。注射后第3、10、17 d行吉西他濱靜脈化療(1000 mg/m2)。休息2周后再次瘤體注射并完成一周期化療。
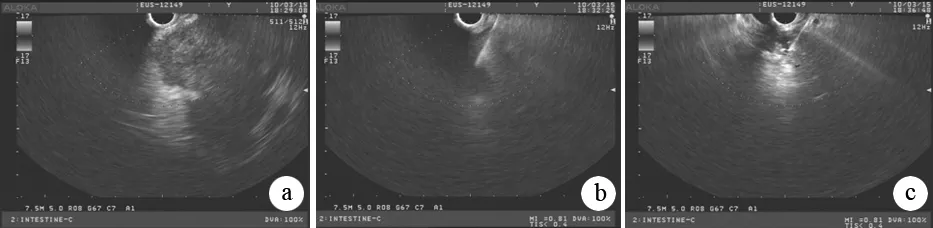
a:內鏡超聲下顯示腫瘤瘤體;b:22G穿刺針刺入瘤體;c:溶瘤病毒注射后超聲下呈云霧狀改變,在瘤體內分布均勻
圖1溶瘤病毒胰腺癌瘤體內注射過程
三、療效判定及隨訪
1.近期療效評價:治療前及治療后1個月行CT或MRI掃描,測定目標與非目標病灶長徑。近期療效評價參照最新的RECIST標準1.1版(表1)[3]。總有效率=(CR+PR)/總例數×100%。

表1 實體瘤療效評價RECIST標準
注:CR:治愈;PR:部分緩解;SD:穩定;PD:進展
2.不良反應:按照美國國家癌癥協會(NCI)毒性分級標準分為0~Ⅳ級。
3.生活質量評價:記錄治療前后Karnofsky評分及疼痛評分。
4.生存期隨訪:隨訪截至2011年3月1日。記錄患者的生存情況,計算中位生存期、總體生存期。
四、統計學處理
結 果
一、療效
多數腫瘤治療后出現囊實性改變,內部出現明顯液化壞死。12例腫瘤體積縮小5.3%~69.7%(圖2),但治療前后的平均體積差異無統計學意義(P=0.275)。3例(15.8%)患者PR,目標病灶長徑總和分別減少30.9%、30.4%、30.8%,未出現新發病灶;6例(31.6%)患者PD,其中5例目標病灶長徑總和增加>20%,1例出現肝轉移病灶;10例(52.6%)患者為SD;無CR者。總有效率達15.8%(3/19)。
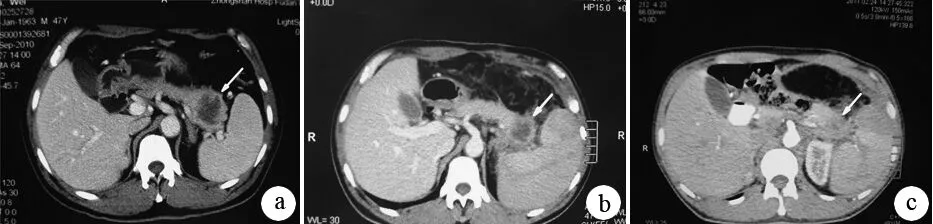
圖2注射H101聯合化療前(a)及治療后1個月(b)、4個月(c)的胰腺CT圖像
二、生活質量
18例有疼痛癥狀者治療后1個月,5例(27.8%)疼痛評分下降1分,4例(22.2%)下降2分,1例(5.6%)下降3分,7例(38.9%)評分無變化,1例(5.6%)提高了1分。患者治療前后的疼痛評分差異具有統計學意義(3.9±1.6比3.1±1.7,P=0.004)。其中9例(50.0%)患者因疼痛在后續的2個月中接受了EUS下腹腔神經松解術。11例(61.1%)患者術后納差、乏力癥狀有不同程度緩解,6例(33.3%)無明顯改善,1例(5.6%)癥狀加重。83.3%(5/6)的黃疸患者因黃疸加重在此后的2個月中接受了ERCP治療。11例(57.9%)患者Karnofsky評分提高10%~30%,7例(36.8%)評分無改善, 1例(5.3%)評分下降10%。治療前后的Karnofsky評分差異具有統計學意義[(61.1±9.9)%比(68.4±12.1)%,P=0.003)]。
三、不良反應及并發癥
未出現與操作有關的穿孔、出血、敗血癥等并發癥,僅1例在術后次日出現輕微的高淀粉酶血癥,經抑酶、制酸等處理后很快緩解。不良反應主要與藥物有關。9例(47.4%)出現發熱,其中Ⅲ級(最高40.1℃)1例,Ⅱ級7例,Ⅰ級1例,經物理降溫或對癥處理后在3 d內體溫恢復正常。2例(10.5%)出現輕微流感樣癥狀。2例(10.5%)出現惡心、嘔吐,4例(21.1%)出現腹瀉,均為Ⅰ~Ⅱ級,其中1例81歲老年女性治療后出現明顯水樣瀉,持續5 d,經對癥處理后好轉。6例(31.6%)轉氨酶升高,3例(15.8%)膽紅素升高,7例(36.8%)出現骨髓抑制,均Ⅰ~Ⅱ級,經谷胱甘肽、甘草酸制劑保肝治療和升白藥物治療均在2周內恢復正常。
四、生存期
19例患者隨訪2.5~10個月,平均(5.1±2.4)個月,中位生存期4.5個月。隨訪截止時存活9例,1例已隨訪10個月仍存活,且未見疾病進展。
討 論
吉西他濱是目前中晚期胰腺癌化療的一線藥物,相比5-FU等傳統藥物在中位生存期、總體生存率等方面都表現出明顯優勢[4]。但以吉西他濱為基礎的聯合化療方案并未表現出優于吉西他濱單藥的更多益處,因而目前臨床應用最多的胰腺癌化療方案仍是吉西他濱單藥化療。然而吉西他濱單藥治療晚期胰腺癌在延長總體生存時間上仍不理想,臨床受益有限[5-6]。隨著EUS技術和器械的進步,發展了EUS引導下的瘤體介入治療方法。該法在高分辨率實時超聲引導下可避免盲目穿刺所引起的周圍臟器損傷,將抗癌制劑直接注入腫瘤病灶中可減少藥物的流失,相對于外科手術和放射介入治療具有更好的耐受性和適用范圍。文獻有在EUS引導下瘤內注射同種異體淋巴細胞混合培養液、攜帶TNF或p53基因的腺病毒載體的報道[5-6]。以125I粒子瘤內種植為代表的近距離內放射技術已在進展期胰腺癌的臨床治療中得到肯定的療效[7]。
溶瘤病毒是經過遺傳學改造而具有復制能力的病毒。國外ONYX-015 ( d11520)是最早應用于臨床的基因重組腺病毒。由于刪除了E1B 55kD片段,感染正常細胞時因不能抑制p53基因的激活,細胞很快進入凋亡,病毒無法增殖而終止感染。而在缺失或下調p53基因的腫瘤細胞中卻仍能復制、增殖,導致細胞破裂、死亡。本文采用的H101是刪除了E1B 55kD和E3區基因片段的重組人5型腺病毒,在國內已獲食品藥品管理局批準上市。注射后10 d病毒DNA可在注射部位被檢測到,而周圍組織中未檢出病毒,表明其具有高度的選擇性。H101的不良反應多數表現為流感樣癥狀和注射局部的疼痛,無其他嚴重不良反應。有研究表明單用該病毒治療的有效率不超過14%,而與化療藥物聯用可以明顯增強溶瘤病毒的溶瘤效應[8-10],Ⅰ~Ⅲ期臨床試驗的有效率可達59.4%~86.5%[10-14]。
本結果顯示,19例中晚期胰腺癌患者治療后12例瘤體有程度不等的縮小,然而治療前后的瘤體平均體積無顯著性差異。其原因可能有:(1)樣本量偏少導致數據偏倚;(2)體積估算誤差。我們用平面二維圖像根據長短徑大致估算,而腫瘤本身并非一個完整的球體;(3)溶瘤病毒聯合化療確實無明顯縮小腫瘤體積作用的可能性也不能排除。本組患者的總有效率為15.8%,較以往發表H101的臨床試驗略低[15-16]。其原因應該與治療方案的不同有關。治療后55.6%的患者疼痛評分下降,一半患者乏力、納差等主觀癥狀緩解,Karnofsky評分明顯上升,表明溶瘤病毒瘤體注射聯合吉西他濱化療可以有效改善患者的生活質量。
本組未出現與EUS操作過程有關的并發癥。主要不良反應為溶瘤病毒相關性發熱,其次為腹瀉,均為Ⅱ級以下,對癥處理后恢復。Ⅰ至Ⅱ級的肝功能異常和骨髓抑制改變考慮與聯合化療有關。說明本治療方法是安全的,可耐受的。
本組治療后患者的中位生存期為4.5個月,與以往吉西他濱單藥治療的結果相近,不甚滿意。
[1] Martuza RL.Conditionally replicating herpes vectors for cancer therapy.J Clin Invest,2000,105:841-846.
[2] Crompton AM,Kirn DH.From ONYX-015 to armed vaccinia viruses:the education and evolution of oncolytic virus development.Curr Cancer Drug Targets,2007,7:133-139.
[3] Eisenhauera EA,Therasseb P,Bogaertsc J,et al.New response evaluati on criteria in solid tumours:Revised RECIST guideline (version 1.1).Eur J Cancer,2009,45:228-247.
[4] Pliarchopoulou K,Pectasides D.Pancreatic cancer: current and future treatment strategies.Cancer Treat Rev,2009,35:431-436.
[5] Mundt AJ,Vijayakumar S,Nemunaitis J,et al.A phase I trial of TNFerade biologic in patients with soft tissue sarcoma in the extremities.Clin Cancer Res,2004,10:5747-5753.
[6] 陳潔,金震東,李兆申,等.內鏡超聲引導下瘤內注射重組人p53腺病毒治療胰腺癌的短期臨床觀察.胰腺病學,2007,7:75-77.
[7] Jin Z,Du Y,Li Z.Endoscopic ultrasonography-guided interstitial implantation of iodine125 seeds combined with chemotherapy in the treatment of unresectable pancreatic carcinoma:a prospective pilot study.Endoscopy,2008,40:314-320.
[8] Cherubini G,Petouchoff T,Grossi M,et al.E1B55K-deleted adenovirus (ONYX-015 ) overrides G1/S and G2/M checkpoints and causes mitotic catastrophe and endoreduplication in p53-proficient normal cells.Cell Cycle,2006,5:2244-2252.
[9] Yuan ZY,Zhang L,Li S,et al.Safety of an E1B deleted adenovirus administered intratumorally to patients with cancer.Chin J Cancer,2003,22:310-313.
[10] Yoon AR,Kim JH,Lee YS,et al.Markedly enhanced cytolysis by E1B-19kD-deleted oncolytic adenovirus in combination with cisplatin.Hum Gene Ther,2006,17:379-390.
[11] Ganly I,Eckhardt SG,Rodriguez GI,et al.A phase Ⅰ study of Onyx-015,an E1B attenuated adenovirus,administered intratumorally to patients with recurrent head and neck cancer.Clin Cancer Res,2000,6:798-806.
[12] Mulvihill S,Warren R,Venook A,et al.Safety and feasibility of injection with an E1B-55 kDa gene-deleted, replication-selective adenovirus (ONYX-015) into primary carcinomas of the pancreas:a phase I trial.Gene Ther,2001,8:308-315.
[13] Hartkopf AD,Fehm T,Wallwiener D,et al.Oncolytic virotherapy of gynecologic malignancies. Gynecol Oncol,2011,120:302-310.
[14] V?h?-Koskela MJ,Heikkil? JE,Hinkkanen AE.Oncolytic viruses in cancer therapy.Cancer Lett,2007,254:178-216.
[15] Chiocca EA,Abbed KM,Tatter S,et al.A phase Ⅰ openlabel,dose-escalation,multi-institutional trial of injection with an E1B-attenuated adenovirus,ONYX-015,into the peritumoral region of recurrent malignant gliomas,in the adjuvant setting.Mol Ther,2004,10:958-966.
[16] Xia ZJ,Chang JH,Zhang L,et al.Phase Ⅲ randomized clinical trial of intratumoral injection of E1B gene-deleted adenovirus (H101) combined with cisplatin-based chemotherapy in treating squamons cell cancer of head and neck or esophagus.Chin J Cancer,2004,23:1666-1670.
2011-03-23)
(本文編輯:呂芳萍)
Intra-tumoralinjectionofE1Bgene-deletedadenoviruscombinedwithgemcitabineforunresectablepancreaticcarcinoma:19casesanalysis
XIAOBin,JINZhen-dong,LIZhao-shen,DUYi-qi,WURen-pei,ZHOUJing.
DepartmentofGastroenterology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
Correspondingauthor:JINZhen-dong,Email:zhendjin@126.com
ObjectiveTo evaluate the efficacy and tolerability of EUS-guided intra-tumoral injection of E1B gene-deleted adenovirus (H101) combined with intravenous gemcitabine for unresectable pancreatic carcinomas.MethodsNineteen patients with advanced adenocarcinoma of the pancreas who were not resectable and never to anti-cancer treatment were enrolled in this study. Each patient underwent two sessions of EUS-guided H101 intra-tumoral injection in combination with gemcitabine (i.v., 1000 mg/m2, d3, 10, 17). The tumor size before and after H101 intra-tumoral injection were recorded for efficacy assessment. The changes of pain score and KPS, adverse effects and complication rates, survival were estimated.ResultsThe tumor size decreased in twelve patients by 5.3%~69.7%, but the difference was not statistically significant (P=0.275). All of nineteen patients completed two cycles of combination treatment. Among them, 3 (15.8%) achieved partial response, 10 (52.6%) had stable disease, and none had complete response. The mean pain score after injection was significantly lower than that before injection (3.1±1.7vs. 3.9±1.6,P=0.004). KPS after injection was significantly increased more than that before injection [(68.4±12.1)%vs. (61.1±9.9)%,P=0.003)]. There was no complication associated with the procedure. Major adverse effects associated with H101 injection were fever and diarrhea. The survival time was 2.5 to 10 months. Nine patients were still alive.ConclusionsEUS-guided E1B gene-deleted adenovirus intra-tumral injection in unresectable pancreatic carcinomas is feasible and well tolerated in combination with intravenous gemcitabine, which can improve the quality of life and decrease the pain score.
Pancreatic neoplasms; Endoscopic ultrasonography; Oncolytic virus; Ultrasonography, intervention; Chemotherapy
10.3760/cma.j.issn.1674-1935.2011.03.004
上海市科委科技支撐計劃重點項目(08411954000)
200433 上海,第二軍醫大學附屬長海醫院消化內科
金震東,Email: zhendjin@126.com

