氧化苦參堿對人胰腺癌細胞株SW1990侵襲轉移能力的影響
李飛 謝立群 冀潤利 周靜 鄭艷敏 劉彩菊 段澤新
·論著·
氧化苦參堿對人胰腺癌細胞株SW1990侵襲轉移能力的影響
李飛 謝立群 冀潤利 周靜 鄭艷敏 劉彩菊 段澤新
目的探討氧化苦參堿對人胰腺癌細胞株SW1990體外遷移及侵襲能力的影響及其作用機制。方法體外培養人胰腺癌SW1990細胞株,用氧化苦參堿處理SW1990細胞后,采用MTT法檢測細胞增殖;通過細胞黏附實驗、細胞劃痕實驗及Transwell小室檢測細胞的黏附、遷移及侵襲能力; RT-PCR法檢測細胞基質金屬蛋白酶2(MMP-2)、血管內皮生長因子(VEGF) mRNA的表達; ELISA法檢測細胞VEGF蛋白的含量。結果氧化苦參堿呈劑量和時間依賴性抑制SW1990細胞的增殖。2 mg/ml氧化苦參堿處理SW1990細胞1 h后,細胞的體外黏附抑制率為(35.23±8.56)%;處理24 h后,細胞的過河時間為(65.46±4.25)h,較對照組的(34.50±4.12)h顯著延長(P<0.05);穿膜細胞數為(91.9±9.6)個,較對照組的(144.2±17.2)個顯著減少(P<0.05);細胞VEGF、MMP-2 mRNA的表達及VEGF蛋白的分泌量均顯著下調[0.515±0.063比0.817±0.054,0.343±0.072比0.650±0.068,(265.50±5.45)pg/ml比(441.06±16.70)pg/ml,P值均<0.05]。結論氧化苦參堿可能通過抑制MMP-2和VEGF表達進而抑制胰腺癌SW1990細胞的增殖、黏附、遷移及侵襲能力。
胰腺腫瘤; 氧化苦參堿; 腫瘤侵潤; 腫瘤轉移
80%的胰腺癌患者在臨床確診時已發現有局部侵犯及血行、淋巴轉移, 5年生存率低于5%[1]。氧化苦參堿(oxymatrine,OM)是從中藥苦參中提取的一種生物堿,具有抗腫瘤、抗炎、抗過敏、抗肝纖維化、免疫及生物反應調節等作用[2-3]。其抗腫瘤活性主要為抑制腫瘤細胞增殖和轉移、促進凋亡,以及誘導分化等[4-6]。本實驗觀察氧化苦參堿對人胰腺癌細胞株SW1990細胞增殖、黏附、遷移及侵襲力的影響,探討氧化苦參堿的抗腫瘤作用機制,為其臨床應用提供一定的實驗依據和理論基礎。
材料與方法
一、MTT法檢測SW1990細胞增殖
人胰腺癌細胞株SW1990由中國科學院上海細胞生物研究所提供,常規培養傳代。取對數生長期細胞,每孔5×103個細胞接種于96孔板,常規培養24 h后改無血清培養液培養12 h,然后加入終濃度分別為1、2、4、8、16 mg/ml的氧化苦參堿(江蘇正大天晴藥業股份有限公司,國藥準字H20057480)繼續培養24、48、72 h,以不加氧化苦參堿為對照組,單純培養液為空白組。每孔加入5 mg/ml MTT溶液(Sigma公司)20 μl后再培養4 h,1500 r/min離心10 min,每孔加入DMSO 150 μl,振蕩10 min,在全自動酶標儀(Bio-Rad550型)上測490 nm波長吸光度(A490)值。每組設8個復孔,實驗重復3次。細胞的生長抑制率(IR)=(對照組A490值-處理組A490值)/(對照組A490值-空白組A490值)×100%。
二、細胞黏附實驗
96孔板每孔鋪Matrigel 30 μg,置37℃培養箱中過夜待用。每孔加入2500個用1、2、4 mg/ml氧化苦參堿處理24 h的SW1990細胞(50 μl),以不加氧化苦參堿作為對照組,繼續培養1 h,每組設3個復孔。PBS洗去未黏附細胞,每孔加入5 mg/ml MTT 20 μl后再培養4 h。棄去MTT,加入150 μl DMSO,測A490值。細胞黏附抑制率=(對照組A490值-處理組A490值)/對照組A490值×100%。
三、細胞劃痕實驗
取對數生長期的SW1990細胞,按每孔5×105個細胞量加入24孔板,待細胞培養至基本鋪滿后棄培養液,用100 μl Tip吸頭在孔中劃一直線。加入終濃度分別為1、2、4 mg/ml的氧化苦參堿,以不加氧化苦參堿作為對照組。培養24 h后每2 h觀察1次,直至劃痕被細胞填滿。觀察過河所需時間。每組設5個復孔,實驗重復3次。
四、細胞侵襲實驗
取對數生長期SW1990細胞,用無血清培養液孵育12 h,胰酶消化,調整細胞數至5×105/ml個。Transwell趨化小室(孔徑6.5 mm,Millipore公司)的上室加入200 μl單細胞懸液及200 μl終濃度分別為1、2、4 mg/ml的氧化苦參堿,以不加氧化苦參堿作為對照組;下室加600 μl條件培養液。常規培養24 h,取出濾膜,刮凈上室細胞,下層黏附的穿膜細胞用95%乙醇固定10 min,蘇木精染色15 min,200倍光鏡下隨機取5個視野,計數穿膜細胞數。每組3個趨化小室,實驗重復3次。
將50 μg Matrigel膠用4℃ DMEM培養液1∶4稀釋,分3次涂于Transwell小室微孔濾膜上,每次間隔10 min。包被后用紫外線照射2 h殺菌,使用前上室加少量無血清培養基室溫水化2 h。重復上述細胞侵襲實驗,共3次。
五、RT-PCR法檢測細胞VEGF、MMP-2 mRNA表達
取對數生長期細胞,以5×105/ml個接種于25 ml培養瓶中培養,24 h后用無血清H-DMEM培養12 h,再用1、2、4 mg/ml氧化苦參堿處理細胞24 h,對照組不加氧化苦參堿。收集細胞,用Trizol提取細胞總RNA,鑒定其純度及完整性。應用Omiga2.0設計引物,VEGF上游引物5′-CTACCTCCACCATGCCAAGT-3′,下游引物5′-TCTCTCCTATGTGCTGGCCT-3′,產物311 bp;MMP-2上游引物5′-CAGGCTCTT-CTCCTTTCACAAC-3′,下游引物5′-AAGCCACGGCTT-GGTTTTCCTC-3′,產物398 bp;內參β-actin上游引物5′-TGTTTGAGACCTTCAACACCC-3′,下游引物5′-AGCACTGTGTTGGCGTACAG-3′,產物540 bp。引物由大連寶生物工程有限公司合成。逆轉錄條件:30℃ 10 min,42℃ 30 min,99℃ 5 min,5℃ 5 min;PCR反應條件: 94℃ 1 min,61℃ 45 s(VEGF)或55℃ 1 min (MMP-2)或58℃ 30 s(β-actin),72℃ 1 min, 30個循環,72℃ 5 min。PCR產物經2%瓊脂糖凝膠電泳,凝膠自動成像2000系統掃描,以目的條帶與β-actin條帶的灰度值比表示mRNA相對表達量。
六、ELISA法檢測細胞培養上清VEGF蛋白含量
取上述各組細胞培養上清液,ELISA法檢測VEGF蛋白含量。ELISA試劑盒購自北京四正柏生物科技有限公司,按說明書操作,根據標準曲線換算VEGF含量。
七、統計學分析
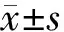
結 果
一、氧化苦參堿對SW1990細胞增殖的影響
氧化苦參堿呈濃度-時間性抑制細胞增殖(圖1)。16 mg/ml氧化苦參堿處理細胞24 h的增殖抑制率高達82.9%,但1、2、4 mg/ml氧化苦參堿對細胞的增殖抑制率均<10%,故取這三種濃度進行其他相關實驗。
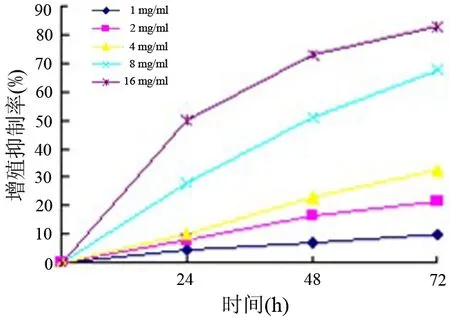
圖1 不同濃度氧化苦參堿對SW1990細胞增殖的影響
二、氧化苦參堿對SW1990細胞黏附的影響
對照組A490值為1.10±0.16,1、2、4 mg/ml氧化苦參堿組A490值分別為0.88±0.12、0.71±0.20和0.59±0.18,均較對照組顯著降低(P<0.05)。1、2、4 mg/ml氧化苦參堿組的黏附抑制率分別為(20.16±4.24)%、(35.23±8.56)%和(46.83±7.26)%,呈明顯量效關系。
三、氧化苦參堿對SW1990細胞遷移的影響
對照組過河時間為(34.50±4.12)h,1、2、4 mg/ml氧化苦參堿組過河時間分別為(48.80±3.56)、(65.46±4.25)和(70.54±3.53)h,均較對照組顯著延長(P<0.05,圖2),且隨濃度增加而延長。
四、氧化苦參堿對SW1990細胞侵襲力的影響
氧化苦參堿組細胞穿膜數呈濃度依賴性下降。對照組穿膜細胞數為(144.2±17.2)個,1、2、4 mg/ml氧化苦參堿組分別為(117.1±13.6)、(91.9±9.6)和(77.4±8.4)個,均較對照組顯著減少(P<0.05)。應用Matrigen包被后,對照組及1、2、4 mg/ml氧化苦參堿組穿膜細胞數分別為(102.4±11.2)、(84.2±9.3)、(69.1±8.8)和(57.9±6.1)個,氧化苦參堿組亦均較對照組顯著減少(圖3),且呈濃度依賴性。

圖2對照組(a)及1(b)、2(c)、4(d)mg/ml氧化苦參堿組的細胞劃痕實驗(36 h ×100)
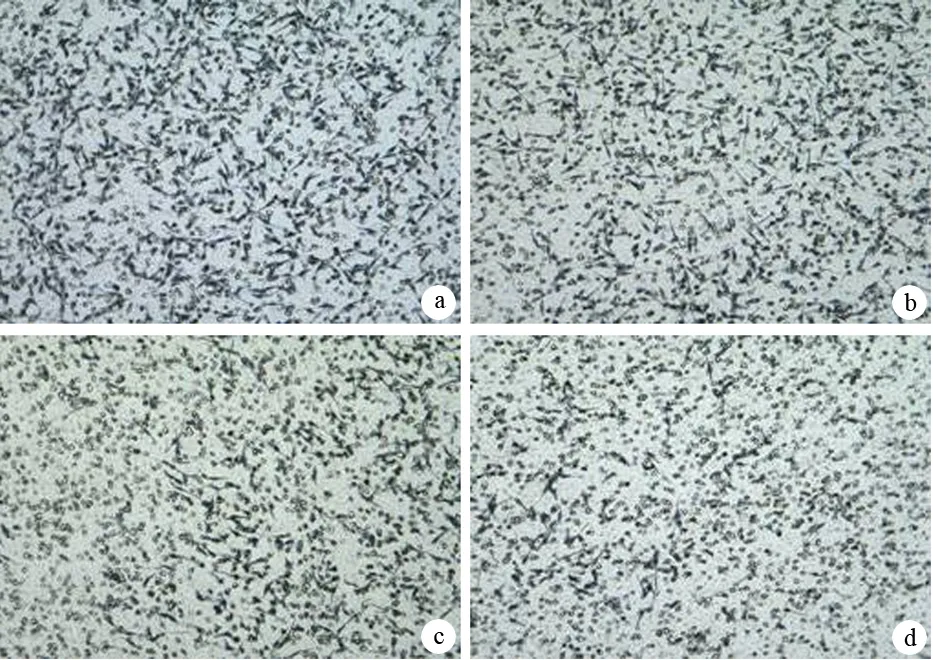
圖3對照組(a)及1(b)、2(c)、4(d)mg/ml氧化苦參堿組的細胞穿膜數( ×100)
五、氧化苦參堿對SW1990細胞VEGF、MMP-2 mRNA表達及VEGF蛋白分泌的影響
對照組及1、2、4 mg/ml氧化苦參堿組細胞VEGF mRNA表達量分別為0.817±0.054、0.612±0.088、0.515±0.063和0.322±0.025;MMP-2 mRNA表達量分別為0.650±0.068、0.492±0.052、0.343±0.072和0.236±0.078,均較對照組顯著降低(P<0.05,圖4) ,且呈濃度依賴性。
對照組及1、2、4 mg/ml氧化苦參堿組細胞VEGF蛋白分泌量分別為(441.06±16.70)、(356.09±16.52)、(265.50±5.45)和(158.11±17.69)pg/ml,氧化苦參堿各組均顯著低于對照組(P值均<0.05),且呈濃度依賴性 。
討 論
從分子水平看,惡性腫瘤侵襲、轉移的過程首先是癌細胞與癌細胞間的黏附松解,然后癌細胞通過溶解蛋白侵入周圍的細胞外基質,再進入血管及淋巴管。在血液(淋巴)循環中,腫瘤細胞逃脫機體的免疫防御機制,黏附在轉移器官血管床的血管內皮上,繼而脫離其血管系統,侵入靶器官,從此開始增殖,并形成新生血管。因此黏附是癌細胞侵襲的起始步驟,隨后經癌細胞的遷移、侵襲等方式實現轉移的結果。
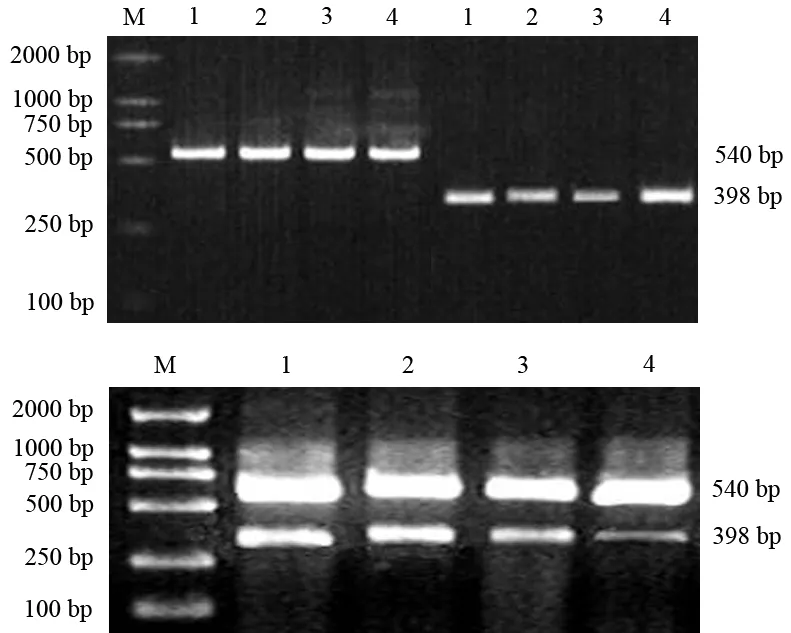
1、2、3:1、2、4 mg/ml氧化苦參堿組;4:對照組
圖4各組SW1990細胞VEGF(上)、MMP-2(下) mRNA的表達
本體外實驗結果顯示,氧化苦參堿呈濃度-時間依賴性抑制胰腺癌細胞SW1990的增殖、黏附及遷移,與文獻報道的氧化苦參堿對其他癌細胞的作用相似。
在腫瘤的侵襲和轉移過程中,細胞外基質的降解和促血管生成因子誘導的新生血管形成起著重要作用[7-8]。基質金屬蛋白酶家族(MMPs)是人體內降解細胞外基質的主要酶類,特別是MMP-2和MMP-9在腫瘤細胞的浸潤和轉移灶的形成過程中起重要作用。研究表明,胰腺癌MMP-2和MMP-9的mRNA和蛋白的表達增加[9],其表達上調可促進胰腺癌細胞浸潤[10]。
VEGF是作用最強、特異性最高的促血管生長因子之一,在腫瘤等病理情況下表達可異常增加,促進腫瘤侵襲和轉移。Itakura等[11]報道,胰腺癌組織VEGF mRNA含量是正常胰腺組織的5倍以上,75例胰腺癌患者中64例VEGF蛋白表達陽性,VEGF表達與微血管密度水平、腫瘤大小、局部浸潤相關,但與生存率無關。研究還表明,胰腺癌MMP-2、VEGF
的表達與胰腺癌的轉移密切相關[12-13]。本實驗結果顯示,胰腺癌SW1990細胞有MMP-2、VEGF mRNA的表達,經氧化苦參堿處理后,SW1990細胞MMP-2、VEGF mRNA表達量呈濃度依賴性下降,VEGF蛋白含量呈濃度依賴性減少。表明氧化苦參堿可能通過下調MMP-2和VEGF的表達抑制胰腺癌SW1990細胞的侵襲和轉移。
[1] 陳可欣,張思維,李連弟.中國胰腺癌死亡情況報告.中華流行病學雜志,2003,24:520-524.
[2] 李正蓉.苦參素的藥理與臨床研究進展.華西藥學雜志,2003,18:435-437.
[3] 王軍學,王國俊.苦參堿及氧化苦參堿的藥理作用及臨床研究.肝臟,2000,5:116-117.
[4] 司維柯,尚桃元,康格非.苦參堿對人肝癌細胞HepG2的細胞形態影響和相關增殖因素的變化.第三軍醫大學學報,2000,22:553-556.
[5] 錢學敏,李繼強,羅鴻予,等.氧化苦參堿抑制SMMC-7721細胞增殖的研究.上海第二醫科大學學報,2002,22:512-514.
[6] 王兵,王國俊,徐均.氧化苦參堿對腫瘤誘導血管內皮細胞增殖的抑制作用.實用腫瘤雜志,2000,15:297-300.
[7] Bodey B,Bodey B Jr,Siegel SE,et al.Immunocytochemical detection of the expression of members of the matrix metalloproteinase family in adenocarcinomas of the pancreas.In Vivo,2001,15:71-76.
[8] Yancopoulos GD,Davis S,Gale NW,et al.Vascular specificgrowth factors and blood vessel formation.Nature,2000,407:242-248.
[9] Ellenrieder V,Adier G,Gress TM.Invasion and metastasis in pancreatic cancer.Ann Oncol, 1999,10:46-50.
[10] Yang X,Staren ED,Howard JM,et al.Invassiveness and MMP expression in pancreatic carcinoma.J Surg Res,2001,98:33-39.
[11] Itakura J,Ishiwata T,Friess H,et al.Enhanced expression of vascular endothelial growth factor in human pancreatic cancer correlates with local disease progression.Clin Cancer Res,1997,3:1309-1316.
[12] Matsuyama Y,Takao S,Aikou C,et al.Comparison of matrix metalloproteinase expression between primary tumors with or without liver metastasis in pancreatic and colorectal carcinomas.J Surg Oncol,2002,80:105-110.
[13] Karayiannakis AJ,Bolarmki H,Syrigos KN,et al.Serum Vascular endothelial growth factor levels in pancreatic cancer patients correlate with advanced and metastatic disease and poor prognosis.Cancer Lett,2003,194:119-124.
2010-10-18)
(本文編輯:呂芳萍)
InfluenceofoxymatrineonmetastaticandinvasiveabilityofhumanpancreaticcancercelllineSW1990
LIFei,XIELi-qun,JIRun-li,ZHOUJing,ZHENGYan-min,LIUCai-ju,DUANZe-xin.
FirstDepartmentofInternalMedicine,XinjiangProductionandConstructionCorpHospitalofChinesepeople′sArmedPoliceForce,Urumqi830063,China
Correspondingauthor:XIELi-qun,Email:xieliqun66@hotmail.com
ObjectiveTo investigate the effect and mechanism of oxymatrine on invasion and metastasis of human pancreatic cancer line SW1990 in vitro.MethodsHuman pancreatic cancer cell line SW1990 was cultured in vitro. Oxymatrine was added into the culture media of SWl990 cells. Then MTT assay was used to determine the effect on proliferation. The adhesive capability, the mobile ability and invasive ability of SWl990 cells were detected by the adhesion assay, the crossing-river test, the transwell migration assay and the matrigel invasion method, respectively. RT-PCR was used to detect the mRNA expression of MMP-2 and VEGF. ELISA method was used to detect the protein levels of the VEGF.ResultsThe growth of SWl990 cells was inhibited by oxymatrine in a dose and time-dependent manner. After 2 mg/ml of oxymatrine treatment for SW1990 cells for 1 h, the adhesive capability inhibitory rate was (35.23±8.56) %; 24 h later, crossing-river time was (65.46±4.25) h, which was significantly longer than that in control group [(34.50±4.12) h,P<0.05)], the number of penetrating cells was 91.9±9.6, which was significantly lower than that in control group (144.2±17.2,P<0.05). The mRNA expression of MMP-2 and VEGF, expression of protein of VEGF in SW1990 cells was significantly down-regulated [0.515±0.063vs. 0.817±0.054, 0.343±0.072vs. 0.650±0.068; (265.50±5.45) pg/mlvs. (441.06±16.70) pg/ml,P<0.05].ConclusionsOxymoron can inhibit the invasion and metastasis ability of pancreatic cancer line SW1990 in vitro, and the mechanism is possibly related to the down-regulation of MMP-2 and VEGF expression.
Pancreatic neoplasms; Oxymatrine; Neoplasm invasiveness; Neoplasm metastasis
10.3760/cma.j.issn.1674-1935.2011.03.008
青島市科技基金項目(2008-wszo1003)
830063 烏魯木齊,新疆武警兵團指揮部醫院內一科(李飛);武警醫學院附屬醫院消化內科(謝立群、冀潤利、周靜、鄭艷敏、劉彩菊、段澤新)
謝立群,Email:xieliqun66@hotmail.com

