脂氧素A4對肝細胞生長因子誘導HepG2肝癌細胞血管生成相關細胞因子表達的影響
周曉燕, 王紅梅, 蔡震宇, 徐方云, 黃永紅, 朱 俊, 吳 萍, 葉篤筠
(1南昌大學醫學院病理生理系,江西 南昌 330006;2華中科技大學同濟醫學院病理生理系,湖北 武漢 430030 )
脂氧素A4對肝細胞生長因子誘導HepG2肝癌細胞血管生成相關細胞因子表達的影響
周曉燕1,2△, 王紅梅1, 蔡震宇1, 徐方云1, 黃永紅1, 朱 俊1, 吳 萍2, 葉篤筠2
(1南昌大學醫學院病理生理系,江西 南昌 330006;2華中科技大學同濟醫學院病理生理系,湖北 武漢 430030 )
目的探討脂氧素A4(LXA4)對肝細胞生長因子(HGF)誘導的HepG2肝癌細胞血管生成相關細胞因子表達的影響。方法體外培養HepG2肝癌細胞,實驗分為空白組、HGF處理組、HGF+LXA4處理組、HGF+脂氧素受體激動劑BML-111處理組。RT-PCR檢測脂氧素受體(ALX)表達情況,Western blotting檢測COX-2、MMP-2、MMP-9、IκBα和NF-κB p65的表達量,ELISA檢測TNF-α、IL-1β、VEGF和TGF-β分泌水平, 熒光素酶報告質粒檢測NF-κB轉錄活性。結果HepG2肝癌細胞表達ALX,LXA4和BML-111下調COX-2、 MMP-2和MMP-9,抑制TNF-α、IL-1β、VEGF和TGF-β分泌,并且干擾NF-κB轉位及其轉錄活性。結論脂氧素抑制HGF誘導HepG2肝癌細胞表達血管生成相關細胞因子,包括VEGF、COX-2、TNF-α、IL-1β、TGF-β、MMP-2及MMP-9,此效應可能通過干擾NF-κB活化實現。
脂氧素; 血管生成; 細胞因子類
新近報道,非甾體抗炎藥抑制肝癌細胞增殖、誘導凋亡并干擾其侵襲和轉移過程[1-3]。脂氧素(lipoxins, LXs) 已被證實是炎癥反應的重要“剎車信號” ,對多種炎癥細胞的功能和炎癥相關基因的表達具有廣泛調節作用[4]。更有趣的是:阿司匹林可以誘導LXs合成[5];同時,肝臟內含有豐富的LXs前體[6],并且肝臟損傷時可以檢測到大量LXs生成[7]。但是,迄今為止,LXs對肝癌有何影響無人報道。我們前期研究結果提示LXs抑制CoCl2誘導內皮細胞形成血管[8], 而血管形成是腫瘤生長和轉移的生物學基礎, 為此本文觀察了LXs及其受體激動劑5(S),6(R),7-三羥基庚酸甲酯[5(S), 6(R), 7-trihydroxyheptanoic acid methyl ester, BML-111]對肝細胞生長因子(hepatocyte growth factor,HGF)誘導的HepG2肝癌細胞血管生成相關細胞因子表達的影響。
材 料 和 方 法
1材料
RPMI-1640培養基為Gibco產品;胎牛血清購自浙江三利生物制品廠;LXA4和BML-111購自Cayman;重組HGF購自Sigma;腫瘤壞死因子α(tumor necrosis factor α,TNF-α)、白細胞介素1β (interleukin 1β, IL-1β)、 轉化生長因子 β (transforming growth factor β, TGF-β)和血管內皮細胞生長因子(vascular endothelial growth factor, VEGF)檢測試劑盒均購自武漢博士德公司;脂氧素受體(lipoxin A4 receptor,ALX)、基質金屬蛋白酶-2(matrix metalloproteinase-2, MMP-2)和基質金屬蛋白酶-9 (MMP-9)、環氧合酶-2(cyclooxygenase-2, COX-2)、核因子-κB(nuclear factor-κ-gene binding, NF-κB) p65、IκBα(inhibitory protein of NF-κB)Ⅰ抗購自Santa Cruz;Trizol和Lipofectamine 2000購自Invitrogen; 逆轉錄試劑、熒光素酶檢測試劑盒和β-半乳糖苷酶檢測試劑盒購自Promega; NF-κB熒光素酶報告質粒為Clontech產品。
2材料
2.1細胞培養與分組 人肝癌細胞株HepG2(購自中國科學院上海生命科學研究院生物化學與細胞生物學研究所)用RPMI-1640培養液培養在6孔培養板中,培養液中加入10%胎牛血清、1×105U/L青霉素和1×105U/L鏈霉素,細胞培養在37 ℃﹑5% CO2培養箱中。按實驗設計將培養細胞分成3組:(1)空白對照組:用生理鹽水處理作為空白對照組;(2)HGF處理組:20 μg/L HGF處理細胞;(3) LXA4處理組:20 μg/L HGF與不同劑量LXA4或BML-111共同處理細胞。檢測HepG2肝癌細胞表面是否表達ALX時,HEK293細胞被用作陰性對照細胞。
2.2RT-PCR檢測脂氧素受體ALX表達 采用Trizol法提取各樣品總RNA,測定濃度定量后取4 μg進行逆轉錄。然后取1μL逆轉錄產物進行PCR反應。ALX上游引物為5’-CACCAGGTGCTGCTGGCAAG-3’,下游引物為5’-AATATCCCTGACCCCATCCTCA-3’。PCR反應條件為95 ℃預變性5 min,94 ℃ 30 s,57 ℃ 60 s,72 ℃ 1 min,循環30次,最后72 ℃ 10 min。產物于2%瓊脂糖凝膠電泳后照相并圖像分析。
2.3免疫印跡法檢測MMP-2、MMP-9、COX-2, IκBα和NF-κB p65表達水平 嚴格按照細胞裂解液說明書分別提取胞漿蛋白或核蛋白,BCA法測定蛋白濃度。取40 μg蛋白樣品(檢測MMP-2、MMP-9、COX-2和IκBα用胞漿蛋白,檢測NF-κB p65用核蛋白)煮沸變性后,10%聚丙烯酰胺凝膠電泳,電轉移至硝酸纖維素膜上,置于5%脫脂奶粉中室溫封閉1 h。加入稀釋的MMP-2、MMP-9、COX-2、IκBα和NF-κB p65 Ⅰ抗4 ℃溫育過夜,TBST洗膜,置1∶8 000稀釋的辣根過氧化物酶標記的Ⅱ抗中37 ℃溫育1 h,TBST洗膜。將膜與ECL反應5 min后,曝光于X光膠片上,顯影、定影,掃描后圖像分析。
2.4ELISA檢測TNF-α、IL-1β、TGF-β和VEGF分泌水平 各組細胞處理預設時間后收集培養上清,按照說明書依次加入樣品或標準品、生物素化抗體、酶結合物工作液、顯色液、顯色終止液,最后酶標儀450 nm測A450值。
2.5報告質粒熒光素酶檢測 24孔板細胞長至80%密度時,轉染NF-κB報告質粒或空載體,并同時轉染β-半乳糖苷酶報告質粒作為內參照, 6 h后更換培養液并加入刺激劑,溫育24 h。棄培養液,加入裂解液,將裂解產物轉入離心管渦旋振蕩15 s后4 ℃ 12 000×g離心2 min, 取上清液加入熒光素酶檢測試劑檢測熒光素酶活性,另取一部分上清液與β-半乳糖苷酶檢測試劑混勻,溫育 3 h后420 nm測β-半乳糖苷酶活性。
3統計學處理
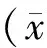
結 果
1脂氧素受體ALX表達于HepG2肝癌細胞
如圖1顯示,陰性對照組未檢測到ALX表達;而空白對照組HepG2細胞可以檢測到ALX表達,并且HGF可以上調ALX。

Figure 1. The expression of lipoxin A4 receptor(ALX) in HepG2 cells. HEK293 cell line denoted the negative control. A:electrophoretogram of ALX mRNA; B:quantitative representation of the ratio of ALX to β-actin ±s.n=3.▲▲P<0.01 vs control group.
2脂氧素對HGF誘導HepG2細胞表達COX-2,MMP-2和MMP-9的影響
Western blotting 結果表明,HGF誘導COX-2、MMP-2和MMP-9的表達,而LXA4和BML-111明顯抑制此效應,見圖2。

Figure 2. Effects of LXA4 and BML-111 on HGF-induced COX-2, MMP-2 and MMP -9 expression in HepG2 cells.A:Western blotting analysis of COX-2,MMP-2 and MMP-9 protein expression;B:quantitative representation of the ratio of COX-2,MMP-2 and MMP-9 to β-actin. ±s.n=3.##P<0.01 vs control group; ▲▲P<0.01 vs HGF group.
3脂氧素對HGF誘導HepG2細胞分泌TNF-α、IL-1β、VEGF和TGF-β的影響
ELISA結果提示,LXA4和BML-111抑制HGF誘導HepG2肝癌細胞分泌TNF-α、IL-1β、VEGF和TGF-β,見圖3。

Figure 3. Effects of LXA4 and BML-111 on HGF-induced TNF-α, IL-1β(A), VEGF and TGF-β secretion(B) in HepG2 cells.s.n=5.##P<0.01 vs control group;▲P<0.05, ▲▲P<0.01 vs HGF group.
4脂氧素對HGF誘導HepG2細胞IκBα和NF-κBp65的影響
結果顯示,LXA4和BML-111抑制HGF誘導HepG2肝癌細胞IκBα降解、NF-κB轉位及其轉錄活性,見圖4。

Figure 4. Effects of LXA4 and BML-111 on HGF-induced IκBα degradation, NF-κB translocation(A) and NF-κB transcriptional activity(B) in HepG2 cells. ±s.n=3.## P<0.01 vs control group; ▲▲P<0.01 vs HGF group.
討 論
血管新生主要依賴于促血管生成因子的作用, 其中VEGF特異性最高、作用最強, 在刺激因素的作用下, 其表達增強并促進血管新生[9,10]。血管新生還需要MMP-2和MMP-9等降解血管基底膜和細胞外基質蛋白,它們的降解對血管生成所必須的內皮細胞遷移極為重要。為此, 本文觀察了LXA4和BML-111對HGF誘導HepG2細胞促進新生血管形成起重要作用的幾種細胞因子的影響,包括: VEGF、COX-2、TNF-α、IL-1β、TGF-β、MMP-2和MMP-9。
VEGF直接刺激血管內皮細胞分裂增殖, 最直接地參與促進血管生成。多種細胞因子誘導VEGF高表達,包括: TNF-α[11]、 IL-1β[12]、COX-2[13]、TGF-β[14]等,而且, 這些細胞因子自身也參與新生血管形成。本研究結果提示:(1)LXA4和BML-111抑制HGF誘導HepG2細胞表達VEGF(圖3), 即其可以干擾血管生成的直接誘導因素; (2) LXA4和BML-111下調HGF誘導MMP-2和MMP-9表達(圖2),即干擾血管生成的間接誘導因素;(3) LXA4和BML-111減少HGF誘導HepG2細胞分泌TNF-α、IL-1β、COX-2和TGF-β(圖2、3)。
VEGF基因的啟動子區域存在NF-κB調節序列, 持續活化NF-κB可引起VEGF異常高表達。而且,其它血管生成相關細胞因子, 包括TNF-α、IL-1β、COX-2、TGF-β、MMP-2和MMP-9的表達均受到NF-κB的調控。靜息狀態時,NF-κB以無活性的形式與其抑制性蛋白IκBα結合存在于胞漿中; 在相應刺激的作用下,IκBα被磷酸化而降解,NF-κB才能由胞漿移位至胞核從而啟動相關基因的轉錄。即IκBα是NF-κB 的抑制性蛋白,其降解水平直接影響NF-κB的轉位水平和轉錄活性。為此, 本文觀察了脂氧素對HGF誘導HepG2細胞NF-κB轉位、轉錄活性及IκBα降解的影響。結果顯示:LXA4和BML-111抑制HGF誘導HepG2細胞IκBα降解、NF-κB轉位及其轉錄活性(圖4)。
綜上所述, LXA4和BML-111可以直接和間接地抑制肝癌血管新生, 此效應可能通過抑制NF-κB活化而實現。本研究提示脂氧素是干擾肝癌生長和轉移的潛在藥物。
[1] Rahman MA, Dhar DK, Masunaga R, et al. Sulindac and exisulind exhibit a significant antiproliferative effect and induce apoptosis in human hepatocellular carcinoma cell lines[J]. Cancer Res, 2000, 60(8): 2085-2089.
[2] Abiru S, Nakao K, Ichikawa T, et al. Aspirin and NS-398 inhibit hepatocyte growth factor-induced invasiveness of human hepatoma cells[J]. Hepatology, 2002, 35(5):1117-1124.
[3] 吳偉江,李曉紅,任先達,等. 非甾體類抗炎藥對荷瘤小鼠肝癌的促凋亡作用[J]. 中國病理生理雜志, 2003, 19(8): 1074 -1078.
[4] 張 力, 萬敬員, 葉篤筠. 脂氧素與炎癥消退[J]. 生命的化學, 2004, 24(1): 61-63.
[5] Clària J, Serhan CN. Aspirin triggers previously undescribed bioactive eicosanoids by human endothelial cell-leukocyte interactions[J]. Proc Natl Acad Sci USA, 1995, 92(21): 9475-9479.
[6] Titos E, Chiang N, Serhan CN, et al. Hepatocytes are a rich source of novel aspirin-triggered 15-epi-lipoxin A4[J]. Am J Physiol, 1999, 277(5 Pt 1): C870-C877.
[7] Titos E, Claria J, Planaguma A, et al. Inhibition of 5-lipoxygenase-activating protein abrogates experimental liver injury: role of Kupffer cells[J]. J Leukoc Biol, 2005, 78(4): 871-878.
[8] Liu SJ, Wu P, Ye DY, et al. Effects of lipoxin A4on CoCl2-induced angiogenesis and its possible mechanisms in human umbilical vein endothelial cells[J]. Pharmacology, 2009, 84(1):17-23.
[9] 張允嶺,劉 超,劉雪梅,等.心腦舒通膠囊對局灶性腦缺血再灌注大鼠皮層VEGF、VEGFR2 mRNA表達的影響[J].中國病理生理雜志,2010,26(3):587-589.
[10]肖隆斌,吳文輝,劉其龍.17-二甲基胺乙基-17-去甲氧基格爾德霉素對人胃癌裸鼠移植瘤血管內皮生長因子表達的抑制作用[J].中國病理生理雜志,2010,26(8):1489-1493.
[11]Nabors LB, Suswam E, Huang Y, et al. Tumor necrosis factor alpha induces angiogenic factor up-regulation in malignant glioma cells: a role for RNA stabilization and HuR[J]. Cancer Res, 2003, 63(14): 4181-4187.
[12]Vinores SA, Xiao WH, Zimmerman R, et al. Upregulation of vascular endothelial growth factor(VEGF) in the retinas of transgenic mice overexpressing interleukin-1beta(IL-1beta) in the lens and mice undergoing retinal degeneration[J]. Histol Histopathol, 2003, 18(3):797-810.
[13]Wu G, Luo J, Rana JS, et al. Involvement of COX-2 in VEGF-induced angiogenesis via P38 and JNK pathways in vascular endothelial cells[J]. Cardiovasc Res, 2006, 69(2):512-519.
[14]Shih SC, Claffey KP. Role of AP-1 and HIF-1 transcription factors in TGF-beta activation of VEGF expression[J]. Growth Factors, 2001, 19(1):19-34.
EffectsoflipoxinA4onhepatocytegrowthfactor-inducedangiogenesis-relatedcytokinesinHepG2cells
ZHOU Xiao-yan1, 2, WANG Hong-mei1, CAI Zhen-yu1, XU Fang-yun1, HUANG Yong-hong1, ZHU Jun1, WU Ping2, YE Du-yun2
(1DepartmentofPathophysiology,MedicalCollegeofNanchangUniversity,Nanchang330006,China;2DepartmentofPathophysiology,TongjiMedicalCollege,HuazhongUniversityofScience&Technology,Wuhan430030,China.E-mail:xyn_zhou@yahoo.cn)
AIM: To explore the possibility that lipoxin A4(LXA4) regulates the expression of angiogenesis-related cytokines in HepG2 cells induced by hepatocyte growth factor(HGF).METHODSThe HepG2 cells were divided into control group, HGF treatment group, HGF+LXA4treatment group and HGF+BML-111(an agonist of lipoxin A4receptor) treatment group. The expression of lipoxin A4receptor in HepG2 cells was measured by RT-PCR. The protein levels of COX-2, MMP-2, MMP-9, IκBα and NF-κB p65 in the cells were determined by Western blotting. The release of TNF-α, IL-1β, VEGF and TGF-β in the supernatants of the cell culture was examined by ELISA. The activity of NF-κB transcription in HepG2 cells was tested by transfection and luciferase activity assay.RESULTSThe expression of lipoxin A4receptor was detected in HepG2 cells. LXA4and BML-111 were able to down-regulate HGF-induced production of COX-2, MMP-2 and MMP-9. The secretion of TNF-α, IL-1β, VEGF and TGF-β was also decreased. Furthermore, LXA4and BML-111 restrained HGF-induced IκBα degradation, NF-κB translocation, and the transcriptional activity of NF-κB in HepG2 cells.CONCLUSIONLXA4is able to inhibit HGF-induced angiogenesis-related cytokines, including VEGF, COX-2, TNF-α, IL-1β, TGF-β, MMP-2 and MMP-9, by inhibition of NF-κB activation.
Lipoxin; Angiogenesis; Cytokines
R364.5
A
10.3969/j.issn.1000-4718.2011.02-017
1000-4718(2011)02-0300-04
2010-07-08
2010-11-30
△通訊作者 Tel:0791-6360562; E-mail: xyn_zhou@yahoo.cn

