大鼠不同時(shí)期乳腺組織中雌激素孕激素及催乳素的變化規(guī)律
江青東,程會(huì)昌
(鄭州牧業(yè)工程高等專科學(xué)校動(dòng)物醫(yī)學(xué)系,河南 鄭州450011)
研究表明,雌激素在孕酮協(xié)同作用下,可增加乳腺細(xì)胞的孕酮受體數(shù)目,來(lái)促進(jìn)乳腺小葉腺泡的發(fā)育[1-5]。孕酮主要作用是促進(jìn)乳腺小葉及腺泡的發(fā)育,在雌激素刺激乳腺導(dǎo)管發(fā)育的基礎(chǔ)上,能使乳腺得到充分發(fā)育。催乳素主要作用是促進(jìn)乳腺發(fā)育、啟動(dòng)和維持泌乳[6-7]。在雌激素、孕激素及其他激素的共同作用下,促使乳腺發(fā)育;使乳腺小葉終末導(dǎo)管發(fā)展成為小腺泡,進(jìn)而為哺乳作準(zhǔn)備。同時(shí)隨著妊娠的進(jìn)行,催乳素與其受體的結(jié)合率增加,且可對(duì)其受體數(shù)量進(jìn)行調(diào)控,來(lái)促進(jìn)乳腺的發(fā)育及啟動(dòng)和維持泌乳。關(guān)于這3種激素相應(yīng)受體的研究報(bào)道較少,零星的研究主要集中在乳腺癌。本文在對(duì)不同時(shí)期大鼠乳腺組織中雌激素、孕激素和催乳素水平的變化進(jìn)行較系統(tǒng)試驗(yàn),豐富動(dòng)物乳腺發(fā)育調(diào)控理論,為用神經(jīng)內(nèi)分泌調(diào)控手段改善動(dòng)物泌乳提供理論參考。
1 材料與方法
1.1 實(shí)驗(yàn)動(dòng)物及樣品采集 SD大鼠,購(gòu)自河南省實(shí)驗(yàn)動(dòng)物中心,體重250g。在12h光照和12h黑暗的條件下喂養(yǎng),環(huán)境溫度20℃~25℃,自由采食和飲水。大鼠料購(gòu)自河南省實(shí)驗(yàn)動(dòng)物中心。根據(jù)陰道涂片決定發(fā)情周期的不同階段,于發(fā)情前期處女鼠與雄性大鼠進(jìn)行同籠飼養(yǎng)(1∶2),雌雄合籠后次日上午在陰道涂片中發(fā)現(xiàn)精子者定為妊娠第1天(d1),妊娠鼠單個(gè)飼養(yǎng),分別于6d,12d,18d處死大鼠;分娩的當(dāng)天看作泌乳0d,分別于6d,12d,18 d處死大鼠;另外處死處女鼠;每組6只。處死大鼠后取乳腺組織入液氮速凍,后置-80℃冰箱保存待測(cè)。
1.2 試劑和儀器 BSA蛋白、考馬斯亮藍(lán)G-250、乙醇、雌激素、孕激素及催乳素放免藥盒(購(gòu)自北京北方生物技術(shù)研究所);勻漿器、離心機(jī)、752紫外分光光度計(jì),SN-695型智能放免γ測(cè)量?jī)x,液氮罐,-80℃冰箱等。
1.3 組織勻漿液的制備 取適宜大小的組織塊,立即稱重后于生理鹽水(1~2mL)中于勻漿器中制成勻漿,4℃,12 000r/min離心20min,取上清液置-20℃待測(cè)。
1.4 勻漿液中蛋白質(zhì)含量的測(cè)定 采用考馬斯亮藍(lán)染色法測(cè)定蛋白質(zhì)濃度,考馬斯亮藍(lán)在一定蛋白質(zhì)濃度范圍內(nèi),蛋白質(zhì)和染料結(jié)合符合比爾定律 ,因此可以通過(guò)測(cè)定染料在595nm處光吸收的增加量得到與其結(jié)合的蛋白質(zhì)量。
標(biāo)準(zhǔn)曲線制作:取11支試管,按照表1依次加入試劑,搖勻,5min后測(cè)定各管OD595nm,并蛋白質(zhì)濃度為橫坐標(biāo),以O(shè)D595nm值為縱坐標(biāo),在坐標(biāo)紙上繪制標(biāo)準(zhǔn)曲線。
未知樣品蛋白質(zhì)濃度的測(cè)定:測(cè)定方法同上,取合適的未知樣品體積于2支干凈試管中,按上法測(cè)定OD595nm值,使其測(cè)定值在標(biāo)準(zhǔn)曲線的直線范圍內(nèi),根據(jù)所測(cè)定的OD595nm值,在標(biāo)準(zhǔn)曲線上查出其相當(dāng)于標(biāo)準(zhǔn)蛋白的量,從而計(jì)算出未知樣品的蛋白質(zhì)濃度(mg/mL)。

表1 標(biāo)準(zhǔn)曲線制作
1.5 放免分析 雌激素、孕激素及催乳素放免試劑盒(由北京北方生物技術(shù)研究所提供)包括:標(biāo)準(zhǔn)品(S0-S6:0~4 000μIU/mL)、兔抗-Prl抗體、125IPrl、驢抗兔免疫分離劑組成。樣本采用雙管重復(fù)測(cè)定,依照試劑盒說(shuō)明書(shū)進(jìn)行。用γ-計(jì)數(shù)器測(cè)定沉淀cpm數(shù),通過(guò)標(biāo)準(zhǔn)曲線換算勻漿液中雌激素、孕激素及催乳素的含量。
1.6 數(shù)據(jù)統(tǒng)計(jì)分析 根據(jù)勻漿液中蛋白質(zhì)濃度及放射免疫所測(cè)E2、P及Prl含量的結(jié)果,將樣本中E2、P及Prl的含量換算成pg/mg蛋白單位。所有數(shù)據(jù)均用X+SD表示,并采用SPSS 13.0統(tǒng)計(jì)軟件進(jìn)行數(shù)據(jù)整理和統(tǒng)計(jì),多組間比較用方差分析F檢驗(yàn),組間兩兩比較用SNK檢驗(yàn)。
2 結(jié)果
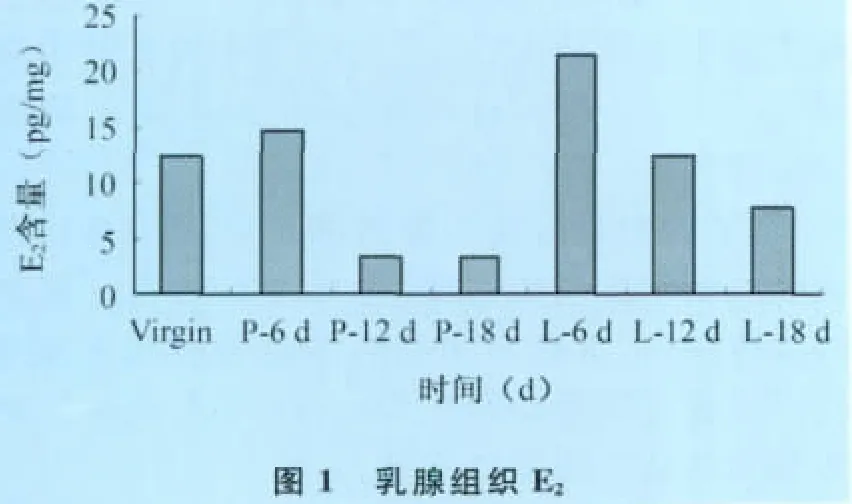
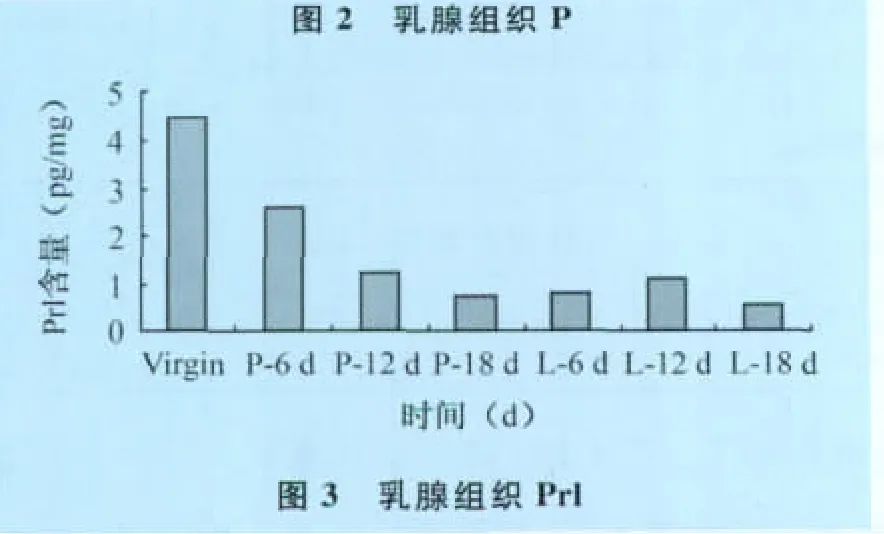
乳腺組織中E2、P及Prl含量:不同時(shí)期大鼠乳腺組織中E2、P及Prl的含量見(jiàn)表2。

表2 不同時(shí)期大鼠乳腺組織中E2、P及Prl含量 (n=6)
乳腺組織中:E2水平在處女期較高,分娩后,乳腺中E2水平又急劇升高,但整個(gè)泌乳期也呈逐漸下降趨勢(shì),且維持在基本接近處女期水平。結(jié)果顯示,E2從處女期到整個(gè)妊娠期,其呈現(xiàn)下降趨勢(shì)。而在分娩后E2水平急劇升高,后又有所下降,但維持在較高水平;P水平以處女期最高;隨著妊娠開(kāi)始,P水平逐漸下降,直至泌乳期18d降到最低。結(jié)果顯示,在乳腺發(fā)育的不同時(shí)期,P在乳腺組織中的整體水平一直呈現(xiàn)下降趨勢(shì);Prl水平以處女期最高;隨著妊娠的進(jìn)行逐漸降低。結(jié)果顯示,整個(gè)乳腺發(fā)育過(guò)程中Prl整體上幾乎一直呈現(xiàn)下降趨勢(shì)。

3 討論
成年動(dòng)物的乳腺一生中要經(jīng)歷發(fā)情周期中的增生和凋亡周期[8]。青春期雌激素可促進(jìn)乳腺導(dǎo)管發(fā)育,孕酮促進(jìn)乳腺腺泡的發(fā)育[9]。同時(shí)成年動(dòng)物乳腺在動(dòng)情期中的周期性生長(zhǎng)也需Prl起作用,以保證乳腺對(duì)雌激素和孕酮的反應(yīng)性[10]。從試驗(yàn)結(jié)果中可以看出,雌激素在促進(jìn)乳腺發(fā)育及維持泌乳方面具有重要作用。青春期雌激素直接刺激導(dǎo)管發(fā)育,孕激素刺激上皮細(xì)胞DNA合成和腺泡發(fā)育[11-12]。本試驗(yàn)結(jié)果也發(fā)現(xiàn),隨著乳腺發(fā)育的不同時(shí)期,其E2的水平也發(fā)生了相應(yīng)的變化。且變化模式與理論報(bào)道一致。P在雌激素刺激乳腺導(dǎo)管發(fā)育的基礎(chǔ)上,它能使乳腺得到較為充分的發(fā)育。試驗(yàn)表明,切除垂體的去勢(shì)大鼠,其乳腺完全缺乏對(duì)孕酮的反應(yīng)。本試驗(yàn)結(jié)果發(fā)現(xiàn),在乳腺發(fā)育的不同時(shí)期,P的水平也發(fā)生了相應(yīng)的變化,尤其在妊娠期P水平明顯高于其余各時(shí)期,也充分體現(xiàn)了P在與其他激素相互作用下促進(jìn)乳腺發(fā)育和維持妊娠方面發(fā)揮了重要作用。且其變化模式與理論報(bào)道基本上一致。Prl在乳腺發(fā)育、啟動(dòng)泌乳和維持泌乳中都起著重要的作用,它協(xié)同卵巢類(lèi)固醇激素(E2和P4)促進(jìn)乳腺小葉腺泡的生長(zhǎng)和上皮細(xì)胞的增殖,妊娠末期,Prl通過(guò)發(fā)動(dòng)乳蛋白基因的表達(dá)來(lái)控制乳腺發(fā)育。本試驗(yàn)結(jié)果表明,Prl水平在處女期和泌乳期變化基本一致,而在妊娠期變化不完全吻合此結(jié)論與理論報(bào)道呈負(fù)相關(guān)。
[1] Leung B S,Potter A H,Qureshi S.Interaction of prolactin,estrogen and progesterone in a human mammary carcinoma cell line CAMA-1ICell growth and thymidine uptake[J].J Steroid Biochem,Dec,2001,15:421-427.
[2] Leung B S,Potter A H,Qureshi S.Interaction of prolactin,estrogen and progesterone in a human mammary carcinoma cell line CAMA-1ICell growth and thymidine uptake[J].J Steroid Biochem,Dec,2003,15:421-427.
[3] Strange R,Metcalfe T,Thackray L,etal.Apoptosis in normal and neoplastic mammary gland development[J].J Microsc Res Tech,2001,52(2):171-181.
[4] Schams D,Russe I,Schallenberger E,etal.The role of steroid hormones,prolactin and placental lactogen on mammary gland development in ewes and heifers[J].J Endocrinol,1998,102(1):121-130.
[5] Thordarson G,Villalobos R,Colosi P,etal.Lactogenic response of cultured mouse mammary epithelial cells to mouse placental lactogen[J].J.Endocr,2003,109:263-274.
[6] 王建元.空懷奶山羊誘導(dǎo)泌乳的研究[J].中國(guó)獸醫(yī)科技,1988,28(3):13-15.
[7] 王建元.催乳素及影響催乳素分泌的藥物[J].國(guó)外獸醫(yī)學(xué):畜禽疾病,1984,11:1-5.
[8] Bocchinfuso W P,Lindzey J K,Hewitt S C,etal.Induction of mammary gland development in estrogen receptor-alpha knockout mice[J].J Endocrinology,2000,141(8):2982-2994.
[9] Moon R C,Griffith D R,Turner C W.Normal and experimental growth of rat mammary gland[J].J Proc Soc Exp Biol Med,1959,101:788-790.
[10]CowieA T,Tindal J S,Yokoyama A.The induction of mammary growth in hypophysectomized goat[J].J Endocr,1998,34:185-195.
[11]Olsson H,Jernstrom H,Alm P,etal.Proliferation of the breast epithelium in relation to menstrual cycle phase,hormonal use,and reproductive factors[J].J Breast Cancer Res Treat,2001,40(2):187-196.
[12]Shyamala G,Chou Y C,Louie S G,etal.Cellular expression of estrogen and progesterone receptors in mammary glands:regulation by hormones,development and aging[J].J Steroid Biochem Mol Biol,2002,80(2):137-148.

