鹵化物在合成亞硫酸金鹽溶金過程中的作用
馬彩蓮,袁守謙,張 良,李東亮
(西安建筑科技大學理學院,陜西西安 710055)
鹵化物在合成亞硫酸金鹽溶金過程中的作用
馬彩蓮,袁守謙,張 良,李東亮
(西安建筑科技大學理學院,陜西西安 710055)
用離子交換膜電解法研究了金在Na2SO3溶液中加入Cl-、Br-后的陽極溶解機理。結果表明,在Na2SO3溶液中加入Cl-和Br-后,由于競爭配位作用可以加快金的溶解速率。Br-在陽極表面被氧化生成初生態Br2,Br2可以快速氧化陽極金從而更有效地抑制SO32-氧化,有利于獲得高純度Na3Au(SO3)2溶液。
亞硫酸金鹽;鹵化物;離子交換膜;金溶解;電解
引 言
表面鍍金已被廣泛應用于電子元器件、通訊器材、金飾品、紀念品及工藝品等的制造領域。氰化金鉀是目前鍍金使用最多的金鹽,其生產和使用過程均對環境造成嚴重污染[1]。隨著2002年國家經貿委和2005年國家發改委在全國淘汰含氰電鍍令的貫徹落實[2-3],必將選擇性能穩定、質量可靠的無氰鍍金試劑來代替劇毒氰化金鉀。在多種無氰鍍金試劑中,經過長期實驗和試用[4],亞硫酸金鹽最有希望替代劇毒的氰化金鉀。
目前國內外生產亞硫酸金鹽均使用傳統的化學法生產工藝,即王水法溶金、亞硫酸鹽還原并配位的生產方法[5]。該生產過程需要消耗大量的酸和還原劑,其工藝流程長、原材料消耗多、環境污染嚴重、生產成本高,特別是生產過程中產生的副產品(如氯化鈉、氯化鉀、硫酸鈉、硫酸鉀等)難以分離,導致產品純度極低,如目前市售液體亞硫酸金鈉中金的質量分數為5%,固體產品中金的質量分數最高為20%(相當于亞硫酸金鈉僅為43.26%,其余均為氯化物和硫酸鹽等雜質)。
離子交換膜電解合成法已成功應用于高純氰化金鈉的制備[6],但該技術無法簡單地移植到制備亞硫酸金鈉的生產過程中。NaCN的化學穩定性好,是金的優良配位劑,而 Na2SO3的還原能力強,化學穩定性差,與金的配位能力較差,在電解制備母液、濃縮結晶過程中易與金離子發生氧化還原反應,導致制備過程失敗。因此電化學合成法制備亞硫酸金鈉具有一定的挑戰性。
本文重點討論離子交換膜電解法合成亞硫酸金鹽過程中如何防止Na2SO3的氧化,以及金的快速溶解等問題。
1 實驗部分
1.1 儀器與材料
自制兩室兩電極電解槽,陽離子交換膜將陰極室與陽極室隔開,陽極(工作電極)為99.99%金,陰極(輔助電極或對電極)分別為鉑、石墨或不銹鋼;直流穩壓電源(WYJ-302型,江蘇省淮陰市儀器儀表有限公司);電熱恒溫水浴(HH-4型,北京科偉儀器有限公司);酸度計(PHS-25型,上海精密科學儀器有限公司);飽和甘汞電極(232型,上海精密科學儀器有限公司);直流數字式電壓表(SX1831,蘇州電訊儀器廠);電位差計(UJ34A,上海電工儀器廠)。
所用試劑亞硫酸鈉、氯化鈉、溴化鈉及氫氧化鈉等均為分析純,西安試劑廠或天津科密歐化學試劑有限公司。
1.2 實驗方法
以10%Na2SO3、5%NaOH做為陽極和陰極電解液,分別放入陰極室和陽極室,在恒溫條件下調節電壓,觀察電流變化和陽極金的溶解情況。
1.3 工作電壓的測定
用數字式電壓表測定陰陽極間的電位差,并用飽和甘汞電極作為參比電極測量工作電極電位,兩相比較其差值不超過0.1V。考慮到本實驗的電壓范圍較寬,故采用數字式電壓表直接測定陰陽極間的電位差作為工作電壓。
2 結果與討論
2.1 合成亞硫酸金鈉的方法簡述
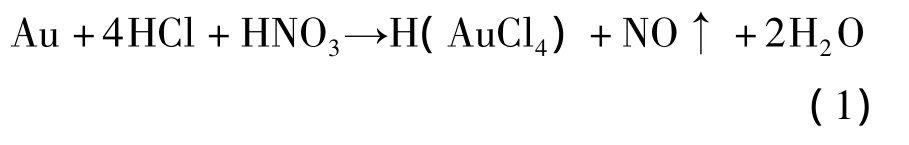
化學法生產亞硫酸金鈉一般采用王水溶金,向H(AuCl4)溶液中加入適量的Na2SO3,發生如下反應:
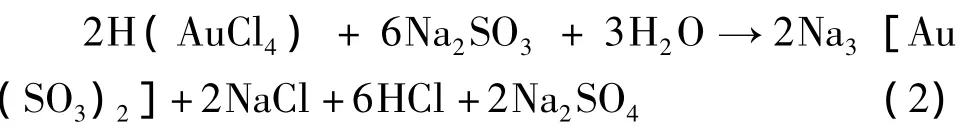
反應過程中,Na2SO3將Au(Ⅲ)還原為Au(Ⅰ),并與Au(Ⅰ)配位形成相對穩定的Na3[Au(SO3)2]。但同時,Na2SO3又可將Au(Ⅲ)還原為Au,如何防止Au(Ⅲ)被還原為Au,成為制備固體亞硫酸金鈉的關鍵因素。從上述反應還可看出,在生成目標產物Na3[Au(SO3)2]的同時,還生成雜質 NaCl和Na2SO4,只有反復重結晶才能獲得較純凈的Na3[Au(SO3)2]。反復重結晶又增加了單質金析出的風險,因此傳統的化學法工藝難以生產出高純度的亞硫酸金鈉,不能實現工業化生產。
離子交換膜電解法是采用純金作為陽極,亞硫酸鹽作為陽極液,以鉑、石墨或不銹鋼作為陰極材料,通直流電后金陽極溶解生成亞硫酸金鹽。所涉及的主要反應為:
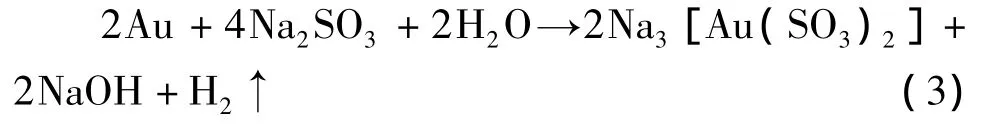
電解過程中,陽離子交換膜隔開電解槽的陰陽兩室,金作為陽極而溶解,并與陽極液配位劑生成目標產品。合成過程不消耗濃硝酸、鹽酸等,且通過離子交換膜及時從陽極室分離出作為雜質的鈉離子,從而保證了產品的純度。其中,陽極金的溶解與陽極液的配位行為是電解合成的重點。
2.2 金在亞硫酸鈉陽極液中的溶解行為
以適當質量分數的Na2SO3作為陽極液,5%NaOH溶液為陰極液,電解過程中陽極金溶解并絡合生成Na3[Au(SO3)2],考察不同的因素對金溶解行為的影響。
2.2.1 亞硫酸鈉對金溶解的影響
控制陽極液θ為40℃,pH=8,配制不同質量分數的Na2SO3溶液測定金的陽極溶解伏安曲線,結果如圖1所示。
從圖1可以看出,w(Na2SO3)在5% ~15%范圍內,都能實現金的溶解,而且隨著電位正移,電流不斷增大,當電位超過4.8 V,vs SCE后,電流的增勢趨緩。
電解過程中的陰極反應為:

陽極反應為:
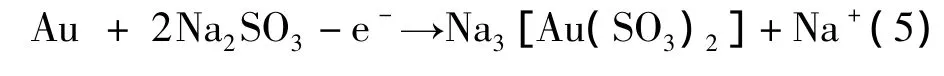
生成的雜質離子Na+穿過陽離子膜進入陰極液,與OH-結合生成NaOH,為獲得純凈的Na3[Au(SO3)2]陽極液創造了條件,實驗發現,金的陽極溶解電流效率僅為10%,遠低于理論溶金量,而且陽極液的pH顯著下降。原因是由于Na2SO3的還原能力較強,能在陽極液中被氧化成Na2SO4:
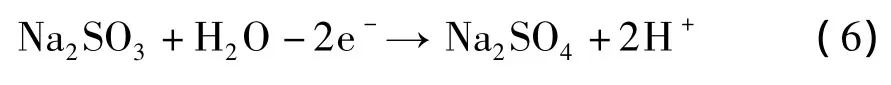
該反應的發生將導致陽極液pH降低,酸度增大,引起陽極液中的雜質升高。分析認為,采用單一Na2SO3溶液作為陽極液,金的溶解效率太低,亞硫酸金鹽溶液的質量分數不高。
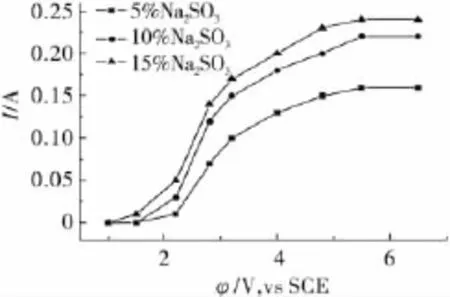
圖1 陽極溶解伏安曲線
2.2.2 溫度對金溶解的影響
對pH=8的10%Na2SO3溶液做不同溫度下金的陽極溶解伏安曲線,結果如圖2所示。由圖2可見,陽極溶解電流隨溫度的升高而增大,電解過程中各溫度下陽極液的pH均顯著下降,說明上述的副反應式(6)均不可避免。
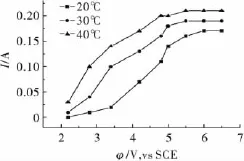
圖2 不同溫度下的陽極溶解伏安曲線
2.2.3 pH 對金溶解的影響
考察了10%Na2SO3陽極液在40℃、不同pH下金的陽極溶解情況。結果發現,當pH<7時,陽極液中有海綿金生成,此時可能發生了如下反應:
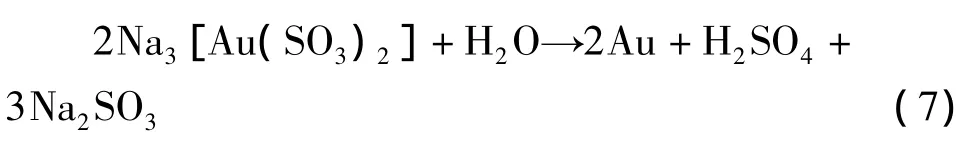
這說明Na3Au(SO3)2在酸性溶液中不穩定,電解過程應控制pH≥8。
2.2.4 陰極材料對金溶解的影響
先后考察了鉑、石墨棒及不銹鋼陰極材料對電解過程的影響,結果發現,陰極材料對金的溶解影響不大,考慮到工業應用,選擇不銹鋼作為陰極材料。
2.3 Cl-對金溶解的影響
2.3.1 氯化鈉對金溶解的影響
控制適當的溫度,在10%Na2SO3陽極液中加入一定量的NaCl,考察不同w(NaCl)對金溶解的影響,結果見圖3。從圖3中可以看出,在陽極電位相同時,電流隨w(NaCl)的增加而增大。與圖1相比,加入NaCl可以增加陽極溶解電流即金的溶解速率明顯增大,陽極電流效率達到15%,說明Cl-離子以某種形式參與了電極反應。
在電解過程中,用淀粉碘化鉀試紙在陽極附近未檢出Cl2,因此可以認為Cl-離子是通過競爭配位參與電解反應的。在陽極附近,由于Cl-離子半徑小于SO32-而優先擴散到金表面,與Au+反應生成[AuCl2]-擴散到本體溶液中,配體 Cl-被 SO32-取代:
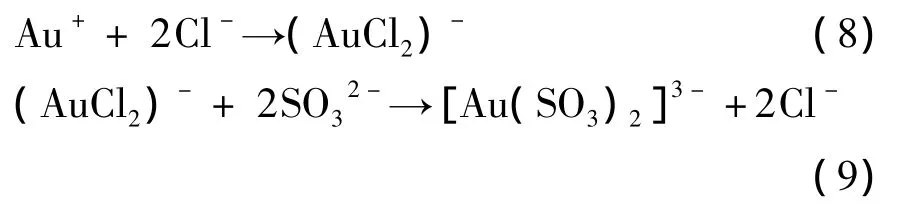
可以看出,Cl-離子的競爭配位作用有利于金的溶解。
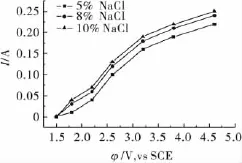
圖3 金在添加w(NaCl)中的陽極溶解伏安曲線
2.3.2 pH 對金溶解的影響
在Cl-催化溶金過程中,pH影響 Na3[Au(SO3)2]的還原穩定性,由于SO32-的存在,在酸性溶液中仍然無法防止反應式(7)的發生,因此電解過程仍應控制pH≥8。
2.4 Br-對金溶解的影響
2.4.1 w(Br-)對金溶解的影響
控制適當的溫度,在10%Na2SO3陽極液中加入一定量的NaBr,考察不同w(NaBr)對金溶解的影響,結果見圖4。從圖4中可以看出,在陽極電位相同時,電流隨w(NaBr)的增加而增大,與圖1和圖3相比,加入NaBr同樣可以增加陽極溶解電流,即金的溶解速率明顯增大,陽極溶解電流效率達到30%以上,較NaCl的助溶效果要好。
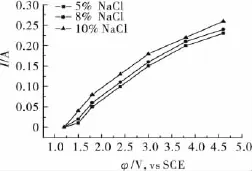
圖4 金在添加w(NaBr)中的陽極溶解伏安曲線
在電解過程中,由于Br-離子半徑小于SO32-而優先擴散到金表面,與Au+反應生成(AuBr2-):
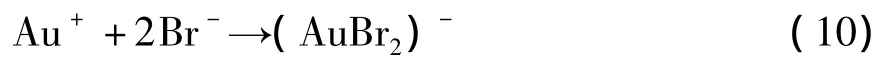
Au(Ⅰ)的亞硫酸鹽配合物比溴配合物穩定得多,其穩定常數約為1030[7]。陽極液中的SO32-很容易取代(AuBr2)-中的Br-離子:
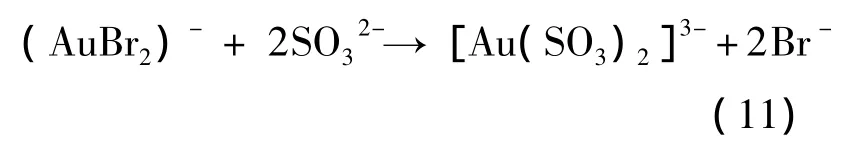
該反應的平衡常數K≈1017[8],上述取代反應進行得很完全。Br-離子的競爭配位作用有利于金的溶解。
實驗發現電解過程中陽極液顏色由無色變成橙紅色,經分析確證是溴水的顏色,即在電解過程中有單質溴生成:

Br2是一種較強的氧化劑,加之(AuBr2)-的穩定常數 logβ2=12.46[7],生成的 Br2立即與金反應生成[AuBr2]-:
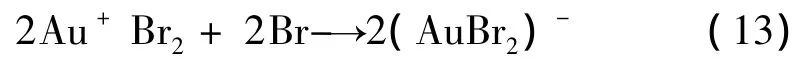
生成的(AuBr2)-再通過反應式(11)生成[Au(SO3)2]3-。動力學研究表明式[9],反應式(13)的活化能約為24.85 kJ/mol,反應速率很快。比較 φoCl2/Cl-=1.360 V和 φoBr2/Br-=1.077 4 V可知[10],Br-更易在陽極氧化,由此,在加入 Br-的電解液中,陽極上既有Au的氧化,又有Br-的氧化,而Br-氧化生成的Br2導致Au的化學溶解,使得金的陽極溶解電流效率增大,電流密度升高,因此Br-以及Br2對金的溶解均有促進作用。
由于動力學方面的差異,盡管 φoBr2/Br-=1.077 4 V較φoSO42-/SO32-=0.157 6 V[10]正得多,仍然有部分Br-被氧化,因而減緩了SO32-離子的氧化,能減少硫酸鹽雜質的生成。
2.4.2 pH 對金溶解的影響
考察了10%Na2SO3和5%NaBr陽極液在40℃、不同pH下金的陽極溶解情況。結果發現,當pH<5時,陽極液中有海綿金生成,此時發生的同樣是反應式(7)。說明有NaBr存在下Na3[Au(SO3)2]穩定性有所提高。實驗還發現,w(NaBr)越高,不會析出海綿金所允許的pH越低。另一方面,溶液的pH過高,會發生Br2的歧化而不利于金的溶解。綜合分析,電解過程中控制pH=8~10為佳。
2.4.3 溫度對金溶解的影響
對pH=8、10%Na2SO3和5%NaBr的陽極液做不同溫度下金的陽極溶解實驗,結果發現,電流隨陽極液溫度的升高而增大,金的溶解速率加快,當陽極液θ超過40℃時,陽極液pH顯著下降,說明副反應式(6)加快,溶液中硫酸鹽雜質增加。
2.4.4 Br2單質的去除
為了獲得高純度的Na3Au(SO3)2陽極液,必須脫除反應中生成的單質Br2。嘗試了多種除溴方法,其中簡單而有效的是CCl4萃取法,Br2的脫除率達到99.5%,完全滿足后續工藝對陽極液純度的要求。
3 結論
1)以適當質量分數的Na2SO3作為陽極液,5%NaOH溶液為陰極液,純金為陽極,不銹鋼為陰極,用陽離子交換膜將陽極室和陰極室分隔,可以電解生成Na3Au(SO3)2。在金溶解的同時伴有Na2SO3的氧化,金的陽極溶解電流效率不足10%,且陽極液中含有Na2SO4等雜質。
2)在Na2SO3陽極液中加入Cl-離子有助于金的溶解,其機理為:Cl-離子優先擴散到金表面與Au(I)配位生成(AuCl2)-,(AuCl2)+與 SO32-發生配體取代生成[Au(SO3)2]3-。加入 Cl-離子能加快金的溶解,但陽極液中的Cl-離子難以去除。
3)在Na2SO3陽極液中加入Br-離子能顯著加快金的溶解,其機理除具有與Cl-離子類似的競爭配位作用外,Br-離子在陽極放電生成的初生態Br2能快速氧化金使之溶解。溴的雙重催化作用使金的電解效率達到30%以上。
4)溴催化溶金法能減少雜質Na2SO4的生成,殘余Br2能用CCl4萃取脫除,該方法能獲得較高純度的[Au(SO3)2]3-陽極液,為制備高純固體 Na3[Au(SO3)2]創造了條件。
(5)陽極液pH是影響電解過程的重要因素,其pH=8~10較佳。
[1]何建平.無氰電鍍工藝的研究現狀及解決問題的途徑[J].電鍍與涂飾,2005,24(7):25-28.
[2]張峰,肖耀坤.無氧鍍金工藝及其展望[C].2007年全國電子電鍍學術年會暨綠色電子制造技術論壇論文集.上海:上海電子電鍍學會,2007:23.
[3]Morrissey,Ronald J.A versatile non-cyanide gold plating system[J].Plating and Surface Finishing 1993,80(4):9-75.
[4]Diao Jianyuan,Liu Yibiao,Zhang Hui,et al.Method of preparing a gold sodium sulfite complex(claimed)for non-cyanide gold plating:Chnia,CN101734708-A[P].2010-06-16.
[5]張東山.金鹽生產技術研究[J].黃金,2003,(24)5:5-6.
[7]余建民.貴金屬化合物及配合物合成手冊[M].北京:化學工業出版社,2009:52,97.
[8]李東亮.銀金鉑的性質及其應用[M].北京:高等教育出版社,1998:34.
[9]puddephatt R J.金的化學[M].陜西科學技術出版社,1992:63.
[10]大連理工大學無機化學教研室.無機化學[M].北京高等教育出版社,2007:694-697.
Function of Halides in Gold Dissolution Process of Au(Ⅰ)-sulfite Synthesizing
MA Cai-lian,YUAN Shou-qian,ZHANG Liang,LI Dong-liang
(College of Science,Xi'an University of Architecture & Technology,Xi'an,710055,China)
Mechanism of gold anodic dissolution was studied by adding Cl-,Br-into sodium sulfite solution through ion-exchange membrane electrolysis.Results indicated that gold dissolution rate in Na2SO3solution was enhanced due to the competitive coordinate function of Cl-and Br-.On anode surface,Brwas easy to be oxidized to nascent Br2which could oxidize the gold quickly,so oxidation of SO32-was inhibited and high purity Na3Au(SO3)2solution was obtained effectively.
Au(Ⅰ)-sulfite;halide;ion-exchange membrane;gold dissolution;electrolysis
TQ153.18
A
1001-3849(2011)09-0042-05
2011-05-16
2011-06-14
西安市科技局基金項目CXY09022(4)

