十四烷基芳基磺酸鹽在大慶油砂上的吸附性能
董志龍 丁 偉 劉 坤 張志偉 曲廣淼 于 濤
(東北石油大學化學化工學院,黑龍江大慶163318)
十四烷基芳基磺酸鹽在大慶油砂上的吸附性能
董志龍 丁 偉*劉 坤 張志偉 曲廣淼 于 濤
(東北石油大學化學化工學院,黑龍江大慶163318)
利用靜態吸附實驗研究了實驗室自制的三種高純度十四烷基芳基磺酸鹽在大慶油砂上的吸附規律,并考察了吸附時間,吸附溫度及磺酸鹽、NaCl、NaOH、正丁醇的濃度對吸附量的影響.結果表明:吸附量隨著磺酸鹽濃度的增大逐漸增加后趨于平穩,隨著吸附溫度和正丁醇體積濃度的降低、NaCl和NaOH濃度的增加而增大;磺酸鹽活性劑的三種同分異構體中,隨兩部分碳鏈長度趨于均等,吸附量下降,且受助劑的影響變小.吸附熱力學研究表明,十四烷基芳基磺酸鹽在油砂上的吸附等溫線服從Langmuir等溫方程,并且計算得到的各參數均能很好地反映磺酸鹽在油砂上的吸附特征.吸附動力學研究表明,Elovich方程能夠更好地描述吸附量隨時間的變化情況.
烷基芳基磺酸鹽;助劑;固/液吸附;吸附熱力學;吸附動力學
1 引言
我國的主要油田已先后進入超高含水期開發階段,部分油田采出液含水率已達98%以上.1為提高現有油田的采收率,三次采油技術得到日益廣泛的應用.烷基芳基磺酸鹽是目前三元復合驅油主要使用的表面活性劑.近年來俞稼鏞、2趙宇、3丁偉4等分別合成了純度較高、結構明確的烷基芳基磺酸鹽,并對其表(界)面性質做了大量的研究;俞稼鏞5-7和李宗石8,9等研究了支鏈烷基苯磺酸鹽結構對表面性能的影響;Wade等10以苯為原料精細合成了結構明確的烷基苯磺酸鹽,并研究了分子結構與油/水界面性能的關系.表面活性劑結構和性質關系的研究一直為人們所關注,11,12疏水鏈類型和結構對其性質影響的研究也有了更多進展.13,14表面活性劑在巖石礦物上的吸附是引起其滯留的一個主要原因,15在地層中吸附會降低驅油段塞中表面活性劑的濃度,破壞所篩選的驅油配方,影響驅油效率.但以往的研究16,17多為不同結構表面活性劑組分的混合物在固體上的吸附,不能準確反映出疏水鏈結構對其性質的影響.
本文研究了十四烷基芳基磺酸鹽的結構,吸附溫度及磺酸鹽、NaCl、NaOH和正丁醇的濃度對表面活性劑在油砂上吸附量的影響,以期為尋求最佳驅油配方和探索吸附機理提供依據.
2 實驗部分
2.1 試劑與儀器
十四烷基芳基磺酸鹽為實驗室自制,18,19兩相滴定法20測定其純度均大于98.0%,濁度法21測定其Krafft點均小于10.0°C,滴體積法22測定其在水溶液中的表面張力與濃度對數曲線均無最低點,其分子結構式如圖1所示,代號分別為MΦC14-3S、MΦC14-5S和MΦC14-7S(其中:MΦ代表甲苯;14代表烷基鏈碳原子個數;3、5、7分別代表芳環連接在碳鏈的第3、5、7位碳原子上;S代表磺酸鈉).NaCl、NaOH、正丁醇、三氯甲烷、硫酸、陽離子表面活性劑海明1622(天津市科密歐試劑廠)、混合指示劑(美國SIGM公司)均為分析純;實驗用水為石英亞沸二次蒸餾水;大慶油田儲層天然巖心分別經苯和乙醇/水(體積比為3:1)溶液抽提,烘干粉碎后過篩的油砂(粒徑0.25-0.149 mm),其主要組成(質量分數)為:石英39.52%,斜長石26.37%,鉀長石25.11%,方解石0.75%,白云石0.27%.

圖1 十四烷基芳基磺酸鹽分子結構式Fig.1 Structure of tetradecyl aryl sulfonates
KDC型電子可控沉淀器(廣東會城無線電廠); CHA-S型氣浴恒溫振蕩器(常州市國華儀器廠).
2.2 實驗方法
油砂用自來水沖洗至中性,再用去離子水沖洗,水洗后的油砂在去離子水中按吸附量測定條件浸泡,離心所得清液用兩相滴定法滴定,未發現空白干擾.
稱取油砂(精確至0.0001 g)置于250 mL錐形瓶中,加入適量蒸餾水浸潤12 h,按一定液固比加入配制好的各磺酸鹽溶液,放入45°C氣浴恒溫振蕩器中振蕩一定時間至吸附平衡,將試樣移入離心管,在轉速為500 r·min-1的條件下離心分離30 min,取上部清液用兩相滴定法測定磺酸鹽的平衡濃度,同樣測定吸附前空白樣的濃度作為初始濃度,由兩者之差計算吸附量Γ,計算公式為:

式中,Γ為每克油砂吸附磺酸鹽的毫克數(mg·g-1);C為磺酸鹽的平衡濃度(mg·L-1);C0為磺酸鹽的初始濃度(mg·L-1);V為實驗所用磺酸鹽溶液的體積(mL);M為油砂的質量(g).
2.3 液固比和吸附平衡時間的確定
,23將液固質量比定為50:1,吸附時間定為28 h,以確保充分吸附.
3 結果與討論
3.1 時間對吸附量的影響
在45°C下,磺酸鹽質量濃度為1000 mg·L-1時,三種磺酸鹽異構體的吸附動力學曲線如圖2所示.從圖2中可以看出,磺酸鹽在油砂上的吸附動力學具有共同特征,即:在吸附初期,吸附量隨時間增加較快,曲線較陡;吸附后期,吸附量隨時間增加較慢,曲線較為平緩,最終達到吸附平衡.分段解析這些吸附動力學曲線,將曲線分為快、中、慢反應三段,說明從時間角度看,油砂表面存在著高、中、低能量的吸附點位.24
常用的吸附動力學模型分析方程有:一級反應動力學方程(lnΓ=a+kt)、雙常數速率方程(lnΓ=a+ klnt)和Elovich方程(Γ=a+klnt).其中,Γ為單位質量的油砂對磺酸鹽的吸附量(mg·g-1);t為吸附時間(h);a為與初始濃度有關的常數;k為與吸附活化能有關的吸附速率常數.25將磺酸鹽在油砂表面吸附動力學實驗結果進行擬合,得到結果如表1所示.

圖2 三種磺酸鹽異構體的吸附動力學曲線Fig.2 Adsorption dynamical curves of three sulfonate?s isomers
從表1可以看出,Elovich方程和雙常數速率方程均能很好地描述磺酸鹽活性劑在油砂上的吸附動力學特征.但從相關系數來看,Elovich方程對這三種磺酸鹽活性劑吸附動力學特征描述更為準確,相關系數r2達到0.9855-0.9929之間.這表明吸附動力學不是一個簡單的一級反應,而是由反應速率和擴散因子綜合控制的過程.因此Elovich方程能夠更好地描述吸附量隨時間的變化情況.
3.2 溫度對吸附量的影響
以MΦC14-5S為例,考察了不同溫度下吸附量隨溫度的變化,結果如圖3所示.從圖3中可以看出,磺酸鹽活性劑吸附量隨溫度的升高而降低.這是因為吸附是一個放熱過程,升高溫度使脫附易于進行,從而降低了磺酸鹽的吸附量.
從圖3中可以看出,吸附曲線均符合Langmuir吸附規律,吸附量隨濃度的增加迅速上升,到某濃度后吸附達到平衡.將等溫線數據代入Langmuir直線吸附方程式:
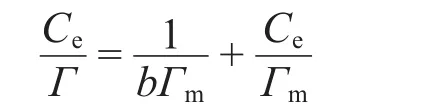
式中Ce為磺酸鹽的平衡濃度(mg·L-1);Γ為吸附量(mg·g-1);Γm為單分子飽和吸附量(mg·g-1);b為與吸附能量有關的常數.
由Ce/Γ對Ce作圖的直線斜率和截距計算出各溫度下的Langmuir常數,即Γm和b,通過線性回歸,用Langmuir吸附等溫式進行擬合,結果如圖4所示.
從圖4中可以看出,擬合相關系數r2均大于0.98,線性關系良好,說明能夠很好地符合Langmuir直線方程.由以下公式26,從不同溫度下的Γm和b值計算出焓變ΔH,結果列于表2.

表1 磺酸鹽在油砂表面吸附動力學方程擬合參數值Table 1 Fitting parameters of adsorption dynamical equation by sulfonates adsorbed on oil sands
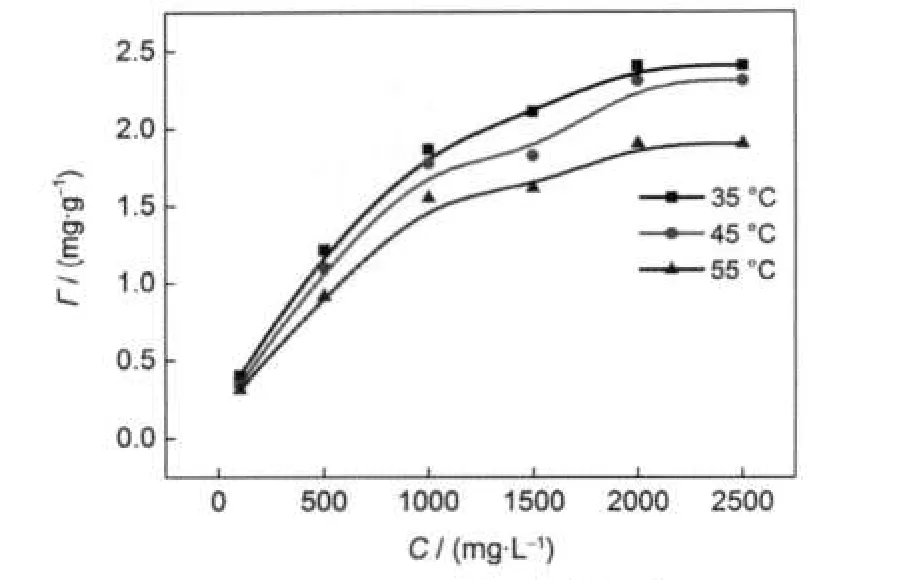
圖3 MΦC14-5S的吸附等溫線Fig.3 Adsorption isotherms of MΦC14-5S

圖4 Ce/Γ對Ce的關系曲線Fig.4 Relation curves of Ce/Γ vs CeCe:equilibrium concentration of sulfonates
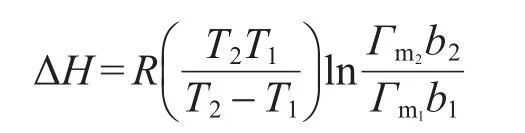
上式中ΔH為焓變(kJ·mol-1);R為摩爾氣體常數;T為絕對溫度(K);下標1、2對應不同的溫度.
溫度升高,飽和吸附量減小,說明吸附過程是放熱過程,這與吸附焓變是負值的結果一致.在吸附劑和吸附質恒定前提下,溫度35-45°C的焓變要大于溫度45-55°C的,說明溫度越高越不利于吸附,且影響趨勢變大.
3.3 磺酸鹽活性劑濃度對吸附量的影響
在45°C下,不同濃度磺酸鹽對吸附量的影響結果如圖5所示.從圖5中可以看出,三種同分異構的磺酸鹽在油砂上的吸附量均隨磺酸鹽溶液濃度的增大先增大后趨于平穩.這是因為隨表面活性劑濃度的增大,表面活性劑在油砂表面由單分子層吸附形成聚集使吸附量增大;當表面活性劑濃度繼續增大時,溶液中存在的大量膠束對油砂表面的油質具有增溶作用,從而將油質溶出進入液相,使油砂對表面活性劑的吸附趨于平衡.
3.4 NaCl濃度對吸附量的影響
在45°C下,磺酸鹽質量濃度為1000 mg·L-1時,不同濃度NaCl對吸附量的影響結果如圖6所示.從圖6中可以看出,隨著NaCl濃度的增加,吸附量逐漸增大,后趨于平衡.這是因為一方面無機鹽離子的存在壓縮界面雙電層,被吸附的磺酸鹽活性劑離子間斥力減小,排列得更加緊密;另一方面可降低磺酸鹽活性劑的臨界膠束濃度,從而有利于吸附進行.因無機鹽的加入引起的吸附量增大是有限的,當無機鹽的濃度達到一定值后吸附量趨于恒定值.27

表2 MΦC14-5S在油砂上的吸附焓變Table 2 Enthalpy change of MΦC14-5S adsorption on oil sands

圖6 NaCl濃度對吸附量的影響Fig.6 Effects of NaCl concentrations on adsorption capacity
3.5 NaOH濃度對吸附量的影響
在45°C下,磺酸鹽質量濃度為1000 mg·L-1時,不同濃度NaOH對吸附量的影響結果如圖7所示.從圖7中可以看出,當體系中加入NaOH后,吸附量隨著堿含量的增加而增大,這可以解釋如下:由于油砂表面帶負電,而NaOH屬于強電解質,加大了磺酸鹽體系的離子強度,壓縮了膠束表面的雙電層,減小了膠束與油砂表面負電荷的靜電斥力; NaOH促進了磺酸鹽的疏水作用吸附,降低了磺酸鹽在水中的溶解度,使溶液中的磺酸鹽分子向固/液界面遷移,導致磺酸鹽在油砂表面的吸附量增大.此時,NaOH實際上起到了類似于鹽的作用,但對吸附量的影響要小于鹽.
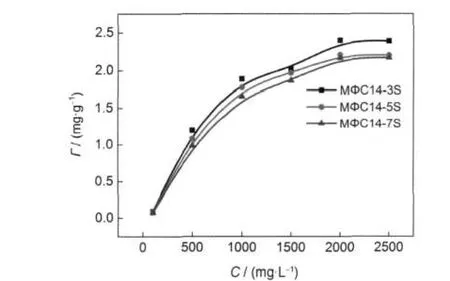
圖5 磺酸鹽濃度對吸附量影響Fig.5 Effects of sulfonate concentrations on adsorption capacity

圖7 NaOH濃度對吸附量的影響Fig.7 Effects of NaOH concentrations on adsorption capacity
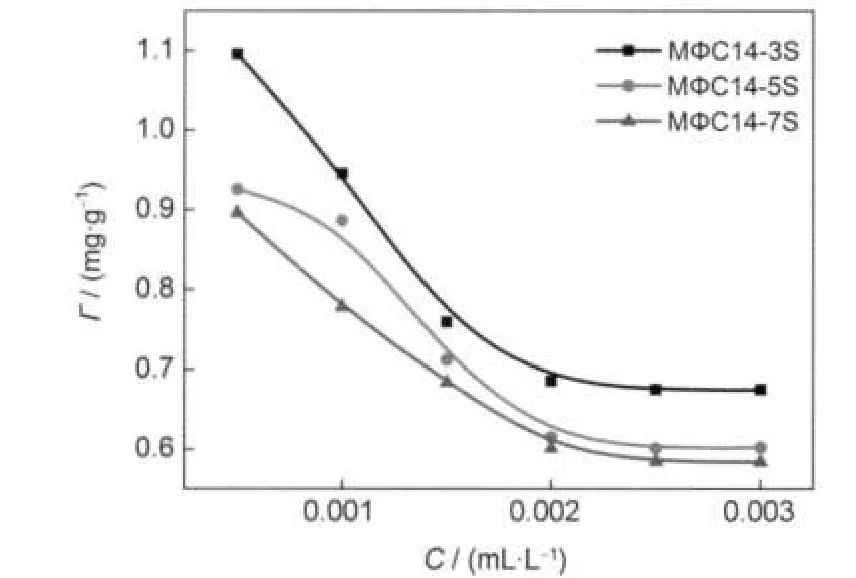
圖8 正丁醇體積濃度對吸附量的影響Fig.8 Effects of n-butanol volume concentrations on adsorption capacity
3.6 正丁醇濃度對吸附量的影響
在45°C下,磺酸鹽質量濃度為1000 mg·L-1時,不同體積濃度正丁醇對吸附量的影響結果如圖8所示.從圖8中可以看出,隨著正丁醇體積濃度的增加,磺酸鹽在油砂表面吸附量逐漸降低.這是由于當吸附體系中含有醇時,醇具有類似表面活性劑的雙親結構,使溶液的極性減弱,醇分子在油砂表面上與磺酸鹽發生競爭吸附,導致吸附量減小.28當正丁醇的體積濃度在一定范圍內時,吸附量不再發生明顯變化,且隨兩部分碳鏈長度趨于均等,吸附量穩定時所需要的正丁醇濃度減小.
3.7 磺酸鹽結構對吸附量的影響
芳基在烷基鏈上的位置變化對磺酸鹽在油砂上的吸附量也有影響.由圖5可看出,隨兩部分碳鏈長度趨于均等,吸附量減小,主要是由磺酸鹽的構效關系決定的,即隨著芳基向中間位置移動,導致支化程度增加,疏水基空間體積增大,因而導致吸附量減少.由圖6-8可見,在加入助劑后,磺酸鹽結構與吸附量之間仍保持這一規律,并且芳基位置越靠近烷基鏈的中間,受助劑的影響也越小.這是因為此時磺酸鹽的結構成為影響吸附量的主導因素,助劑的加入對吸附量的影響變小.23
4 結論
(1)Elovich方程能夠更為準確地描述三種磺酸鹽活性劑的吸附動力學特征,相關系數r2在0.9855-0.9929之間.表明吸附動力學不是一個簡單的一級反應,而是由反應速率和擴散因子綜合控制的過程.
(2)由吸附焓變為負可知,吸附是放熱過程.溫度35-45°C的焓變要大于溫度45-55°C的,說明溫度越高越不利于吸附,且影響趨勢變大.
(3)吸附量隨著磺酸鹽濃度的增大逐漸增加后趨于平穩,隨著正丁醇體積濃度的降低、NaCl和NaOH濃度的增加而增大.
(4)磺酸鹽活性劑的三種同分異構體中,隨著支化程度的增加,吸附量下降,且受助劑的影響變小.
(1)Yu,F.;Fan,W.Y.;Duan,Y.Z.;Li,S.P.;Nan,G.Z.Oilfield Chemistry 2007,24,347.[于 芳,范維玉,段友智,李水平,南國枝.油田化學,2007,24,347.]
(2) Jiang,X.M.;Zhang,L.;An,J.Y.;Zhao,S.;Yu,J.Y.Acta Phys.-Chim.Sin.2005,21,1426.[姜小明,張 路,安靜儀,趙 濉,俞稼鏞.物理化學學報,2005,21,1426.]
(3) Zhao,Y.Synthesis and Interfacial Properties of Pure Alkylbenzenesulfonates.Ph.D.Dissertation,Dalian University of Technology,Dalian,2006.[趙 宇.系列烷基苯磺酸鹽純化合物的合成及界面性能的研究[D].大連:大連理工大學, 2006.]
(4)Yu,T.;Liu,H.J.;Ding,W.;Qu,G.M.;Guo,S.J.Chinese Journal of Applied Chemistry 2008,25,1107. [于 濤,劉紅娟,丁 偉,曲廣淼,國勝娟.應用化學,2008,25,1107.]
(5)Wang,L.;Gong,Q.T.;Wang,D.X.;Zhao,S.;An,J.Y.;Yu,J. Y.Petrochemical Technology 2004,33,104. [王 琳,宮清濤,王東賢,趙 濉,安靜儀,俞稼鏞.石油化工,2004,33,104.]
(6)Gong,Q.T.;Jiang,X.M.;Wang,L.;Zhao,J.S.;Wang,D.X.; Zhang,L.;Zhao,S.;Yu,J.Y.Petrochemical Technology 2005, 34,122.[宮清濤,姜小明,王 琳,趙金生,王東賢,張 路,趙 濉,俞稼鏞.石油化工,2005,34,122.]
(7) Jiang,X.M.;Xu,Z.C.;Shi,F.Q.;An,J.Y.;Zhao,S.;Yu,J.Y. Fine Chemistry 2004,21,808.[姜小明,徐志成,史福強,安靜儀,趙 濉,俞稼鏞.精細化工,2004,21,808.]
(8) Zhang,S.B.;Qi,H.M.;Zhang,H.;Qiao,W.H.;Li,Z.S. Journal of Dalian Nationalities University 2005,7,15.[張樹彪,齊會勉,張 晗,喬衛紅,李宗石.大連民族學院學報, 2005,7,15.]
(9) Li,Z.G.;Qiao,W.H.;Li,Z.S.;Wang,X.N.Journal of Dalian University of Technology 2002,42,531.[李志剛,喬衛紅,李宗石,王秀娜.大連理工大學學報,2002,42,531.]
(10)Doe,P.H.;Emary,M.E.L.;Wade,W.H.J.Am.Oil Chem.Soc. 1978,55,505.
(11) Dahanayake,M.D.;Coben,A.W.;Rosen,M.J.Phys.Chem. 1986,90,2413.
(12) Hevalier,Y.Current Opinion in Colloids and Interface Science 2002,7,3.
(13) Keisuke,M.;Yoshikiyo,M.Current Opinion in Colloid and Interface Science 2003,8,227.
(14)Aksenenko,E.V.;Makievski,A.V.;Miller,R.;Fainerman,V.B. Colloids and Surfaces A:Physicochemical and Engineering Aspects 1998,143,311.
(15) Shan,C.L.;Zong,L.P.;Xu,Y.S.;Chen,J.;Wu,X.L.China Foreign Energy 2006,11,45. [單存龍,宗麗平,徐艷姝,陳 劼,伍曉林.中外能源,2006,11,45.]
(16) Peltonen,L.J.;Yliruusi,J.J.Colloid Interface Sci.2000,227,1.
(17)Lorenzo,M.D.;Vinagre,H.M.;Joseph,D.D.Colloids and Surfaces A:Physicochemical and Engineering Aspects 2001, 180,121.
(18)Ding,W.;Wang,R.;Yu,T.;Qu,G.M.;Wen,H.Y.Acta Petroleti Sinica(Petroleum Processing Section)2007,23,75. [丁 偉,王 瑞,于 濤,曲廣淼,溫海飛.石油學報(石油加工),2007, 23,75.]
(19)Qu,G.M.;Cheng,J.C.;Ding,W.;Yu,T.;Li,G.Q.Acta Petrolei Sinica(Petroleum Processing Section)2010,26,208. [曲廣淼,程杰成,丁 偉,于 濤,李國橋.石油學報(石油加工),2010,26,208.]
(20) Cross,J.Marcal Dekker 1998,45.
(21) Shinoda,K.;Masakata,H.J.Phys.Chem.1973,77,378.
(22) Zhao,G.X.;Zhu,B.Y.Principles of Surfactant Action;China Light Industry Press:Beijing,2003.[趙國璽,朱 瑤.表面活性劑作用原理.北京:中國輕工業出版社,2003.]
(23)Yu,T.;Tong,W.;Su,Y.B.;Ding,W.Chinese Journal of Applied Chemistry 2010,27,466.[于 濤,童 維,宿雅彬,丁 偉.應用化學,2010,27,466.]
(24) Zhao,G.Y.;Qin,Q.;Zhou,Q.Environmental Science and Technology 2006,29,84.[趙桂瑜,秦 琴,周 琪.環境科學與技術,2006,29,84.]
(25) Tu,C.Tropical and Subtropical Soil Science 1994,3,175. [涂 從.熱帶亞熱帶土壤科學,1994,3,175.]
(26)Yao,T.Y.;Yao,F.Y.;Li,J.S.Oil Drilling&Production Technology 2008,30,82.[姚同玉,姚風英,李繼山.石油鉆采工藝,2008,30,82.]
(27) Xiao,J.X.;Zhao,Z.G.Application Principle of Surfactant; Chemical Industry Press:Beijing,2002;pp 93-97. [肖進新,趙振國.表面活性劑應用原理.北京:化學工業出版社,2002: 93-97.]
(28) Wang,P.Y.;Xu,B.C.;Wang,J.The Synthesis,Property and Use of Surfactants;Chemical Industry Press:Beijing,2007;pp 174-179.[王培義,徐寶才,王 軍.表面活性劑——合成·性能·應用.北京:化學工業出版社,2007:174-179.]
July 19,2011;Revised:September 13,2011;Published on Web:September 20,2011.
Adsorption Performance of Tetradecyl Aryl Sulfonates on Oil Sand from the Daqing Oilfield
DONG Zhi-Long DING Wei*LIU Kun ZHANG Zhi-Wei QU Guang-Miao YU Tao
(Chemistry and Chemical Engineering School,Northeast University of Petroleum,Daqing 163318, Helongjiang Province,P.R.China)
Three tetradecyl aryl sulfonates of high purity were synthesized.Their static adsorption performance on oil sand from the Daqing oilfield was studied and the influence of adsorption time, adsorption temperature,concentrations of sulfonate,NaCl,NaOH,and n-butyl alcohol on the efficiency of adsorption were investigated.The experimental results show that with an increase in the concentrations of the sulfonates the adsorption capacity initially increased and then remained constant.The adsorption capacity increased with the addition of NaCl and NaOH while it decreased with the addition of n-butyl alcohol and the increase of temperature.In the structural isomer,upon moving the aryl from the terminal to the center of the long alkyl chain,the adsorption capacity decreased and the impact of the additive was reduced.Thermodynamic results show that the adsorption of tetradecyl aryl sulfonates onto oil sand could be well described by the Langmuir isotherm.The constants of each equation were calculated from the experimental data and indicated the characteristics of oil sand adsorption.The dynamic results showed that the adsorption capacity changing with time as described by the Elovich equation.
Alkyl aryl sulfonate;Additive;Solid/liquid adsorption;Adsorption thermodynamics; Adsorption dynamics
10.3866/PKU.WHXB20112767
?Corresponding author.Email:dingwei40@126.com;Tel:+86-459-6504071.
The project was supported by the National Major Technology Special Fund of China(2008ZX05011),National Key Basic Research Program of China (973)(2005CB221300),and Graduate Student Innovation Research Project of Heilongjiang Province,China(YJSCX2008-044HLJ).
國家重大科技專項基金(2008ZX05011)、國家重點基礎研究發展規劃項目(973)(2005CB221300)和黑龍江省研究生創新科研項目(YJSCX2008-044HLJ)資助
O642;O643

